基于数据挖掘的肥胖动物模型分析
祁木森 王 莉
1.辽宁中医药大学研究生学院,辽宁沈阳 110847;2.辽宁中医药大学附属医院治未病科,辽宁沈阳 110032
△辽宁中医药大学研究生学院2021级中医内科学在读硕士研究生
肥胖是机体内脂肪异常堆积的受多因素影响的一种慢性代谢性疾病,与糖尿病、高血压等慢性疾病的发生密切相关,已成为一种全球性“流行病”[1]。近年来,随着人们饮食结构的改变,肥胖症的患病率呈逐年上升趋势,约50%的成年人超重[2],对人类健康危害极大。预防和治疗肥胖是摆在人类面前亟须解决的问题。统计学数据显示,肥胖可诱发代谢综合征、2型糖尿病、脂代谢异常、高血压病、痛风、心脑血管等疾病[3]。为了科学防治肥胖,现阶段建立有效的肥胖动物模型成为重点。肥胖的动物模型选择包括哺乳动物和非哺乳动物。非哺乳动物包括斑马鱼、果蝇等。研究发现,果蝇作为肥胖模型有三大优势:①获取容易,研究成本低;②果蝇基因组中脂肪调控潜力大,且在全基因组筛选中发现大量额外的脂肪调节候选基因,可通过多种基因编辑工具进行干预;③寿命短,有利于研究在肥胖遗传过程中的机制[4-5]。果蝇作为研究脂质储存和脂质分解之间平衡的模型系统具有很大潜力,但由于非哺乳动物解剖和生理与人类仍不完全相似[6],这一类模型有局限性,而哺乳动物发病机制更接近人类。在哺乳动物中小鼠是肥胖建模中最常用的动物。
1 资料与方法
1.1 数据来源
在中国知网、万方和维普数据库中检索2012年1月1日至2022年12月30日运用肥胖动物造模的实验性期刊文献,中文检索式为“肥胖”“动物模型”;英文检索式为“Obesity”“Models,Animal”。
1.2 文献筛选标准
纳入标准:①选择研究肥胖症并成功造模的实验性文献;②造模完全(动物种类、造模方式、造模周期、成模标准、检测指标明确)且可获取全文的期刊文献。排除标准:①综述、学位论文、期刊、会议论文;②造模方式未明确阐述的文献;③肥胖合并其他病症或以肥胖作为合并症的文献。
1.3 统计学方法
提取文献中的实验动物种类、造模方式、造模周期、造模配比、成模标准、检测指标等信息汇总,运用Excel整理成肥胖动物造模基准数据库,并制作数据频次表格。动物种类、名称等均参照《实验动物与动物实验技术》[7]。
2 结果
2.1 文献检索结果
基于中英文检索式初步检索,知网625篇,万方1376篇,维普40篇,共计2041篇文献,基于文献筛选标准,并剔除重复文献以及无法获取全文的文献,共纳入204篇中文文献。
2.2 实验动物种类
筛选符合条件的204篇文献,统计得出共使用15种动物。其中,使用频率最高的为SD大鼠和C57BL/6J小鼠,其余实验动物种类总体分布情况见图1。高脂饮食诱导的肥胖可促使SD大鼠卵泡发育相关激素水平紊乱进而促使卵泡停止发育,其可能与IGF-1/PI3K/Akt信号通路激活有关[8],胡文等[9]研究也表明促性腺抑制激素会诱发SD大鼠糖代谢紊乱。C57BL/6J小鼠是常用的实验室多基因模型小鼠,近交系C57BL/6J小鼠因易发生严重肥胖、脂肪堆积、葡萄糖不耐受和中度胰岛素抵抗而被广泛用于肥胖模型[10]。大多数的C57BL/6J小鼠在高脂喂养后出现了肥胖症状,总体占比分布在60%左右,可能与小鼠自身个体差异、环境因素等相关。通常C57BL/6J小鼠血糖、血浆胰岛素、胰岛素抵抗水平和瘦素/脂联素比率在喂养6周龄时达到高峰,在这个时间段内,肝脏二肽基肽酶4抑制剂的表达在体重增加较多的小鼠中增加显著,与肝脏脂肪含量无关[11-12]。
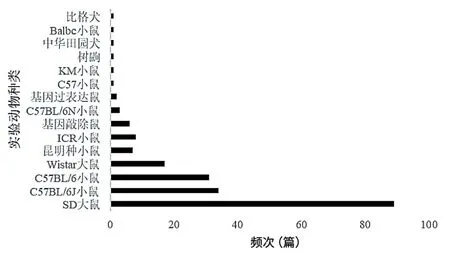
图1 实验动物种类总体分布情况
2.3 造模方式
将造模方式分为饮食、药物、手术或遗传造模4大类。饮食诱导中包含5小类,药物造模下含4小类,共细化为11种造模方式。出现频次最高的为饮食诱导(186,89.9%),其次是药物诱导(16,7.7%),手术造模(3,1.5%)及遗传模型(2,0.9%),见表1。

表1 肥胖模型造模方式
2.3.1 饮食造模 肥胖的诱因是能量摄入过多或者消耗过低。通过游翕等[10]总结表明食源性肥胖(diet-induced obesity,DIO)动物模型是最能模拟还原人体肥胖过程的方式,目前发病率较高的是营养性肥胖,营养性肥胖与人类肥胖发病过程相似性高,因此营养性肥胖造模是目前主流造模方式。造模方法是通过周期性喂养高脂饲料,增加体重,最终诱发肥胖症。数据库中的饮食诱导造模所选用的不同造模类型,依据造模方式分为高脂高糖饮食、高脂高糖饲料、高脂饮食、高脂饲料混合饲料五类。本文主要研究高脂高糖饮食和高糖高脂饲料,其中高脂高糖饮食采用蛋白15.4%+脂肪35.55%+碳水化合物49%,总供能4.8 kcal/g的配比方式;高糖高脂饲料采用58%基础饲料+30%绵白糖+10%猪大油+2%鸡蛋的配比方式。表2和表3分别统计了高脂饲料和高脂饮食的供能及成分配比并统计每种供能的频次。

表2 高脂饲料及高脂饮食供能配比

表3 高脂饲料及高脂饮食成分配比
2.3.2 化学诱导的给药方法 研究者[13]在总结归纳肥胖动物造模过程中发现药物诱导的占比仅次于饮食诱导,药物选择性多,大多通过肌内注射造模。区别于饮食造模简单易行,药物造模同比周期较短,操作频次少。总结出用药频次变化见表4,发现谷氨酸钠的剂量从1.6~4.0 g/kg均有报道,单次给药3~4 g/kg频次最高。谷氨酸钠诱导肥胖在肥胖动物造模中应用最广。主要原理是谷氨酸钠损伤了下丘脑弓状核饮食中枢,造成摄食及能量代谢紊乱,引起体型肥胖。研究表明,腹腔注射谷氨酸钠或金硫葡萄糖诱导肥胖的机制是下丘脑损伤,高剂量谷氨酸钠迅速消减刺鼠关联蛋白神经元(Agouti-related protein,AgRP)神经元,诱导中枢神经系统伸长细胞生殖,损伤下丘脑弓状核及其邻近区域,导致胰岛素抵抗,诱发肥胖[14]。根据实验验证,谷氨酸钠破坏小鼠弓状核,促生长激素释放激素分泌减少,动物往往生长缓慢且体型相对较小[15],且谷氨酸钠造模小鼠脏器质量及体积都显著降低。金硫葡萄糖损伤下丘脑腹内侧核,诱导过度进食造成肥胖。其作用机制尚不明确,金硫葡萄糖用量较大且价格高昂,对小鼠造成损害不可逆,因此应用较少[16]。
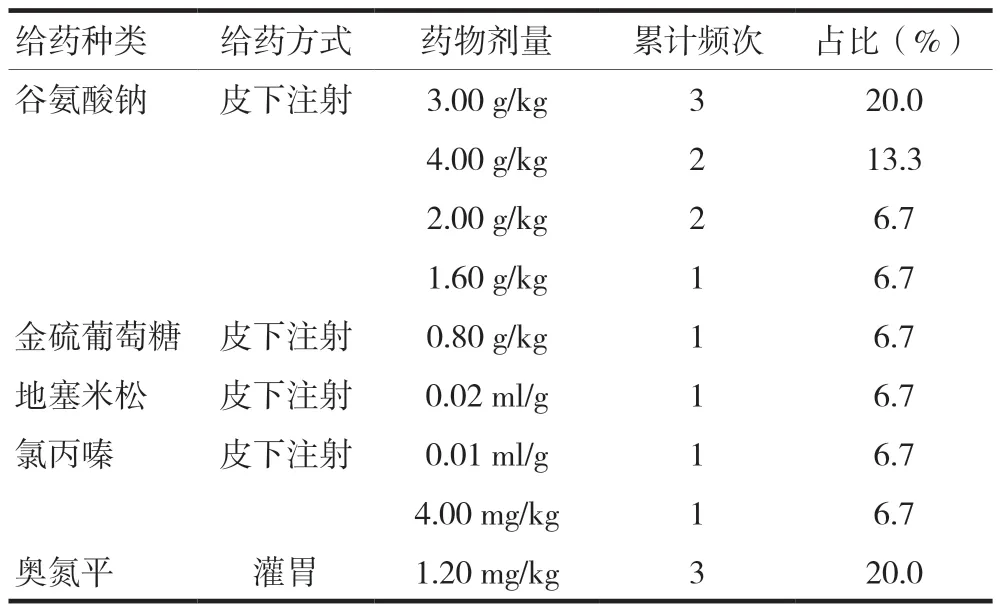
表4 单次给药频次
2.3.3 手术诱导 手术选择双侧卵巢切除术,术后恢复1~2周后,再进行6~16周的药物治疗,进行肥胖造模。优点是手术干预可以模拟中枢异常所致肥胖,与人体中枢异常型肥胖高度统一;药物或饮食诱导可能造成造模个体激素异常,但手术价格昂贵,且操作难度大,恢复期较长。
2.4 检测指标
频数分析将文献中体重、体长、腰围、摄食量、摄水量等统称为生理指标进行统计,血清检测中血糖、血脂谱、胰岛素水平等,统称为血清生化指标,肥胖特异性指标统称为脂肪细胞因子,对不同检测指标进行频次分类统计,见表5~6。

表5 检测指标频次

表6 生化指标频次
其中频率最高的是生理指标,共检测313次。生理指标检测是动物成模判断的首要标准,其中频率最高的是体重检测(170次),其次是体长(76次)、摄食量(48次)、腰围(10次)、摄水量(9次)。通过检测指标计算出肥胖指标,其中李氏指数(Lees index,Lees)(63次)、体重指数(body mass index,BMI)(4次)。其次是生化指标,累计出现246次,肥胖动物通常有合并血脂、血糖、胰岛素异常表现,研究者可先行监测血糖血脂谱以此科学判断肥胖造模是否成功。血清生化指标中较多的依次是血脂谱(156次)、空腹血糖(48次)、血清胰岛素(26次)。其次出现频率最高的是组织病理学(累计频率104次),最常用的是肝脏脂肪染色病理切片,衍生出脂体比指标(35次)。为了更客观地判断实验动物造模成功与否,实验者在试验过程中会进行相应指标监测,其中葡萄糖耐量试验(oral glucose tolerance test,OGTT)33次、胰岛素耐受试验(iusulin tolerance test,ITT)23次。
2.5 成模标准
2.5.1 西医成模标准 肥胖动物模型成模标准较不统一,据数据分析所示,目前主流评定方法为:①通过测定体重、体长等计算Lees指数和/或BMI与正常组在统计学上存在显著差异;②体重相比对照组上升20%;③内脏脂肪含量。并结合表观指标,观察实验动物的活动状况、摄食量和饮水量、称体重,肥胖成模动物较对照组明显表现出体重增加,体长、腰围明显增加等特征。具体的造模成功的标准暂未统一,需探寻明确标准。
2.5.2 中医成模标准 在中医成模中现阶段根据证型来评价建模成功与否。不同证型有其特定的评价指标。评价方法分为行为学指标、量表评价以及生化病理指标等。行为学指标多从行为状态进行分析。其中脾胃虚弱证采用旷场实验验证,肝郁脾虚运用十字实验、强迫游泳实验验证。这些模型具有特定筛选标准。脾肾阳虚、肝胃郁热、脾虚证型需采用量表评价,模型量表以人类肥胖临床分型为基础,基本符合肥胖状态,但动物模型现阶段始终无法完全模拟肥胖发病过程。痰瘀互结证、痰湿证应用血脂作为评价标准,痰瘀互结证检测血糖、血脂、全血黏度、红细胞凝集指数、胰岛素敏感指数。痰湿证在临床上与高脂血症相关,故应用肝组织切片染色以及脂肪量测定。这些评价方法会对动物造成创伤性损害,不利于实验进程。
3 讨论
通过对纳入文献进行数据频次分析,肥胖动物实验造模多选用SD大鼠和C57BL/6J小鼠。通常选择高脂饲料(碳水化合物20%~64.5%,脂肪13.8%~60%,蛋白质15.7%~30%)、高脂饮食(含碳水化合物45%~60%)或注射单次小剂量谷氨酸钠(3~4 g/kg)的方式诱导。指标多以血脂谱为基础,选取血糖、血清胰岛素、转氨酶检测等不同方面来综合评定。但在实验动物脂肪切片染色、内在脂肪称重、肥胖相关激素指标测定以及中医病证结合造模方面,本文仅通过对实验性文献的挖掘分析,未能采取实验验证有效造模方式。
饮食诱导是最常见的造模方式,但高脂饮食成分配比以及供能配比存在较大差异,从而导致肥胖建模存在差异性。食源性肥胖不仅与饮食结构相关,还与药物、肠道菌群、精神状态等因素[17-19]有关。所以,饮食诱导肥胖无法完全模拟肥胖发生的全过程。在药物诱导中,谷氨酸钠法以及金硫葡萄糖法通过影响下丘脑中枢功能诱导进食,出现腹型肥胖;地塞米松注射法造模大鼠出现毛色光泽度差、肌肉无力、反应迟缓、活动较少等脾虚表现[20];维生素D注射法的肥胖大鼠血清瘦素增加[19]。这些造模方法通过影响动物激素水平,诱导肥胖。其模型稳定且造模结果相统一。从中医理论来讲,通过造模成功的表现对诱导的肥胖大鼠进行证候评分,不仅有利于评价造模成功与否,还有助于研究不同证型造模成功的表现,有利于探寻多样化的造模方式。
肥胖已经成为困扰世界的重大难题,患者数量上升速度较快,其病理因素等也极易诱发糖尿病、心血管疾病。现阶段建立符合人体肥胖发病过程的动物模型成为重点。通过分析2012年1月1日至2022年12月30日实验性肥胖动物模型造模,发现现阶段造模方法暂无统一标准,造模方法、饮食结构、药物剂量、指标等方面存在差异;有文献对造模的选择、方法进行综合性分析,但缺乏数据支撑。故本文应用数据挖掘的方式对肥胖动物实验文献进行数据可视化分析,对肥胖动物造模选择以及指标监测做出总结,希望可以为今后造模提供理论支持。肥胖动物模型的建立已趋于完善,但模拟人类肥胖发病全过程仍较困难,目前常用的造模方式优缺点明显:①自发模型发病过程虽能较大程度还原肥胖发病过程,但繁殖的条件高、成本高,难以大规模造模;②高脂饲料诱导模型,造模周期长,成模比例难以把控,成模受环境影响较大,但仍能保持过半成模率,造模成本较低,是现阶段应用较广的造模方式;③手术诱导可以有效模拟出肥胖,但可操作性差,价格昂贵,恢复周期长;④啮齿动物模型是目前最能还原人类发病机制的模型,但啮齿动物模型需要大量的人员和资金支持、费用昂贵。因此,开发简单和廉价的动物肥胖症模型来补充目前使用的鼠类模型成为期待[6]。
目前应用最广的肥胖动物模型是高脂饲料诱导的肥胖模型,但仍易受个体因素等影响,仍需继续研究周期短、造模标准明确的肥胖模型。现阶段主要采用西医疾病模型,缺乏公认的既能体现中医证候特征又能反映西医疾病属性的动物模型,严重影响了中药对疾病的诊疗功能,因此建立有效的病症结合模型是现阶段迫切需要的[21]。人类肥胖受基因、个体差异、饮食生活结构的影响。通过更换造模方式,重构饮食框架等措施,使动物模型更还原人类肥胖状态。哺乳动物更易造模,而非哺乳动物(果蝇)易于使用基因编辑工具,筛选鉴定肥胖相关基因,两者均有优缺点,应该多模型互补应用以建立科学肥胖模型。

