2型糖尿病合并阻塞性睡眠呼吸暂停低通气综合征的列线图预测模型构建
邓春颖 李其英 刘文曲 王建霖 丁静雅 万政伟 刘玉萍
1.自贡市第四人民医院内分泌代谢病科,四川自贡 643000;2.电子科技大学医学院 四川省人民医院健康管理中心,四川成都 610072
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)是2型糖尿病(type 2 diabetes mellitus,T2DM)的常见共患病之一[1-2]。《中国2型糖尿病防治指南》建议对T2DM患者进行OSAHS的常规筛查[3],但OSAHS筛查受到特殊设备、场地、时间等限制。本研究旨在结合一般资料和生化指标构建T2DM患者合并OSAHS发生的预测模型,以期改善OSAHS常规筛查困难的现状。
1 资料与方法
1.1 一般资料
选取2018年9月至2020年4月自贡市第四人民医院(本院)内分泌代谢病科完成多导睡眠监测(polysomnography,PSG)的T2DM患者526例。本研究经本院医学伦理委员会审核批准[伦理号:2019年科研审(011号)]。经7∶3比例随机将所有患者分为训练集样本369例、验证集样本157例。
1.2 纳入及排除标准
1.2.1 纳入标准 ①符合T2DM诊断标准:世界卫生组织(World Health Organization,WHO)1999年糖尿病诊断及分型标准[4];②完成PSG监测,且临床资料完整;③OSAHS诊断标准:每夜7 h睡眠过程中呼吸暂停及低通气反复发作在30次以上,或呼吸暂停低通气指数(apnea-hypopnea index,AHI)≥5次/h诊断为OSAHS[5]。
1.2.2 排除标准 ①排除T1DM、妊娠糖尿病、其他特殊类型糖尿病者;②资料不完整者;③合并严重心脑血管疾病、肝肾功能不全、恶性肿瘤或精神疾患者。
1.3 资料采集
1.3.1 一般资料收集 年龄(岁)、性别(男、女)、高血压病史、身高(cm)、体重(kg)、体重指数(body mass index,BMI)。
1.3.2 生化资料收集 三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、尿酸(uric acid,UA)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、肾小球滤过率(glomerular filtration rate,eGFR)、胱抑素C(cystatin C,CysC)、促甲状腺素(thyroid stimulating hormone,TSH)、25(OH)维生素D等。
1.3.3 AHI测量 本研究应用多导睡眠记录器(YH-1000c/PolywatchYH-600)进行PSG监测,获得AHI。
1.4 统计学处理
1.4.1 样本量计算 以高血压为暴露因素,单纯T2DM患者患高血压概率报道为36.5%,合并OSAHS的T2DM患者合并高血压概率为67.2%[6],利用PASS 15.0软件,α=0.05,检验效能≥90%。考虑数据缺失,样本量增加5%,最终样本量为110。
1.4.2 数据分析 本研究采用R软件版本4.1.1来处理数据分析和图形绘制。符合正态分布的计量资料以均数±标准差()描述,采用t检验;不符合正态分布的计量资料以[M(P25,P75)]描述,采用非参数检验。计数资料以[n(%)]描述,采用χ2检验。P< 0.05为差异有统计学意义。
1.4.3 模型建立和评价 在本研究中,参与者被随机分配到训练集和验证集,比例为7∶3。训练集数据用于建立是否存在OSAHS的列线图模型,基于单变量和多变量二元logistic回归分析。模型的预测性能和拟合度通过受试者操作特征(receiver operating characteristic curve,ROC)曲线、Hosmer-Lemeshow检验和决策曲线分析(decision curve analysis,DCA)进行评估。
2 结果
2.1 基线资料
本研究共收集T2DM患者526例,其中男292例(55.50%)、女234例(44.50%),OSAHS阳性患者339例(64.40%),阴性患者187例(35.60%)。经7∶3比例随机将所有患者分为训练集样本369例、验证集样本157例。两组患者一般资料比较,除肾小球滤过率之外差异均无统计学意义(P> 0.05),见表1,组间具有可比性。

表1 训练集和测试集样本信息比较
2.2 OSAHS患者的危险因素分析
以T2DM患者是否同时患有OSAHS(1=是,0=否)作为依赖变量,自变量包括二元分类变量[性别(1=男,2=女)、高血压史(1=无,2=有)]、连续变量[包括年龄、身高、体重、BMI、TG、TC、LDL-C、HDL-C、UA、HbA1c、eGFR、CysC、TSH和25(OH)维生素D],进行二元logistic回归分析。单因素logistic分析发现性别、高血压史、体重、LDL-C、25(OH)维生素D和BMI可作为预测OSAHS发生的备选变量(P< 0.05)。将P< 0.1的变量进行多因素二分类logistic回归分析,结果显示高血压病史、LDL-C、25(OH)维生素D及BMI是T2DM患者发生OSAHS的独立预测因素(P< 0.05)。见表2。

表2 训练集数据中OSAHS患者危险因素的单因素及多因素logistic回归分析
2.3 构建和评价列线图预测模型
利用上述独立预测因素构建列线图预测模型如下(图1)。

图1 由训练集构建的T2DM患者发生OSAHS风险的预测列线图
ROC曲线被绘制以评估模型的预测准确性。在训练集中,模型的ROC曲线面积达到了0.742,确立的诊断阈值是0.825,达到了79.4%的灵敏度和58.8%的特异度(图2A)。而在验证集中,模型的ROC曲线面积为0.789,诊断阈值是0.651,拥有76.8%的灵敏度和72.3%的特异度。验证集中模型的ROC曲线面积比训练集提高了0.047,并且特异度提升了13.5%(图2B),这表明模型在预测方面具有较好的区分能力。
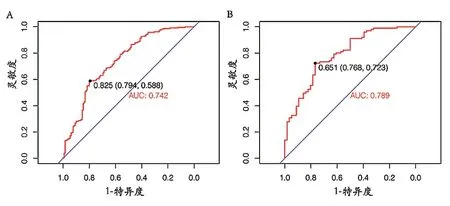
图2 训练集(A)和测试集(B)中预测模型预测T2DM患者发生OSAHS的ROC曲线
2.4 列线图预测模型的性能验证
在分析训练集数据时,模型的Hosmer-Lemeshow检验结果显示P> 0.05,指出模型预测与实际观测值拟合良好(图3A)。验证集的数据也支持了模型的可靠性,与实际观测数据的一致性较好(P> 0.05)(图3B)。

图3 训练集(A)和测试集(B)数据中预测模型预测T2DM患者发生OSAHS风险的校准曲线
在预测模型的基础上,利用多因素logistics回归结果筛选的独立影响因素预测T2DM患者发生OSAHS的DCA显示,训练集使用预测模型预测T2DM患者发生OSAHS的能够获得净收益的风险阈值>0.9(图4A),说明该模型具有很好的预测表现。同样的预测表现在验证集数据中也得到证实(图4B)。

图4 预测模型预测T2DM患者发生OSAHS风险的决策性曲线
3 讨论
本研究结果显示,血清LDL-C、BMI以及高血压病史与T2DM患者合并OSAHS发生呈正相关。LDL-C是动脉血管内皮细胞损伤的最主要因素,可以导致动脉粥样硬化、高血压等心血管疾病[7]。高血压患者发生OSAHS的概率增加,可能是由于长期的低氧血症、交感神经系统过度兴奋以及氧化应激和炎症反应等因素[8]。此外,BMI升高(肥胖)患者的咽喉部明显增厚,会降低呼吸通气效率,引起长期低氧血症,导致血管内皮损伤和代谢紊乱等症状,加重T2DM患者的OSAHS症状[9]。
研究表明25(OH)维生素D含量与T2DM合并OSAHS发生呈负相关。这与一项关于血清25(OH)维生素D与儿童OSAHS相关性分析结果一致[10]。血液中低水平的25(OH)维生素D有可能会增加T2DM患者的呼吸道感染风险,从而导致呼吸道慢性炎症,增加OSAHS发生概率[11-12]。与Mehrdad等[13]的研究相反,目前未发现HbA1c与T2DM患者合并OSAHS疾病的统计学关联。关于OSAHS与T2DM患者HbA1c的关系及其机制有待进一步深入研究。
列线图预测模型能够通过可视化方式为医务工作者提供疾病发生风险评估[14-15]。通过逻辑回归分析,本研究挑选出4个T2DM并发OSAHS的关键临床风险因素,基于这些因素建立了预测模型并利用ROC曲线、校准曲线以及DCA曲线进行验证。结果表明,该模型是评估T2DM并发OSAHS的有效工具。未来研究应展开多中心调查,以进一步提升模型的准确性和实用性。

