十种清热解毒中药提取物抗泛耐药鲍曼不动杆菌感染的研究
杨 琰,冯建文,季 波,袁 进,王 妍,李 健,蔡学究,姜志辉
(1.南方医科大学药学院,广东 广州 510515; 2.中国人民解放军南部战区总医院临床药学科,广东 广州 510010; 3.中国人民解放军南部战区总医院药剂科,广东 广州 510010; 4.中国人民解放军南部战区总医院骨科,广东 广州 510010)
鲍曼不动杆菌是一类非发酵革兰阴性杆菌,对环境的适应性强,在自然界和我国医院中广泛分布,已经成为医院感染的主要病原菌之一。临床抗菌药物不合理使用导致鲍曼不动杆菌耐药问题日趋严重[1-2],特别是泛耐药鲍曼不动杆菌(extensively drug-resistantAcinetobacterbaumannii,XDR-AB),其耐药机制复杂多样,临床治疗异常困难,研发针对XDR-AB感染的新型抗菌药物迫在眉睫[3]。清热解毒中药在感染性疾病的治疗方面积累了丰富的经验。《伤寒论》和《温病条辨》中总结了许多行之有效的方剂,如泻心汤、葛根芩连汤、白头翁汤等。清热解毒中药成功治疗温病的临床实践为解决细菌耐药问题提供了可行的创新路径。秀丽隐杆线虫是一种经典的试验动物模型,体积小,结构简单,全身透明易于观察,具有可操控性强、遗传背景清晰和生命周期短等特点,是药物筛选的理想试验模型[4]。相比体外抗菌活性,清热解毒中药在被感染的秀丽隐杆线虫体内的抗菌活性更接近人体内的真实抗菌活性。本课题组前期建立了XDR-AB秀丽隐杆线虫感染模型,具有良好的量效关系和稳定性,并对板蓝根、金银花、黄芩和连翘等75种《中国药典》记载的经典清热解毒中药的体内抗XDR-AB活性进行了筛选,发现牡丹皮、冬凌草和何首乌的提取物具有较好的抗XDR-AB感染活性[5-6]。为进一步探讨非经典清热解毒中药提取物的体内抗XDR-AB感染活性,并为发现新型抗XDR-AB感染先导化合物奠定前期研究基础,本研究从《中药大辞典》中选取了十种活性成分有体外抗菌作用的非经典清热解毒中药,在不同条件下制成提取物后,利用秀丽隐杆线虫XDR-AB感染模型进行体内活性测定。
1 材料与方法
1.1 试验材料
1.1.1 药品和试剂 十味清热解毒中药金果榄、矮脚苦蒿、姜黄、白桦皮、败酱草、藏报春、冷水花、山慈菇、驳骨草和土荆皮购自广州康圣药业有限公司,并经南部战区总医院中药房执业中药师刘艳艳鉴定。多黏菌素B(PMB,美国Sigma化学试剂公司),二甲基亚砜(DMSO,天津大茂化学试剂厂),琼脂粉、胰蛋白胨、LB肉汤培养基、CAMHB肉汤培养基(青岛高科工业园海博生物技术有限公司),脑心浸出液肉汤(BHI)培养基(广东环凯微生物科技有限公司)。
1.1.2 仪器 WSI-3000型倒置生物显微镜(广州微域光学仪器有限公司),SW-CJ-1F型净化工作台、DY04-13-44-00型立式压力蒸汽灭菌器(上海博迅实业有限公司),TDZ5-WS型多管架自动平衡离心机(长沙湘仪离心机仪器有限公司),DHP-9012型恒温培养箱、LRH-70型生化培养箱、HWS28型电热恒温水浴锅(上海一恒科学仪器有限公司),VITEK 2型微生物全自动鉴定药敏仪(法国生物梅里埃公司),BP210S型电子分析天平(德国赛多利斯)。
1.1.3 菌株、秀丽隐杆线虫 临床分离的XDR-AB GZ-JZH-1由南部战区总医院检验科提供,药敏试验检测结果见表1,其仅对多黏菌素和替加环素敏感,对其他常用抗菌药物均耐药;质控菌株为大肠埃希菌ATCC 25922,采用法国生物梅里埃公司VITEK 2微生物全自动鉴定药敏仪进行鉴定及药物敏感性试验。秀丽隐杆线虫由第二军医大学新药研究中心药学院惠赠。
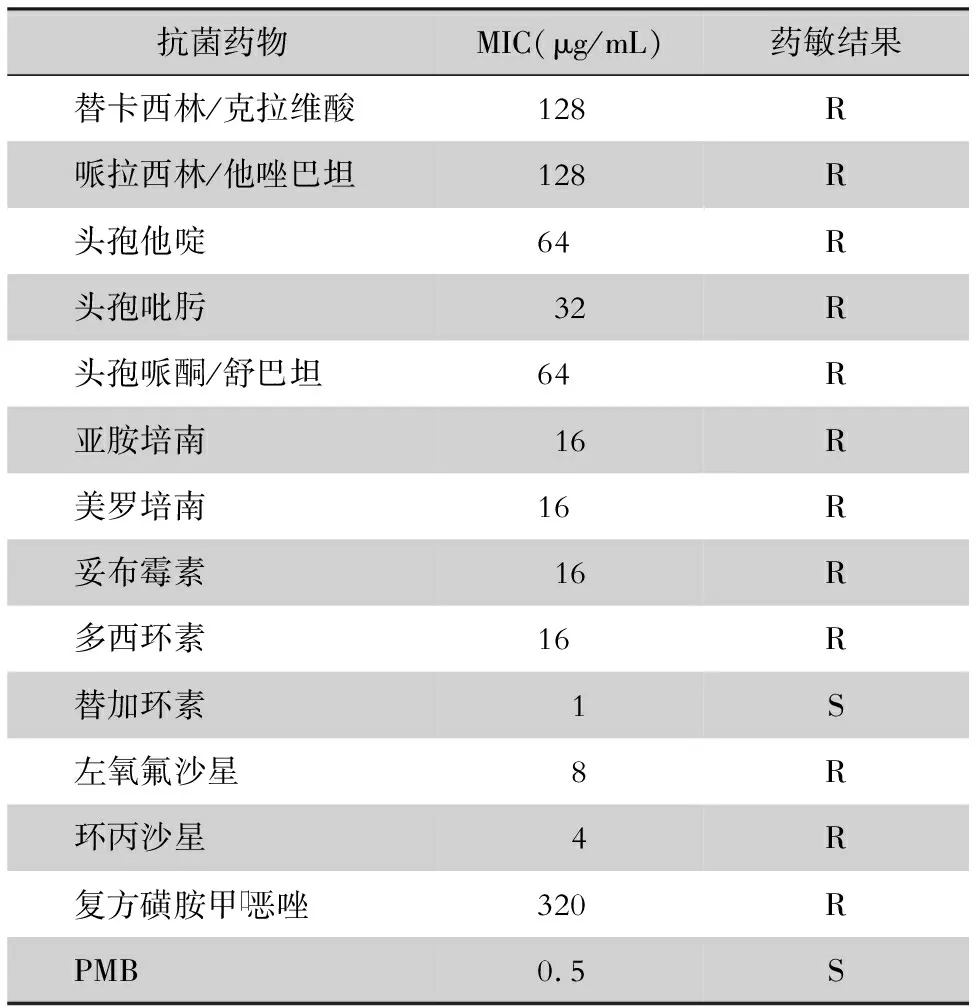
表1 XDR-AB GZ-JZH-1药敏检测结果
1.2 方法
1.2.1 中药材提取 分别称取金果榄、矮脚苦蒿、姜黄、白桦皮、败酱草、藏报春、冷水花、山慈菇、驳骨草和土荆皮6 g,并分成三等分置于3个250 mL圆底烧瓶中,按1∶12物料比分别加入蒸馏水、50%乙醇和95%乙醇30 mL。将3个不同溶剂的烧瓶分别于100、90、85℃加热回流1.5 h后,对药液进行减压过滤。再次按1∶8 的物料比加入溶剂,重复提取1.5 h,合并滤液,60℃下减压干燥获得药物浸膏,
置于-20℃保存备用。
1.2.2 秀丽隐杆线虫感染模型的构建与验证 使用含有10 μmol Fe3+的20% BHI培养基将同步化的秀丽隐杆线虫(每块板约1 000条)从线虫标准培养基(nemathod growth media,NGM)平板上冲洗至15 mL离心管中,800 r/min离心1 min,弃上清液,加培养基至2 mL左右。挑取单个XDR-AB菌落于含有3 mL 20% BHI培养基的比浊管内,调整至0.5麦氏单位(约为1.5×108CFU/mL)。取300 μL菌液至2.7 mL 20% BHI培养基中进行10倍稀释,使得菌液浓度约为1×107CFU/mL。吸取2 mL稀释后的菌液加到秀丽隐杆线虫管中,使XDR-AB以终浓度5×106CFU/mL感染秀丽隐杆线虫,置于25℃、85%湿度下培养。
将秀丽隐杆线虫与5×106CFU/mL的XDR-AB在20% BHI中共培养6 h后,显微镜下观察秀丽隐杆线虫的生存状态,判断是否存活。为进一步明确秀丽隐杆线虫的死亡是XDR-AB所致,本试验使用细胞膜红色荧光探针Dil(1,1-双十八烷基-3,3,3’,3’-四甲基吲哚二碳菁)示踪XDR-AB的感染路径:称取2 mg的Dil溶于1 mL的二甲基甲酰胺(DMF)中制备成Dil储备液,将细菌悬浮在2 mL的M9溶液中,添加1 μL Dil储备液,用锡纸避光,在25℃孵育3 h。使用M9溶液清洗细菌至少3次后,调整菌液终浓度为5×106CFU/mL,在25℃温箱中感染秀丽隐杆线虫6 h。最终感染后的秀丽隐杆线虫用M9溶液清洗直至上清液完全无色为止,并使用荧光显微镜观察细菌的荧光强度。
1.3 配制待测中药系列浓度 称取10 mg中药浸膏于1.5 mL Ep管中,加入100 μL DMSO,再加入900 μL的20% BHI培养基将药物溶解,20% BHI 10倍梯度稀释4次,获得浓度分别为10 000、1 000、100、10、1 μg/mL的药液。阳性对照为20 μg/mL的PMB,阴性对照为DMSO。
1.4 筛选具有体内抗XDR-AB活性的中药 秀丽隐杆线虫感染6 h后,用20% BHI液体培养基清洗至少3次,将秀丽隐杆线虫分配至96孔板中,15~20条/孔,每孔加培养基180 μL,药液20 μL,使各提取物以1 000、100、10、1、0.1 μg/mL梯度终浓度进行干预,同时设置阳性对照孔(含2 μg/mL PMB和感染后的秀丽隐杆线虫)和阴性对照孔(含1% DMSO和感染后的秀丽隐杆线虫),于25℃、85%湿度培养36 h。计算秀丽隐杆线虫存活率,判断不同浓度的中药提取物对感染秀丽隐杆线虫的作用。每组设3组平行对照,求平均值。当阳性对照孔秀丽隐杆线虫生存良好,阴性对照孔秀丽隐杆线虫全部感染致死时计算试验组存活率。秀丽隐杆线虫存活率=试验组秀丽隐杆线虫存活数/试验组秀丽隐杆线虫总数×100%。
1.5 统计学分析 应用SPSS 25.0软件进行分析。多组率的比较采用卡方检验和Fisher确切概率法。多重比较采用α分割法,检验水准α=0.05/比较次数(比较3次时,α=0.05/3=0.017)。
2 结果
2.1 秀丽隐杆线虫显微镜观察结果 感染模型构建完成后,显微镜下观察秀丽隐杆线虫形态,以判断是否存活。存活秀丽隐杆线虫呈现正弦状态(见图1A),咽部肌肉不停泵动,在光线和机械刺激时可以自由活动,而XDR-AB感染死亡的秀丽隐杆线虫呈直线僵直不动状态,秀丽隐杆线虫的整个肠道充满细菌(见图1B),死亡秀丽隐杆线虫和存活秀丽隐杆线虫具有明显的外观差异。为进一步证实秀丽隐杆线虫肠道的膨胀是由于XDR-AB的定植,用细胞膜红色荧光探针Dil标记XDR-AB,示踪其感染路径。

注:A为存活状态;B为XDR-AB感染后死亡状态。
将秀丽隐杆线虫置于含荧光标记细菌中共培养6 h后,可观察到秀丽隐杆线虫整个肠道明显膨大,其中充满大量的细菌,红色荧光强度很高,见图2。
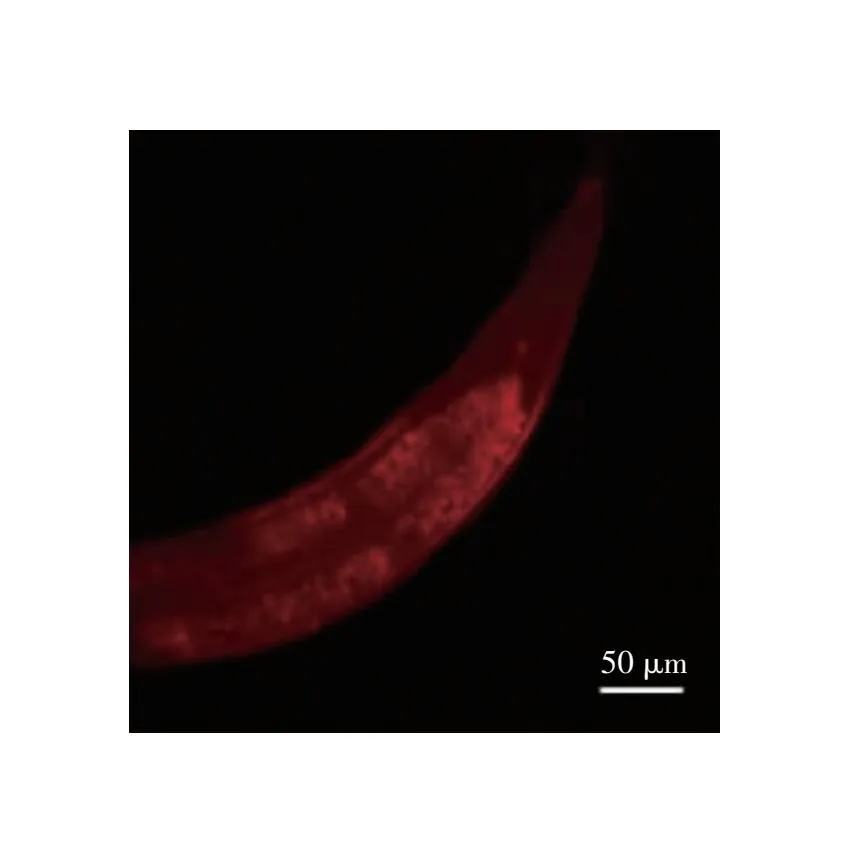
图2 细胞膜红色荧光探针Dil标记的XDR-AB感染秀丽隐杆线虫荧光显微镜下观察结果(40×)
2.2 不同浓度的中药提取液体内抗XDR-AB的活性 使用该秀丽隐杆线虫感染模型从十种清热解毒中药中筛选对临床XDR-AB GZ-JZH-1具有体内抗菌活性的中药。结果显示,姜黄和土荆皮表现出较好的体内抗XDR-AB活性。其中,姜黄的水提取物、50%乙醇提取物和95%乙醇提取物在浓度1 000 μg/mL时,可使XDR-AB感染的秀丽隐杆线
虫存活率分别提高至54.2%(与阴性对照组比较,P<0.001)、18.8%、13.3%;土荆皮的水提取物、50%乙醇提取物和95%乙醇提取物在浓度1 000 μg/mL时,可使XDR-AB感染的秀丽隐杆线虫存活率分别提高至47.4%(与阴性对照组比较,P<0.001)、23.8%(与阴性对照组比较,P=0.013)、15.8%。见表2。

表2 不同清热解毒中药提取物体内抗XDR-AB活性[秀丽隐杆线虫存活率(%)]
2.3 不同中药提取物体内抗XDR-AB的活性 姜黄与土荆皮的不同提取物抗XDR-AB感染活性不同。姜黄的水提物较50%乙醇提取物、95%乙醇提取物抗XDR-AB感染的活性更高(χ2值分别为10.04、17.16,P值分别为0.002、<0.001);50%乙醇提取物抗XDR-AB感染的活性与95%乙醇提取物比较,差异无统计学意义(P>0.017),且姜黄提取物的体内抗菌活性随着乙醇浓度的提高而降低,水提取物的体内抗菌活性随着浓度的增大而增强。土荆皮的水提取物较95%乙醇提取物抗XDR-AB感染的活性更高(χ2=8.77,P=0.003),水提取物、95%乙醇提取物抗XDR-AB感染的活性分别与50%乙醇提取物比较,差异均无统计学意义(均P>0.017)。见表2。姜黄与土荆皮水提取物的体内活性也具有较强的浓度依赖性。见图3。
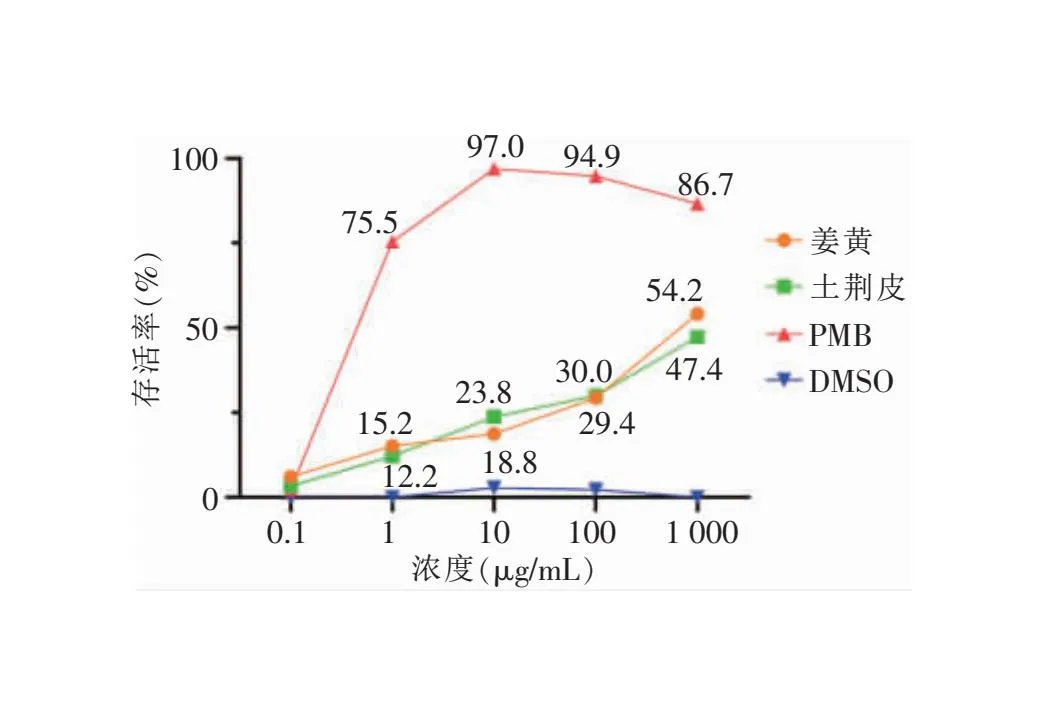
图3 姜黄和土荆皮水提取物不同浓度下的秀丽隐杆线虫存活率
3 讨论
目前中药的抗菌活性研究多集中在体外活性[7-9],体内抗菌活性研究仍较少,尤其是中药抗XDR-AB的体内活性研究罕见报道。本课题组前期建立了XDR-AB感染的秀丽隐杆线虫模型,能较真实地反映中药提取物的体内抗XDR-AB的活性。本研究使用该模型对十种清热解毒中药进行测定,结果显示姜黄和土荆皮的水提取物具有较好的体内抗XDR-AB活性,其余8种中药基本没有体内抗XDR-AB活性,表明清热解毒中药的体内抗菌药效因中药种属、提取溶剂和细菌种类等因素而存在巨大的差异,姜黄和土荆皮发挥体内抗菌活性的成分可能以水溶性成分为主。
姜黄味辛温,归脾、肝经,有破血行气、通经止痛之功效[10]。其主要活性成分姜黄素(含3%~6%)可通过破坏生物膜、下调基因表达、增加细胞膜的通透性和破坏细胞壁的完整性等机制发挥抗菌作用,可抑制金黄色葡萄球菌、链球菌、铜绿假单胞菌及幽门螺杆菌等病原体[11-12],但在体外对鲍曼不动杆菌无抑制活性(MIC>256 μg/mL)[13-14]。本研究首次发现姜黄具有体内抗XDR-AB感染的活性,且相同浓度下,水提取物的活性高于乙醇提取物。其原因可能是姜黄水提物中含有的单一成分或多种成分协同产生的体内药效,也可能是姜黄素通过增强秀丽隐杆线虫的免疫系统或是减弱XDR-AB的毒力发挥体内药效。
土荆皮具有抗菌、抗肿瘤和抗血管生成等活性,土槿乙酸为土荆皮发挥抗微生物活性的主要成分,其对白念珠菌、石膏样小孢子菌、球拟酵母菌、金黄色葡萄球菌和大肠埃希菌均有明显的抗菌作用,且对革兰阴性菌的抗菌效果强于革兰阳性菌[15-16]。但也有文献[16]报道土槿乙酸对大肠埃希菌无体外抑制作用。鉴于其矛盾的抗菌药效,很难判断土荆皮起体内药效的成分是土槿乙酸。因此,有必要对土槿乙酸以及其他土荆皮主要化学成分进行体内抗XDR-AB活性研究,以明确其体内药效成分。综上所述,本研究通过XDR-AB秀丽隐杆线虫感染模型发现了姜黄和土荆皮具有较好的体内抗XDR-AB感染活性,但药效物质尚需进一步研究确证。
本研究通过XDR-AB秀丽隐杆线虫感染模型筛选出了具有体内抗XDR-AB活性的清热解毒中药姜黄和土荆皮,为其抗菌活性研究提供了研究基础。接下来将进一步明确这两种中药提取物发挥体内抗XDR-AB活性的成分,并对其进行结构改造,为研发新型高效抗XDR-AB感染的抗菌药物提供方向。
利益冲突:所有作者均声明不存在利益冲突。

