伊丽莎白菌属感染流行病学及耐药性研究进展
冯孟文,张梦怡,周 静
(南京医科大学第一附属医院重症医学科,江苏 南京 210029)
伊丽莎白菌属是革兰阴性杆菌,广泛存在于环境中,可导致免疫功能低下人群感染,引起肺炎、脑膜炎、菌血症等疾病。伊丽莎白菌属对多种抗菌药物天然耐药,临床治疗中可选择的抗菌药物较少,患者感染后病死率高。随着广谱抗菌药物的应用,人口老龄化,以及免疫功能低下人群增加,伊丽莎白菌属感染发病率逐年上升,有的地区甚至出现感染暴发。因此,临床医生应加强对伊丽莎白菌属感染的关注。
1 概况
1.1 伊丽莎白菌属发现史 20世纪50年代,美国细菌学家伊丽莎白·金(Elizabeth O.King)发现1种与新生儿脑膜炎相关的革兰阴性杆菌。1959年该革兰阴性杆菌被命名为脑膜脓毒性黄杆菌[1],1994年更名为脑膜脓毒金黄杆菌(C.meningosepticum)[2],2005年与新发现的米尔金黄杆菌一起归类为伊丽莎白菌属(Elizabethkingia)[3]。2011年,在非洲冈比亚按蚊肠道发现按蚊伊丽莎白菌[4]。2017年,Nicholson等[5]根据基因序列分析结果,对伊丽莎白菌属分类学进行了修订。目前伊丽莎白菌属可分为6类:脑膜败血伊丽莎白菌(E.meningoseptica)、米尔伊丽莎白菌(E.miricola)、按蚊伊丽莎白菌(E.anophelis)、E.bruuniana、E.ursingii和E.occulta。
1.2 伊丽莎白菌属特征 伊丽莎白菌属菌体呈直杆状,菌落圆形,白色或黄色,半透明,边缘光滑,可形成生物膜[3,5],革兰染色阴性,不运动,不形成孢子;专性需氧,可水解酪蛋白,不发酵糖,在28~37℃环境生长良好,在5℃或42℃环境不生长。伊丽莎白菌属菌体约0.5 μm×(1.0~2.5) μm,DNA序列长4.3~4.4 Mbp,约有4 000个编码基因[6],DNA(G+C)含量为35.0%~38.2%[3,5]。不同菌株的特有基因变化较大,目前仍陆续发现新的基因[7-8]。脑膜败血伊丽莎白菌与其他菌种之间差异较大,其平均(G+C)含量高于其他菌种,且共享的编码基因不到86%[9]。E.bruuniana、E.ursingii和E.occulta在基因同源性上与米尔伊丽莎白菌更接近[8]。
2 菌种鉴定
2.1 伊丽莎白菌种鉴定方法 临床常用的微生物鉴定系统通常可以识别出伊丽莎白菌属,但无法进一步进行菌种分类。临床常用的API/ID32、Phoenix 100、VITEK 2全自动微生物鉴定系统和基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)系统鉴定伊丽莎白菌属的准确率为14.3%~66.7%,容易发生的错误主要为将按蚊伊丽莎白菌鉴定为脑膜败血伊丽莎白菌[10-14]。MALDI-TOF MS根据细菌蛋白质和脂多糖的质谱峰识别细菌,可以区分按蚊伊丽莎白菌和脑膜败血伊丽莎白菌,但很难区分E.bruuniana、E.occulta和E.ursingii[11-12,15-17]。
高通量实时荧光定量PCR技术主要依据细菌的特异基因对菌株进行鉴定,该方法可以直接、快速、可靠的从初级标本中检测细菌,同时准确区分按蚊伊丽莎白菌和脑膜败血伊丽莎白菌[18]。新一代测序技术(NGS)具有高灵敏度、高通量等特性,除可以鉴定伊丽莎白菌属,还可以区分菌种,提供更多与细菌生物特性相关的信息[5,8],帮助鉴定是否为同种同源菌株感染暴发[14]。
2.2 伊丽莎白菌致病菌种分布情况 既往认为伊丽莎白菌属感染主要由脑膜败血伊丽莎白菌引起,随着菌种鉴定技术的发展,按蚊伊丽莎白菌感染的报道逐渐增加。多项研究[10-13,15,19-23]对既往保存的菌株重新进行鉴定,发现按蚊伊丽莎白菌占到伊丽莎白菌属感染的59%~99%,是主要的致病菌种;脑膜败血伊丽莎白菌占1%~26.9%,但在某些地区也可达到60%~66.7%;米尔伊丽莎白菌占0~11.9%,E.bruuniana、E.ursingii和E.occulta检出率较低,台湾一项回顾性研究[23]显示,269株伊丽莎白菌中仅发现1株E.bruuniana和2株E.occulta。
3 致病机制
伊丽莎白菌属感染可以引起肺炎、脑膜炎、菌血症,也可引起心内膜炎、胆管炎、腹膜炎、尿路感染、皮肤软组织感染、化脓性关节炎等疾病[11,16,20,22-23]。
伊丽莎白菌属最重要的致病因子为生物被膜[9],其形成的微环境有利于细菌黏附、定植在物体表面,提供细菌生长需要的营养,促进基因在细菌间的水平转移,从而对抗机体免疫应答,并对抗菌药物产生耐受,导致机体持续性感染,增加患者病死率[8-9]。营养丰富的条件下,细菌生物被膜形成能力更强[24],而荚膜多糖在生物被膜形成过程中发挥重要的作用[16]。
伊丽莎白菌属的毒力因子还包括溶血素、唾液酸、芳基硫酸酯酶、磷脂酶C(PLC)、脂多糖(LPS)、趋化因子Mig-5和过氧化物酶。溶血素可裂解红细胞,获取必要的营养,同时改变患者机体状态,降低免疫力[8-9],溶血素基因表达可随环境变化而调节[24];唾液酸通过分子模拟逃避宿主免疫应答,也可成为营养来源[9];芳基硫酸酯酶协助细菌穿过血脑屏障,引起脑膜炎;PLC有助于细菌逃避巨噬细胞的杀伤[25];LPS、Mig-5可活化免疫细胞,引起炎症反应;过氧化物酶可清除自由基,抵抗宿主免疫杀伤[8]。
有些菌种含有独特的毒力因子,发挥着独特的作用。米尔伊丽莎白菌中发现特有的毒力因子:脲酶可代谢产氨,增强细菌耐酸性,而Ⅲ型分泌系统(T3SS)可将毒力相关蛋白转运入宿主细胞[8,17]。
4 耐药情况与耐药机制
美国临床实验室标准化协会(CLSI)(2019)推荐采用微量肉汤稀释法测定伊丽莎白菌属对抗菌药物的敏感性[26]。最低抑菌浓度(MIC)折点参照CLSI中其他非肠杆菌目的判定标准,万古霉素、利福平MIC折点参照葡萄球菌或肠球菌的判定标准,替加环素MIC折点参照美国食品药物管理局(FDA)设定的肠杆菌的判定标准;由于CLSI未确定其他肠杆菌纸片扩散法折点标准,使用纸片扩散法测定伊丽莎白菌属药物敏感性(药敏)时,可参照CLSI设定的不动杆菌或假单胞菌判定折点。另有研究[27]显示,纸片扩散法、E-test法测定伊丽莎白菌属对14种常用抗菌药物的敏感性与琼脂稀释法的一致率分别为74.8%、76.1%。因此,推荐采用琼脂稀释法或微量肉汤稀释法测定伊丽莎白菌属对抗菌药物的敏感性。
4.1 β-内酰胺类抗生素耐药情况及耐药机制 伊丽莎白菌属对头孢菌素类、碳青霉烯类抗生素表现出极高的耐药率[21,23,27-29],对含酶抑制剂类抗生素敏感性各地报道不一。脑膜败血伊丽莎白菌对哌拉西林/他唑巴坦的敏感率为73%~100%,按蚊伊丽莎白菌为30.6%~92.4%,米尔伊丽莎白菌为73%~96%[11-17,21-23,30-32]。对伊丽莎白菌属基因序列进行分析,发现其同时携带超广谱β-内酰胺酶(ESBLs)和金属β-内酰胺酶(MBL)两种耐药酶基因[16,21,28,32-33]。ESBLs由blaCME编码,主要介导对头孢菌素类抗生素耐药;blaBlaB、blaGOB编码MBL,可水解包括碳青霉烯类在内的几乎所有β-内酰胺类抗生素。
4.2 喹诺酮类抗菌药物耐药情况及耐药机制 伊丽莎白菌属中不同菌种对喹诺酮类抗菌药物敏感性差异较大。脑膜败血伊丽莎白菌对左氧氟沙星、环丙沙星、莫西沙星敏感率分别为30%~92%、10%~58%、41%~100%;按蚊伊丽莎白菌分别为29%~100%、8.3%~75%、41%;米尔伊丽莎白菌分别为77%~100%、56%~75%、100%;E.bruuniana对左氧氟沙星和环丙沙星敏感率分别为66%~100%、33%~60%[12,14-15,23,27,33-39]。伊丽莎白菌属的DNA旋转酶亚单位(GyrA和GyrB)或拓扑异构酶Ⅳ亚单位(ParC和ParE)的喹诺酮耐药决定阈(QRDR)发现多个氨基酸突变,导致靶蛋白与药物亲和力下降或不能结合,从而对氟喹诺酮类药物产生抗性[16,21,23,28]。在耐氟喹诺酮类药物菌株中,RND家族的AcrAB-TolC外排系统表达可增加12.7倍,增强了对药物的外排作用[28]。
4.3 氨基糖苷类抗生素耐药情况及耐药机制 乙酰基转移酶GNATs和核苷转移酶ANT(6)介导伊丽莎白菌属对氨基糖苷类抗生素耐药,该菌属ant(6)基因携带率达92.4%~100%[39],对庆大霉素敏感率为0~4.3%[21,27,36]。研究[33,40]发现伊丽莎白菌属均携带catB和tetX基因,catB编码B类氯霉素乙酰基转移酶,介导对氯霉素耐药,tetX编码核糖体保护蛋白,与四环素耐药性相关,但此基因单独不发挥作用。伊丽莎白菌属还可以利用多药外排泵排出抗菌药物,如RND外排泵家族的CeoB可泵出氯霉素和环丙沙星,ABC家族的MsrB可排出红霉素和链球菌素B[9]。
4.4 万古霉素耐药情况及耐药机制 采用不同的药敏检测方法测定伊丽莎白菌属对万古霉素的敏感性差异较大[27]。有研究[13]显示,纸片扩散法和E-test法测定万古霉素的敏感率分别为29.4%、96.4%[19]。基于CLSI推荐的微量肉汤稀释法的研究中,万古霉素MIC值为8~256 μg/mL,均不敏感,该菌属20%~100%对万古霉素为中介水平[12,21,29,31]。伊丽莎白菌属含vanW、vanB等基因,编码的代谢酶合成低亲和力前体,消除了万古霉素作用的靶位,从而对万古霉素耐药[33,41]。
5 流行病学特征
伊丽莎白菌属广泛分布于自然环境中,可在经氯化物处理的城市供水系统中存活,定植在水池和水龙头中;可污染物体表面,如呼吸机管路、加湿器、静脉导管、胃管、新生儿保温箱、冰箱等[11,19,30,46];可通过工作人员的手传播[33,46]及母婴垂直传播[25]。
伊丽莎白菌属易感人群包括婴幼儿、高龄及免疫低下的成年人[11,16,22-23]。易感因素有合并糖尿病、高血压、终末肾脏病、恶性肿瘤等基础疾病,或接受免疫抑制治疗、侵入性操作,既往有抗菌药物暴露[21,23,29,35,47-48]。研究[23,28,42]显示,85%以上的伊丽莎白菌感染患者至少有一项基础疾病。另有研究[13]显示50%左右感染患儿为早产或出生体重<2 500 g。Huang等[34]发现接受多黏菌素雾化治疗患者感染伊丽莎白菌属的比例更高,可能与抗菌药物选择压力有关。英国38例肺囊性纤维化患者中均分离出米尔伊丽莎白菌,提示肺囊性纤维化与该菌种感染可能存在一定关系[17]。
伊丽莎白菌属感染患者的病死率为13.5%~70%[16,19-21,23,29,34-35]。对感染患者临床资料进行分析,发现简化急性生理功能评分(SAPS Ⅱ)高、C反应蛋白/清蛋白比值升高、血红蛋白降低、深静脉置管、ICU住院时间长、对利福平及左氧氟沙星耐药等为感染患者的死亡危险因素,不合理的经验性抗菌药物治疗为患者死亡的独立危险因素[19,23,29,48]。
伊丽莎白菌是一种机会致病菌,分离出该细菌的成年人中有1/2无任何临床症状,考虑为定植菌,分离出该细菌的婴幼儿中,这一比例为1/3。近年来,随着广谱抗菌药物的应用增加,人口老龄化加重,世界各地相关感染的报道不断增加[11,29,38]。2014—2016年美国威斯康星州和伊利诺伊州感染暴发的规模最大,共造成75例患者感染,25例死亡,且多为社区获得性感染[16]。2019年土耳其一所医院儿童重症监护病房发现6例儿童感染脑膜败血伊丽莎白菌,导致4例儿童死亡[30]。2020年上海一项回顾性研究[21]发现,该院既往5年中52例患者感染伊丽莎白菌属,其中7例患者死亡。在韩国首尔世福兰斯医院,住院患者伊丽莎白菌属感染发病率从2009年的0.002%上升至2017年的0.088%[20]。台湾地区耐碳青霉烯类非发酵革兰阴性杆菌中,伊丽莎白菌属感染发病率仅次于鲍曼不动杆菌[34]。
6 诊治与防控
伊丽莎白菌属感染后,高龄、接受免疫抑制治疗、合并基础疾病等人群病死率高,需要临床加强关注。伊丽莎白菌属对多种抗菌药物耐药,其中84.6%患者存在不合理的经验性抗感染治疗[29]。临床应注意加强病原学检测,及时根据药敏试验结果选用敏感抗菌药物。临床选择的药敏检测方法会影响该菌属的敏感率,采用纸片扩散法、E-test法检测时,容易提高该菌对抗菌药物敏感性的判断[27],导致临床选择的抗菌药物效果不好。因此,应选择合适的药敏检测方法对伊丽莎白菌属进行分析。
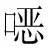
针对留置静脉导管的伊丽莎白菌感染患者,拔除导管可提高其治愈率[30,42]。随着细菌耐药性的增加,探索新的抗感染方法非常重要。研究[31]发现,联用金属螯合剂乙二胺四乙酸(EDTA)可以使亚胺培南的MIC降低到单用亚胺培南MIC的四分之一。噬菌体TCUEAP1可以裂解伊丽莎白菌,将感染小鼠存活率从30%提升至80%[53]。
临床发现伊丽莎白菌属感染或定植患者时,为避免其医院感染暴发,可主动筛查污染源,加强环境消毒,特别是水槽、水龙头、机械通气管路等,彻底清理污染的洗涤槽,更换水龙头。对阳性患者可加强隔离,限制病房人员流动。医务人员应加强规范化无菌操作,使用含乙醇消毒剂进行消毒[30,38,46]。Balm等[54]发现所有被污染的设备被替换1个月后又再次分离出伊丽莎白菌属,因此,应加强对设备的日常管理,定期消毒,最大限度地减少细菌污染。
7 总结与展望
近年来,伊丽莎白菌感染率快速上升,导致免疫功能低下人群感染,增加了患者的病死率,给患者和社会带来严峻挑战。伊丽莎白菌对多种抗菌药物耐药,不合理的经验性抗感染治疗是患者死亡的独立危险因素。因此,早期识别细菌并进行药敏检测,根据药敏结果选择合适的抗菌药物治疗非常重要。同时,应加强医院感染管理,定期对医院环境、设备进行消毒,避免出现院内交叉感染。
致谢:感谢南京医科大学第一附属医院检验科刘根焰主任在论文写作过程中的指导与帮助。
利益冲突:所有作者均声明不存在利益冲突。

