益肠散结颗粒对结肠癌小鼠肠道菌群及免疫功能的调节作用及机制研究
侯爱画, 戴玲玲, 孟鹏, 张晓妮, 谭松, 刘泽, 赵啸虎
(1.烟台市中医医院肿瘤科,山东烟台 264000;2.烟台市中医医院肿瘤四科,山东烟台 264000;3.烟台市中医医院肿瘤一科,山东烟台 264000)
结肠癌是临床常见的消化道恶性肿瘤之一,其发病率占全球恶性肿瘤的第3 位,死亡率占第5 位[1]。数据统计[2]显示,我国每年约有120万患者被诊断为结直肠癌,其中,因结肠癌死亡的患者超过60 万。近年来研究[3-5]发现,肠道菌群失调可介导结肠癌的发生发展。肠道菌群失衡会导致肠道黏膜上皮细胞遗传学改变,引发肠道炎症反应和微环境紊乱,同时还可通过持续产生细胞毒素刺激肿瘤的发生和发展。目前,姑息手术、放化疗、靶向治疗、免疫治疗和介入治疗等是晚期结肠癌的主要治疗手段,但由于晚期结肠癌患者正气不足和免疫力低下往往难以承受,且药物在杀伤肿瘤细胞的同时亦致机体免疫力降低,对患者毒副作用较大[6]。因此,寻找有效低毒的治疗方法对临床治疗结肠癌具有重要意义。中医治法在结肠癌的综合治疗中具有独特的辨证论治和整体思想,不仅可以帮助患者增强正气和免疫力,还可以减轻临床症状,提高生活质量[7-8]。我院国家重点专科学术带头人、山东省名老中医专家侯爱画教授总结中医学理论认识及多年的临床实践经验,基于“扶正祛邪治癌”的学术观点,以“益气健脾、祛湿化浊、散结消积”为主要治法,拟定益肠散结方。本方治疗结肠癌的临床疗效显著,能减轻患者的临床主症,提高免疫功能及生活质量,但具体作用机制尚不清楚。因此,本研究旨在探究益肠散结颗粒对结肠癌小鼠肠道菌群及免疫功能的作用及机制,以期为临床应用提供依据,现将研究结果报道如下。
1 材料与方法
1.1 实验动物 60只SPF级4~6周龄雄性C57BL/6小鼠,体质量17~19 g,购自上海中医药大学实验动物中心,实验动物生产许可证号:SCXK(沪)2017-0005。将小鼠饲养于温度21~25 ℃,相对湿度55%~65%的动物房内,光照昼夜交替12 h/12 h循环,标准鼠饲料及无菌水饲养,自由饮食饮水,适应性喂养7 d。本研究方案已通过烟台市中医医院伦理委员会批准(编号:2021-013-KY)。
1. 2 药物、试剂与仪器 益肠散结颗粒(党参24 g、炒白术15 g、黄芪30 g、茯苓15 g、薏苡仁15 g、砂仁9 g、姜半夏9 g、女贞子15 g、陈皮15 g、郁金9 g、大青叶6 g、鱼腥草9 g、浙贝9 g、甘草9 g),由烟台市中医医院制剂室加工颗粒。葡聚糖硫酸钠(DSS,美国Sigma 公司);氧化偶氮甲烷(AOM,瑞典TdB 公司);过表达黑色素瘤缺失基因2(AIM2)质粒(pcDNA-AIM2,美国赛默飞世尔科技公司);免疫球蛋白(Ig)G、IgM、白细胞介素(IL)-1β、IL-18 酶联免疫吸附分析(ELISA)试剂盒(北京Solarbio 公司);磁珠法土壤和粪便基因组DNA 提取试剂盒(上海雅吉生物科技有限公司);AIM2、凋亡相关斑点样蛋白(ASC)、胱天蛋白酶1(caspase-1)等抗体(上海联迈生物工程有限公司);CD4+抗体、CD3+抗体、CD8+抗体(美国Abcam公司)。高速冷冻离心机(美国Thermo Fisher公司);PCR仪(美国ABI公司);电泳仪(北京六一生物科技有限公司);Illumina MiseqDNA 测序仪(美国Illumina Sandiego公司)。
1.3 分组、模型制备与给药 将60只小鼠随机分为6 组,即正常组、模型组,益肠散结颗粒低、中、高剂量组,pcDNA-AIM2干预组,每组10只。采用AOM/DSS诱导法制备结肠癌模型[9]。除正常组外,其余各组小鼠均一次性腹腔注射10 mg/kg的致癌剂AOM;正常组一次性腹腔注射生理盐水10 mg/kg。恢复7 d 后,除正常组外,其余各组小鼠灌胃质量分数为3%的DSS 水溶液,每日1 次,持续5 d,开始肠炎Ⅰ期造模,而后换回饮用水持续14 d 为肠炎恢复期,如此19 d 为1 个DSS 周期。结肠癌模型的建立一共需要3个DSS周期,之后正常饲养直至肿瘤成熟,整个模型周期约4个月。同期,正常组小鼠对应给予生理盐水处理。
从肠炎恢复期Ⅰ期第11 天开始,各组给药。根据成人临床用量换算后的动物用量,益肠散结颗粒低、中、高剂量组分别灌胃含生药0.56、1.11、1.67 g/kg的益肠散结颗粒水溶液,每日1次,直至实验结束需8周;pcDNA-AIM2组给予一次性腹腔注射10 μg pcDNA-AIM2质粒;正常组和模型组小鼠一次性腹腔注射生理盐水。各组均饮用高压灭菌水直至实验结束。
1.4 观察指标与方法
1.4.1 小鼠一般状况 在实验周期中,观察各组小鼠饮食、活动、精神、毛发、粪便性状及生存情况,并绘制各组小鼠生存曲线。
1. 4. 2 小鼠成瘤情况 实验结束前禁食8 h,用2%戊巴比妥钠麻醉小鼠,将胸腔和腹腔剖开。从盲肠的末端开始,逐步分离结肠和直肠,一直到达肛门处。PBS漂洗结肠,观察小鼠成瘤情况并计算肿瘤体积[(最长径×垂直短径2)/2]。
1.4.3 脾指数测定 实验周期结束后,解剖各组小鼠取脾组织,吸水纸将组织表面的水分吸干,称取质量,并计算脾指数。脾指数=脾质量(mg)/体质量(g)。
1.4.4 ELISA法检测小鼠血清中IgG、IgM、IL-1β和IL-18 水平 实验结束前禁食8 h,小鼠麻醉满意后,抽取腹主动脉血,离心取血清。按照ELISA试剂盒说明书检测血清中IgG、IgM 水平和炎症因子IL-1β和IL-18水平。
1. 4. 5 流式细胞仪检测外周血T 细胞CD3+、CD4+、CD8+水平 取各组小鼠全血100 μL,置于2 mL 不含肝素的EP 管中,分别加入2 μL 的CD4+抗体和5 μL 的CD3+、CD8+抗体,充分振荡均匀,在室温的环境中避光反应15 min。将1.5 mL的红细胞裂解液加入到样品中染色,混匀后,在4 ℃环境中避光孵育15 min,以离心机1 000 r/min(离心半径15 cm)的速度离心5 min。收集并弃掉上清液,用PBS溶液洗涤沉淀1次,后将0.5 mL的PBS稀释沉淀,于流式细胞仪上检测各组小鼠全血中CD3+、CD4+、CD8+水平,并计算CD4+/CD8+比值。
1. 4. 6 HE 染色法检测结肠组织病理学变化 取小鼠结肠组织固定于4%多聚甲醛溶液中,石蜡包埋后切片,经酒精脱水,二甲苯中透明。加入苏木素染色,蒸馏水冲洗后酒精脱水,伊红染色,于显微镜下观察。
1. 4. 7 16S-rDNA 肠道菌群测序 收集各组小鼠粪便,使用磁珠法土壤和粪便基因组DNA 提取试剂盒抽提粪便中DNA,电泳质检并定量DNA 定量。加入338F(5’-ACTCCTACGGGAGGCAGCAG-3’)-806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物,对16S rRNA 基因扩增。扩增条件:预变性95 ℃、3 min,变性95 ℃、30 s,退火55 ℃、30 s,延伸72 ℃、30 s,共27 个循环。将提取的DNA于-80 ℃环境保存,将PCR产物构建测定文库,用Illumina MiSeq 平台测序并分析数据。使用QIIME程序对序列进行生物学分析,uPares软件对有效数据在97%水平的操作分类单元(OTU)行聚类分析。根据OTU 结果(包括Observed 指数、Chao1 指数和Shannon 指数),以微生物多样性分析比较组间菌群差异。
1. 4. 8 蛋白免疫印迹(Western Blot)法检测结肠组织中AIM2、ASC、caspase-1 蛋白表达 取结肠组织,提取总蛋白,用BCA 法检测总蛋白浓度。将蛋白溶液的终浓度配制为2 μg/mL,置于热水中煮沸10 min,后保存在-20 ℃冰箱中。将30 μg的蛋白样品用200 V 电压电泳,转移蛋白样品于PVDF膜上,用5%脱脂奶粉封闭PVDF 膜1 h。将一抗(1∶500 稀释)加入到PVDF 膜上,4 ℃孵育过夜。洗膜后,加入HRP 标记的二抗(1∶1 000),室温孵育2 h。加入ECL 放光液,曝光显影后用Image Lab软件分析条带灰度值。
1.5 统计方法 采用Graphpad priam 8.0软件进行统计学分析,计量资料以均数± 标准差()表示。针对多组间的数据,采用单因素方差分析(One-way ANOVA)来进行统计学比较,组间两两比较采用LSD-t检验。采用Kaplan-Meier法绘制生存曲线,进行Log-Rank 检验比较生存率之间的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠一般情况比较 除正常组外,其余各组小鼠在肠炎Ⅰ期饮用3%DSS 第5 天起肠炎症状最为明显,腹泻严重且伴有出血,进食饮水量减少,毛色暗淡,精神状态差,活动减少。恢复6 d 后肠炎症状逐渐减轻,10 d 后体质量恢复平稳,此时给药组开始给药干预。肠炎Ⅱ、Ⅲ期小鼠症状较Ⅰ期症状有所减轻,此时为肠炎慢性期,可见药物组小鼠的状态明显好于模型组。造模80 d 后小鼠结肠肿瘤逐渐形成,部分可见肛外瘤。
2.2 各组小鼠生存率及肿瘤体积比较 图1 结果显示:正常组小鼠生存率为100%;与正常组比较,模型组小鼠生存率显著降低(P<0.05),生存率为20%(2/10),肿瘤体积显著增加(P<0.05);与模型组比较,益肠散结颗粒低、中、高剂量组小鼠生存率显著升高(P<0.05),分别为40%(4/10)、50%(5/10)、90%(9/10),肿瘤体积减少(P<0.05),且呈剂量依赖性;益肠散结颗粒高剂量组小鼠生存率[均为90%(9/10)]、肿瘤体积与pcDNA-AIM2组比较,差异无统计学意义(P>0.05)。
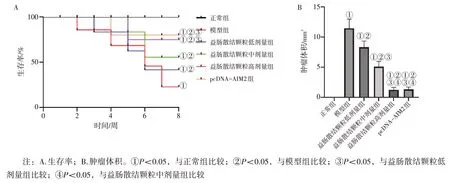
图1 各组小鼠生存率和肿瘤体积比较Figure 1 Comparison of survival and tumor volume in mice among various groups
2. 3 各组小鼠血清中IgG、IgM、IL-1β 和IL-18水平比较 图2结果显示:与正常组比较,模型组小鼠血清中IgG、IgM水平显著降低,IL-1β、IL-18水平显著升高(均P<0.05);与模型组比较,益肠散结颗粒低、中、高剂量组小鼠血清中IgG、IgM水平显著升高,IL-1β、IL-18 水平显著降低(均P<0.05),且呈剂量依赖性;益肠散结颗粒高剂量组小鼠血清中IgG、IgM、IL-1β 和IL-18 水平与pcDNA-AIM2 组比较,差异无统计学意义(P>0.05)。
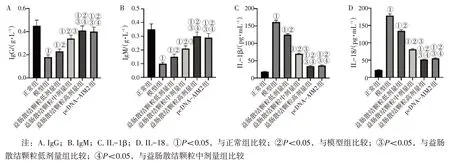
图2 各组小鼠血清中IgG、IgM、IL-1β和IL-18水平比较Figure 2 Comparison of serum levels of IgG,IgM,IL-1β,and IL-18 among various groups of mice
2.4 各组小鼠外周血T 细胞CD3+、CD4+、CD8+水平比较 图3结果显示:与正常组比较,模型组小鼠外周血中CD3+、CD4+水平及CD4+/CD8+比值降低,CD8+水平升高(均P<0.05);与模型组比较,益肠散结颗粒低、中、高剂量组小鼠外周血中CD3+、CD4+水平及CD4+/CD8+比值升高,CD8+水平降低(均P<0.05),且呈剂量依赖性;益肠散结颗粒高剂量组小鼠外周血中CD3+、CD4+、CD8+水平及CD4+/CD8+比值与pcDNA-AIM2 比较,差异无统计学意义(P>0.05)。
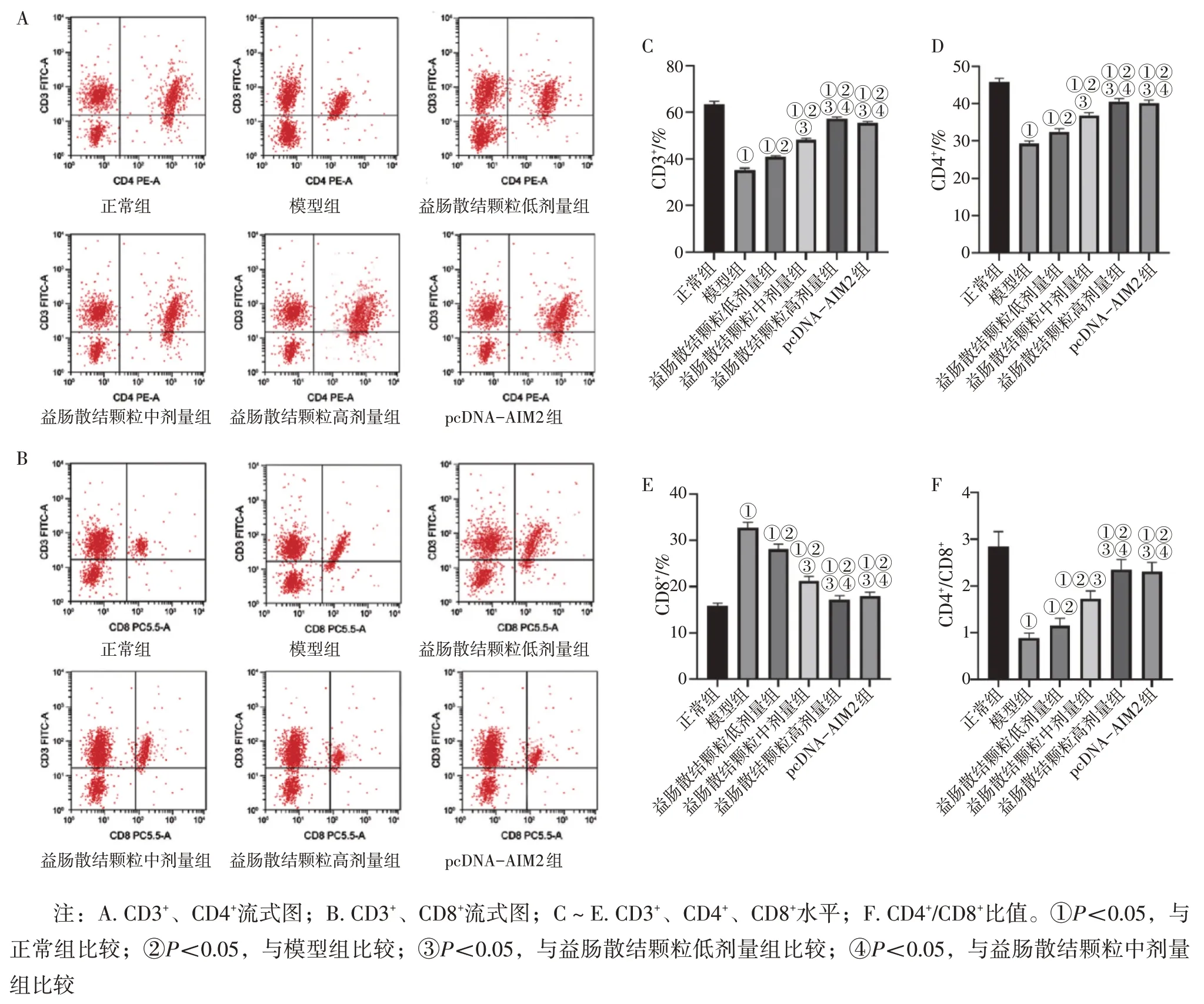
图3 各组小鼠外周血T细胞CD3+、CD4+、CD8+水平比较Figure 3 Comparison of levels of peripheral blood CD3+,CD4+,CD8+T cells among various groups of mice
2.5 各组小鼠脾指数比较 图4 结果显示:与正常组比较,模型组小鼠脾指数显著升高(P<0.05);与模型组比较,益肠散结颗粒低、中、高剂量组小鼠脾指数显著降低(P<0.05),且呈剂量依赖性;益肠散结颗粒高剂量组小鼠脾指数与pcDNA-AIM2组比较,差异无统计学意义(P>0.05)。
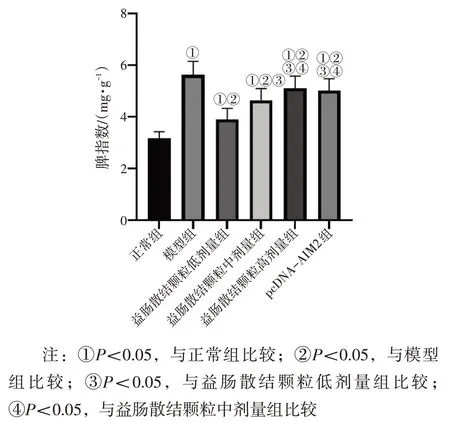
图4 各组小鼠脾指数比较Figure 4 Comparison of splenic index among various groups of mice
2.6 各组小鼠结肠组织病理学变化比较 图5 结果显示:正常组小鼠结肠隐窝排列紧凑整齐,黏膜层和肌层结构完整;模型组小鼠有显著的隐窝腺瘤,且伴有炎症浸润,隐窝分支且扩张;与模型组比较,益肠散结颗粒中剂量组、益肠散结颗粒高剂量组和pcDNA-AIM2 组结肠组织恶性程度显著降低,隐窝腔虽有部分扩张,但大部分较为完整。
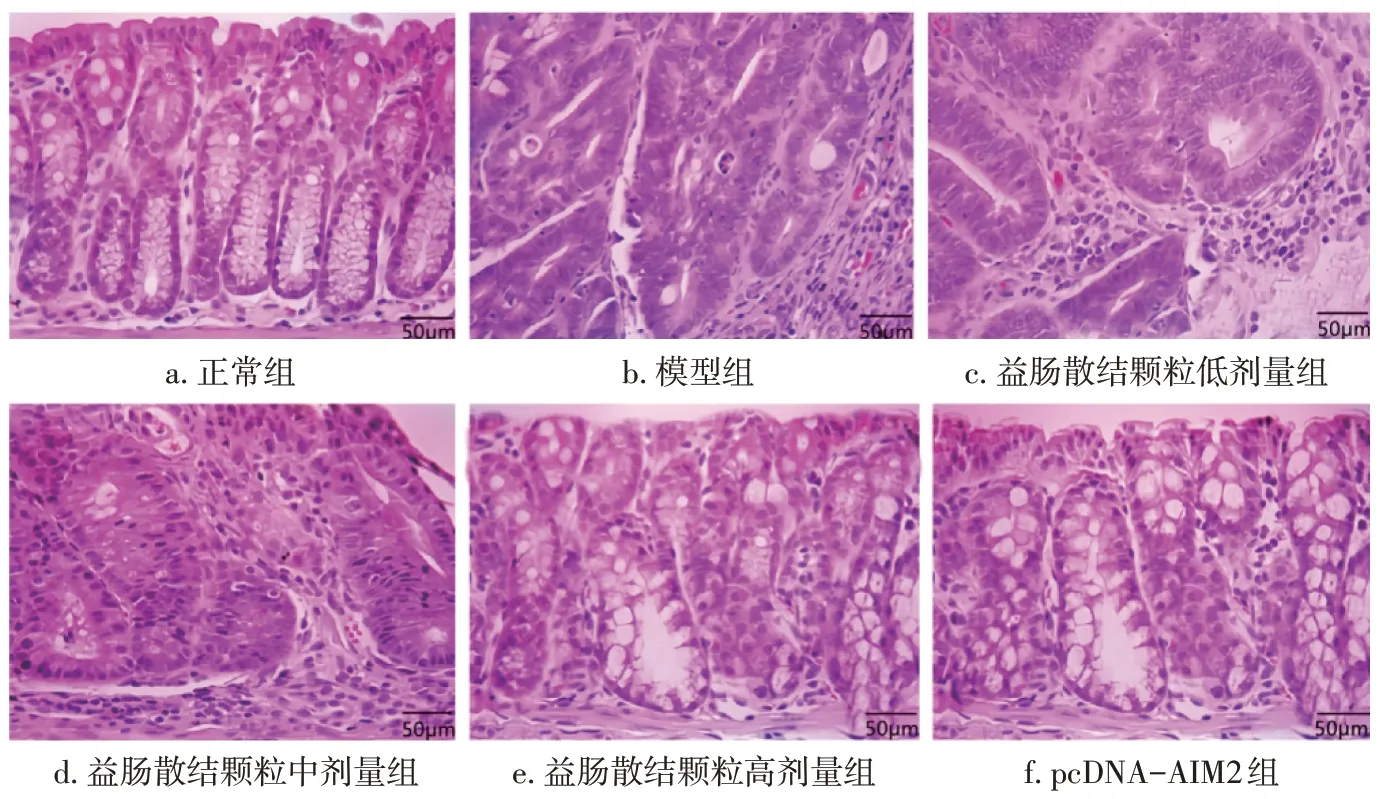
图5 各组小鼠结肠组织HE染色结果(×200)Figure 5 HE staining results of mice colon tissue in each group(×200)
2.7 各组小鼠肠道菌群α 多样性比较 图6 结果显示:与正常组比较,模型组小鼠Observed 指数、Chao1 指数和Shannon 指数均显著降低(P<0.05);与模型组比较,益肠散结颗粒低、中、高剂量组小鼠Observed 指数、Chao1 指数和Shannon 指数均升高(P<0.05),且呈剂量依赖性;益肠散结颗粒高剂量组小鼠Observed 指数、Chao1 指数和Shannon 指数与pcDNA-AIM2 组比较,差异无统计学意义(P>0.05)。
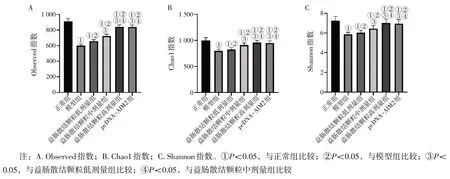
图6 各组小鼠肠道菌群α多样性比较Figure 6 Comparison of the α diversity of the intestinal flora in various groups of mice
2.8 各组小鼠肠道菌群群落结构比较
2.8.1 门水平上 图7-A 结果显示:与正常组比较,模型组拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)菌落相对丰度显著降低,厚壁菌门(Firmicutes)、 放线菌门(Actinobacteria)和Patescibateria 菌落相对丰度显著升高(P<0.05);与模型组比较,益肠散结颗粒低、中、高剂量组拟杆菌门和变形菌门菌落相对丰度显著升高,厚壁菌门、放线菌门和Patescibateria菌落相对丰度显著降低(P<0.05);益肠散结颗粒高剂量组肠道菌群菌落相对丰度与pcDNA-AIM2 组比较,差异无统计学意义(P>0.05)。
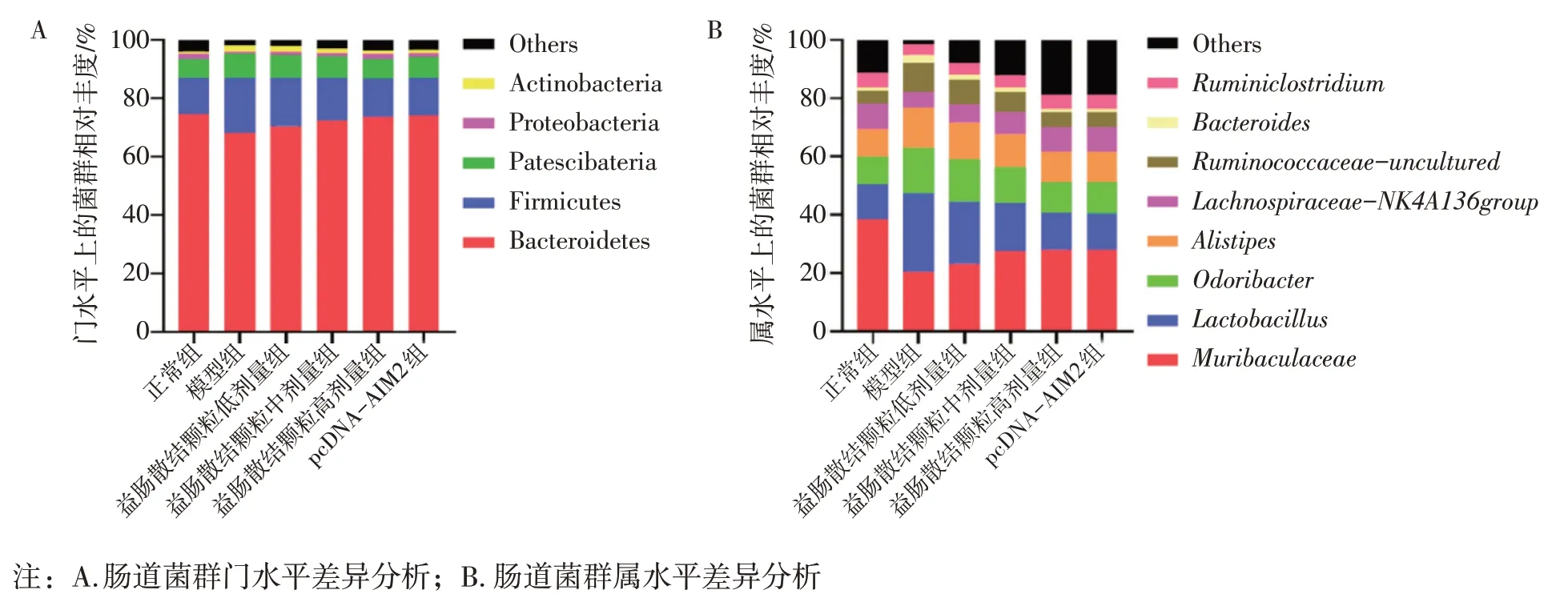
图7 各组小鼠肠道菌群结构图Figure 7 Structure of intestinal flora in each group of mice
2.8.2 属水平上 图7-B 结果显示:与正常组比较,模型组鼠杆菌科(Muribaculaceae)、毛螺菌属(Lachnospiraceae-NK4A136group)和瘤胃梭菌属(Ruminiclostridium)菌落相对丰度显著降低,乳杆菌属(Lactobacillus)、臭杆菌属(Odoribacter)、别样杆菌属(Alistipes)、未培养的瘤胃球菌科(Ruminococcaceaeuncultured)和拟杆菌属(Bacteroides)菌落相对丰度显著升高(P<0.05);与模型组比较,益肠散结颗粒低、中、高剂量组杆菌科、毛螺菌属和瘤胃梭菌属菌落相对丰度显著升高,乳杆菌属、臭杆菌属、别样杆菌属、未培养的瘤胃球菌科和拟杆菌属菌落相对丰度显著降低(P<0.05);益肠散结颗粒高剂量组肠道菌群菌落相对丰度与pcDNA-AIM2组比较,差异无统计学意义(P>0.05)。
2.9 各组小鼠结肠组织中AIM2、ASC、caspase-1蛋白表达比较 图8结果显示:与正常组比较,模型组小鼠结肠组织中AIM2、ASC、caspase-1 蛋白表达水平显著升高(P<0.05);与模型组比较,益肠散结颗粒低、中、高剂量组小鼠结肠组织中AIM2、ASC、caspase-1 蛋白表达水平显著降低(P<0.05),且呈剂量依赖性;益肠散结颗粒高剂量组小鼠结肠组织中AIM2、ASC、caspase-1 蛋白表达与pcDNA-AIM2 组比较,差异无统计学意义(P>0.05)。
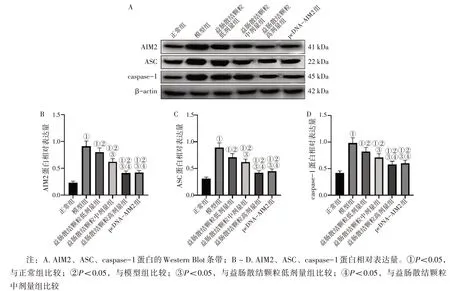
图8 各组小鼠结肠组织中AIM2、ASC、caspase-1蛋白表达比较Figure 8 Comparison of protein expressions of AIM2,ASC,and caspase-1 in the colonic tissues among various groups of mice
3 讨论
结肠癌归属于中医学“积聚”“脏毒”“肠积”“锁肛痔”等病症范畴,病机特点为正虚为本,邪实为标。正气不足,脏腑功能失调,加之各种致病因素导致痰凝、湿滞、血瘀、热毒等证候要素出现,使得邪毒内侵,长期闭阻经脉,阻碍气血畅通,精血和津液凝聚,邪毒在肠道内瘀结,最终演变成为肠癌[10]。故结肠癌以正气不足、脾肾功能失调为根本病机,同时发生湿热、瘀毒等证候要素相互结合[11]。侯爱画教授认为,治疗结肠癌应以中西医结合的方式,二者取长补短,使临床疗效最大化,创立了中药复方益肠散结方。全方注重扶正驱邪,共奏补脾燥湿、散结软坚的功效。本研究采用AOM 和DSS 诱导结肠癌小鼠模型,结果显示,模型组小鼠生存率和肿瘤体积显著增加,不同剂量的益肠散结颗粒均可抑制小鼠生存率和肿瘤体积,提示益肠散结颗粒对结肠癌小鼠有较好的疗效。
细胞免疫系统在机体免疫对抗肿瘤中扮演主要角色,而作为细胞免疫最重要的T淋巴细胞,则通过功能各异的T淋巴细胞亚群来发挥免疫调节作用。其中,CD3+细胞分布在每个T淋巴细胞中,代表T淋巴细胞的总数,还可以作为鉴别T淋巴细胞的指标。CD4+细胞主要是辅助体液免疫和细胞免疫,若CD4+细胞的表达水平降低,会通过降低免疫反应的诱导作用降低机体抗肿瘤的能力[12]。CD8+细胞是一种抑制性T淋巴细胞,可抑制自身抗体生成负性调控免疫反应[13]。当CD4+/CD8+比值较低时,机体的免疫系统的功能会受到影响,对外界病原微生物和突变细胞的识别和杀伤能力会降低,从而为肿瘤的迅速生长、转移以及继发感染等病理过程创造了条件[14]。本研究结果显示,益肠散结颗粒可增加结肠癌小鼠外周血中CD3+、CD4+水平及CD4+/CD8+比值,降低CD8+水平,提示益肠散结颗粒可增强结肠癌小鼠机体免疫功能,增强机体识别杀伤突变细胞的能力。
免疫球蛋白是机体免疫防御机制的重要组成部分,能识别并消灭外来病原体和异常细胞。当B淋巴细胞接触到外来的病原体时,就会开始分泌免疫球蛋白,包括IgA、IgG、IgM等。这些抗体可以识别与病原体相关的物质,并对其进行结合与破坏,从而发挥体液免疫的作用[15]。其中,IgG 是血液中主要的免疫球蛋白,可以激活补体和促进吞噬功能,在机体再次遭受同样病原体攻击时,扮演着关键的角色[13]。本研究结果发现,益肠散结颗粒能够增加结肠癌模型小鼠血清中IgG和IgM的含量,表明益肠散结颗粒有助于提高结肠癌小鼠自身的体液免疫能力,从而能更好地对抗结肠癌的侵袭。
脾指数是指脾脏大小在体内所占比例,可评估机体的免疫防御和造血功能[16]。本研究结果显示,益肠散结颗粒可抑制结肠癌小鼠脾指数,进一步证实益肠散结颗粒可增加结肠癌小鼠自身免疫力。
肠道菌群是一个复杂的微生态系统,在肠道结构、免疫及代谢作用中起重要作用,通过其代谢物参与碳水化合物和蛋白的水解发酵,影响肠上皮细胞增殖和分化[17]。肠道菌群微生物组成的改变有利于致癌细菌的滋生,影响结肠癌的相关微环境。α多样性反应的是单个样品物种丰度及物种多样性,其中,Observed和Chao1指数越高代表菌群丰度越高,Shannon 值越大代表菌群多样性越高。谢辉等[18]研究证实,可通过增加小鼠肠道菌群丰度及多样性抑制结肠癌的发展。本研究结果显示,益肠散结颗粒可增加肠道菌群丰度和多样性,且能抑制厚壁菌门、放线菌门和Patescibateria菌落及乳杆菌属、臭杆菌属、别样杆菌属、未培养的瘤胃球菌科和拟杆菌属菌落相对丰度,纠正肠道菌群紊乱,通过调节菌群而抑制肠癌的发展。
AIM2 是一种细胞内模式识别受体,能够激活炎症小体的形成[19]。炎症小体由3 种蛋白质组成,包括感受器、接头蛋白ASC 和效应分子caspase 前体。炎症小体的主要作用是激活caspase-1,将IL-1β、IL-18 等细胞因子的前体切割为成熟的细胞因子,从而发挥促进炎症反应的作用。炎症小体是炎症反应关键的组成部分,其失调与多种慢性炎症、感染和自身免疫性疾病密切相关[20]。Zhu等[21]研究证实,结肠癌易敏感的AIM2-/-小鼠因肠道微生物群失调而加重,但与健康小鼠肠道微生物群的交换改善了结肠癌易感性。因此推测,AIM2在结肠癌中起着保护作用,其可能通过炎症小体独立的方式发挥功能,控制肠道干细胞增殖,调节肠道微生物群。本研究结果显示,益肠散结颗粒可增加结肠癌小鼠肠道组织中AIM2、ASC 和caspase-1 蛋白表达,抑制血清中IL-1β、IL-18 水平,提示益肠散结颗粒可能通过促进结肠癌AIM2炎性小体的激活,调节肠道菌群平衡,增加自身免疫力。为了进一步验证本结果,本研究采用过表达AIM2质粒和高剂量益肠散结颗粒联合干预结肠癌小鼠,结果显示,过表达AIM2和高剂量益肠散结颗粒具有相似的作用,均能激活AIM2 信号,增强自身免疫力,改善肠道菌群结构。
综上所述,益肠散结颗粒可增强结肠癌小鼠自身免疫力,改善肠道菌群结构,其作用机制可能与激活AIM2炎性小体有关。由于时间和成本等因素,本研究尚未对AIM2炎性小体对益肠散结颗粒改善结肠癌小鼠肠道菌群的影响进行验证,使本研究结果存在一定局限性,在今后的研究中会完善相关的实验研究,为临床治疗结肠癌提供更多真实有效的实验依据。

