基于下丘脑瘦素受体介导的JAK2/STAT3通路探讨穴位埋线治疗食源性肥胖大鼠的中枢机制
张荣, 伍先明, 杨硕, 莫倩
(1.贵州中医药大学,贵州贵阳 550025;2.贵州中医药大学第二附属医院,贵州贵阳 550003)
肥胖是心脑血管等疾病的高危因素,我国肥胖发生率逐年升高[1]。肥胖防治问题亟需解决。机体能量代谢紊乱是导致肥胖发生的重要原因。下丘脑是调控机体能量稳态的重要高级中枢[2],而瘦素(leptin)是中枢神经系统调节机体能量代谢的关键上游因子,主要通过下丘脑长型瘦素受体(LepR)介导的Janus激酶2(JAK2)/信号转导和转录激活因子3(STAT3)通路传递能量代谢信号[3]。穴位埋线减肥在临床上已被证实是一项安全有效的方法[4]。团队前期研究发现,以中脘、水道、天枢、脾俞、胃俞、三焦俞等穴组方,穴位埋线治疗肥胖症临床疗效显著[5-6],其机制可能与调控血清瘦素的表达从而良性调节外周脂肪代谢有关[7-8],但是否同时影响中枢有待于进一步研究。因此,在前期研究的基础上,本研究以下丘脑LepR介导的JAK2/STAT3通路为切入点,观察该通路在正常状态下及被特异性阻断剂AG490 阻断时,穴位埋线对食源性肥胖(diet-induced obesity,DIO)大鼠减重降脂效用变化,初步探讨穴位埋线治疗肥胖症的中枢机制,以期为临床治疗本病提供科学佐证,现将研究结果报道如下。
1 材料与方法
1. 1 实验动物 健康SPF 级雄性SD 大鼠40 只,1 月龄,体质量120~140 g,购自第三军医大学实验动物中心,实验动物生产许可证号:SCXK(渝)2017-0002,饲养于贵州中医药大学动物实验中心,光照12 h 昼夜交替,室温(23±2)℃,湿度(40±5)%。本研究获得贵州中医药大学第二附属医院伦理委员会批准(审批号:2015088)。动物的处置严格遵照《关于善待实验动物的指导性意见》[9]。
1.2 试剂与仪器 AG490(美国MCE公司);甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)生化检测试剂盒(南京建成生物工程研究所);瘦素检测试剂盒(武汉华美生物工程有限公司);RNA 提取及纯化试剂盒(德国Qiagen 公司);RNA 逆转录试剂盒、PCR扩增试剂盒(日本TaKaRa公司);LepR兔多抗、JAK2 兔单抗、STAT3兔单抗(美国Abcam公司);β-actin抗体、羊抗兔IgG二抗(北京博奥森生物技术有限公司)。7号一次性埋线针(苏州市吴中区东方针灸器械厂);3-0号羊肠线(上海信成医疗器械有限公司);凝胶扫描成像系统、CFX96荧光定量PCR仪(美国Bio-Rad公司);酶标仪、核酸蛋白测定仪(美国Thermo Fisher Scientific公司)。
1. 3 模型制备与分组 大鼠适应性喂养1 周后,采用随机抽样的方法选取10 只作为正常组,给予普通饲料饲养。剩余30 只大鼠给予高脂饲料(配方:普通饲料60%,猪油12%,鸡蛋10%,花生、奶粉、蔗糖各5%,食盐2%,麻油1%,由北京科澳协力有限公司配制)饲养25 周建立DIO 模型[10-11],自由摄食、饮水。25周后体质量高于正常组平均体质量20%及以上的示为造模成功[12]。将DIO 造模成功后的大鼠随机分为模型组、埋线组、埋线+AG490组,每组10只。
1. 4 干预方法 埋线组、埋线+AG490 组在造模成功后第1、8、15、22 天进行埋线治疗,操作方法:参照文献研究[13-16]选取中脘、水道、天枢、脾俞、胃俞、三焦俞等穴位,自制固定架固定大鼠,穴区皮肤备皮,将0.5~0.6 mm 的3-0 号羊肠线用7 号一次性埋线针埋入上述穴位的脂肪层[7],共治疗4 次。埋线+AG490 组埋线期间每天腹腔注射AG490(1 mg/kg)[17]。正常组和模型组仅抓取固定。干预期间,各组均用普通饲料饲养,自由饮水摄食。
1.5 观察指标与检测方法
1.5.1 样本采集 治疗结束后大鼠禁食过夜,腹主动脉取血,离心后将上清液转移到无菌EP 管中,-80 ℃冰箱冷冻保存。处死大鼠后迅速取下丘脑组织分装至无酶EP 管,液氮速冻后-80 ℃冰箱保存备用。
1.5.2 血清生化指标及瘦素检测 采用ELISA 方法检测各组血清TG、TC、LDL-C、HDL-C及瘦素水平,检测步骤严格按照试剂盒说明书进行。
1. 5. 3 Western Blot 法检测下丘脑LepR、JAK2、STAT3蛋白表达 提取下丘脑总蛋白,二喹啉甲酸(BCA)法测定蛋白浓度。根据目的蛋白的分子量配制相应浓度的分离胶和浓缩胶,以β-actin 为内参,采用十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)(恒压60 V 持续1 h,120 V 持续30 ~40 min),湿转法转膜(恒流,250 mA,约3 h),封闭,TBST 洗膜。分别加入一抗(LepR 1∶1 500,JAK2 1∶5 000,STAT3 1∶2 000,β-actin 1∶5 000),4 ℃孵育过夜。TBST 洗膜,加入羊抗兔IgG 二抗(稀释比例为1∶10 000)孵育1.5 h。TBST洗膜后再加入增强化学发光(ECL)显影剂,放入化学发光成像系统,进行自动曝光,并保存图片。用Image Lab Software 5.2分析条带,计算灰度值。
1.5.4 实时定量聚合酶链反应(RT-PCR)法检测下丘脑中LepR、JAK2、STAT3 mRNA 表达 提取下丘脑总RNA 并检测其浓度及纯度。逆转录生成cDNA。按PCR 扩增试剂盒配制反应液进行扩增,反应程序:预变性95 ℃、30 s;变性95 ℃、5 s,退火60 ℃、30 s,扩增39 个循环;变性95 ℃、10 s,延伸65 ℃、5 s,酶瞬间灭活97 ℃、5 s。以GAPDH 为内参,用2-ΔΔCt法计算目的基因相对表达量。引物序列见表1。引物由生工生物工程(上海)股份有限公司合成。

表1 PCR引物序列Table 1 PCR primer sequences
1. 6 统计方法 采用SPSS 26.0 软件进行数据处理。计量资料以均数±标准差()表示,多组间比较采用单因素方差分析。如果方差齐,进一步两两比较采用LSD 检验;如果方差不齐,两两比较则采用Tamhane’s T2 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠干预前后体质量比较 图1 结果显示:干预前,与正常组比较,模型组、埋线组、埋线+AG490组大鼠体质量均升高(P<0.01),提示DIO 造模成功;与模型组比较,埋线组、埋线+AG490 组体质量无显著性差异(P>0.05),具有可比性。干预后,与模型组比较,埋线组体质量降低(P<0.01);与埋线+AG490组比较,埋线组体质量降低(P<0.01)。

图1 各组大鼠干预前后体质量比较Figure 1 Comparison of body mass among various groups of rats before and after intervention
2. 2 各组大鼠血清TG、TC、LDL-C、HDL-C含量比较 图2结果显示:与正常组比较,模型组TG、TC、LDL-C 含量均升高(P<0.05),HDL-C无显著性差异(P>0.05);与模型组比较,埋线组TG、TC、LDL-C 含量降低(P<0.05),HDL-C 无显著性差异(P>0.05);与埋线+AG490组比较,埋线组TG、TC、LDL-C含量降低(P<0.05),HDL-C无显著性差异(P>0.05)。
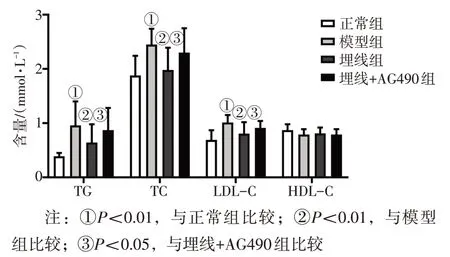
图2 各组大鼠血清TG、TC、LDL-C、HDL-C水平比较Figure 2 Comparison of serum TG,TC,LDL-C,HDL-C levels among various groups of rats
2.3 各组大鼠血清瘦素比较 图3 结果显示:与正常组比较,模型组瘦素水平升高(P<0.01);与模型组比较,埋线组瘦素水平降低(P<0.01);与埋线+AG490 组比较,埋线组瘦素水平降低(P<0.05)。
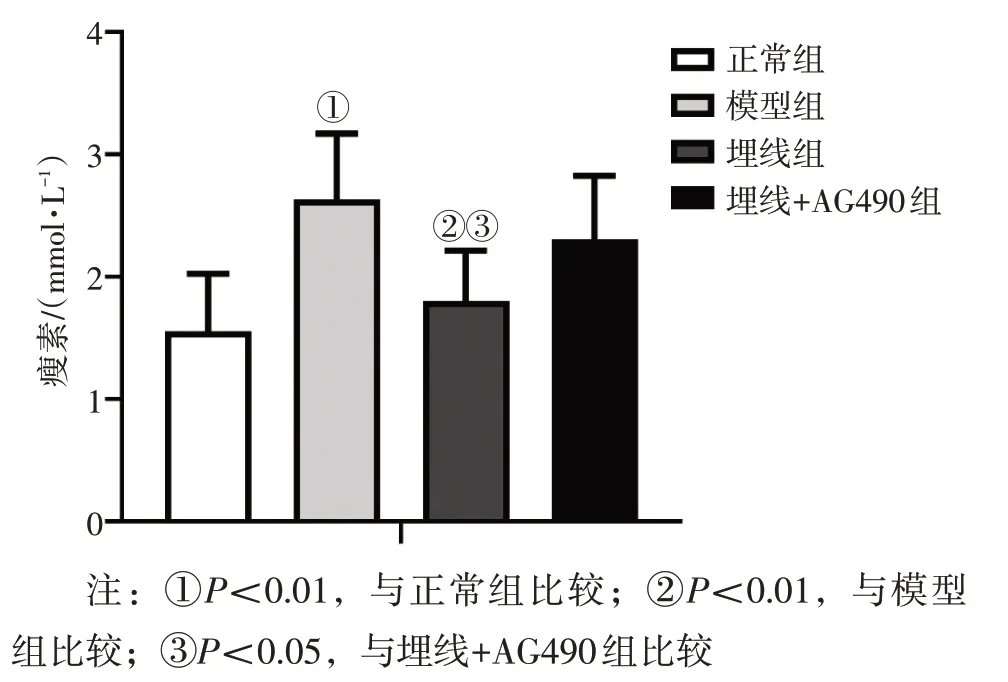
图3 各组大鼠血清瘦素水平比较Figure 3 Comparison of serum leptin level among various groups of rats
2. 4 各组大鼠下丘脑组织LepR、JAK2、STAT3 mRNA表达水平比较 图4结果显示:与正常组比较,模型组LepR、JAK2、STAT3 mRNA 表达水平均降低(P<0.01);与模型组比较,埋线组LepR、JAK2、STAT3 mRNA 表达量均升高(P<0.01);与埋线+AG490 组比较,埋线组LepR、JAK2、STAT3 mRNA表达量均升高(P<0.01)。
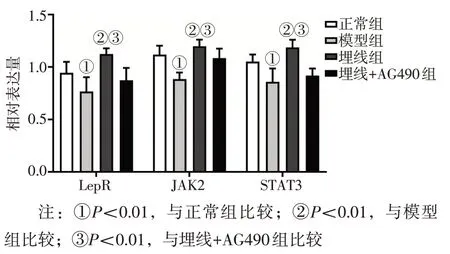
图4 各组大鼠下丘脑组织中的LepR、JAK2、STAT3 mRNA表达水平比较Figure 4 Comparison of mRNA expression levels of LepR,JAK2 and STAT3 in hypothalamus tissue among various groups of rats
2. 5 各组大鼠下丘脑组织LepR、JAK2、STAT3蛋白表达水平比较 图5 结果显示:与正常组比较,模型组LepR、JAK2、STAT3 蛋白表达水平均降低(P<0.01);与模型组比较,埋线组LepR、JAK2、STAT3 蛋白表达水平均升高(P<0.01);与埋线+AG490组比较,埋线组LepR、JAK2、STAT3蛋白表达水平均升高(P<0.01)。
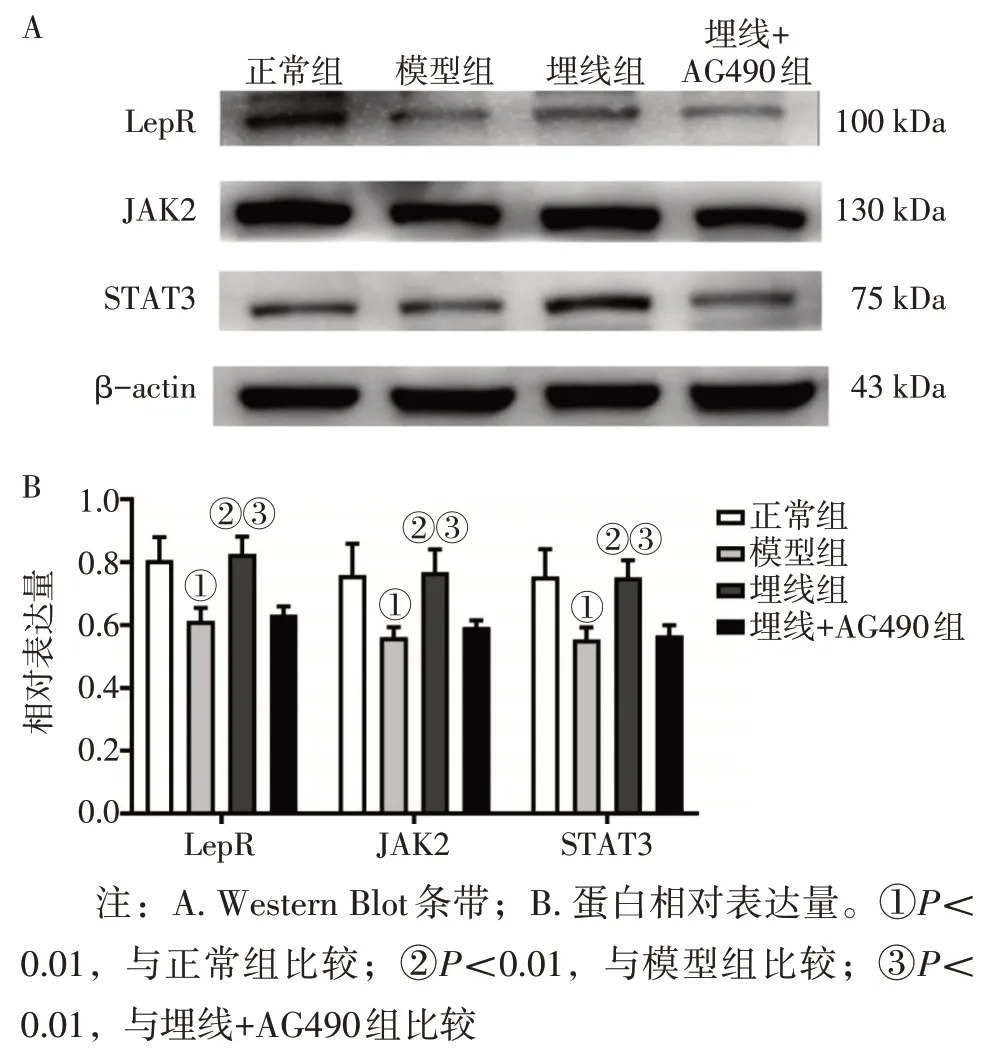
图5 各组大鼠下丘脑组织中的LepR、JAK2、STAT3蛋白表达水平比较Figure 5 Comparison of protein expression levels of LepR,JAK2 and STAT3 in hypothalamus tissue among various groups of rats
3 讨论
中医学认为,肥胖多与饮食不节、劳逸失调等因素有关,基本病机为脾胃虚衰,运化功能失常,痰湿聚集,壅滞脏腑经络[18],病位主要在脾胃,故肥胖治疗多以调脾胃、祛痰湿为主。本团队前期临床研究[5-6]显示,穴位埋线治疗肥胖症临床疗效显著,且基础研究[7-8]结果显示,在降低肥胖大鼠体质量、Lee’s指数以及调节外周脂质代谢方面,脂肪层埋线效果优于肌肉层埋线。因此,本研究采用脂肪层穴位埋线的方法,选取脾胃经之背俞穴脾俞、胃俞以健脾和胃,胃、大肠经之募穴中脘、天枢以和胃气,调节胃肠,配合水道、三焦俞以疏利三焦、通调水道,达健脾胃、祛痰湿、利水道之功。结果显示,脂肪层穴位埋线可显著降低食源性肥胖(DIO)大鼠的体质量,下调血清TG、TC、LDL-C水平,调节脂质代谢。
目前肥胖动物多以饮食诱导为主[19],故本研究以高脂饮食诱导建立DIO 模型,以体质量超过同期普通饲料饲养大鼠的20%为造模成功的标准[12]。
肥胖的发生是遗传、社会环境等因素共同作用的结果。下丘脑是机体调控能量平衡和代谢的高级中枢,是导致肥胖患者脂肪组织聚集的关键区域,同时也是瘦素发挥作用的主要靶器官[20]。瘦素是防治肥胖的重要靶点,具有减少能量摄入、促进能量消耗、抑制脂肪合成并促进其分解的生理功能,同时作为“信使”,向中枢神经系统反映机体能量储存情况[21]。既往临床研究[22]显示,肥胖患者血清瘦素水平偏高,但不能抑制食欲,提示机体对瘦素的代谢性调节作用敏感性降低,这种现象称为“瘦素抵抗”。出现“瘦素抵抗”的原因错综复杂,JAK2/STAT3 通道活性降低是导致机体出现“瘦素抵抗”重要原因之一[23]。下丘脑LepR介导的JAK2/STAT3通路是目前已知的瘦素发挥调节机体能量代谢的主要信号通路,瘦素正常生物学效应的发挥与JAK2/STAT3 通路活性呈正相关。瘦素经血液循环穿过血脑屏障到达下丘脑,与长型LepR 结合后通过激活JAK2,使LepR 上的酪氨酸残基磷酸化,被磷酸化的酪氨酸残基通过特异性的招募结合使STAT3活化并形成二聚体,STAT3二聚体转移至细胞核内通过调节目的基因的转录从而发挥瘦素作用[24]。
本研究结果显示:穴位埋线后,DIO大鼠体质量,瘦素,TG、TC、LDL-C 水平降低,LepR、JAK2、STAT3 mRNA 和蛋白表达升高,说明穴位埋线能够激活LepR 介导的JAK2/STAT3 通路,纠正瘦素抵抗。AG490 可通过与受体酪氨酸酶竞争结合位点特异性阻断JAK2/STAT3 通路[25]。穴位埋线的同时腹腔注射AG490,DIO大鼠各项指标与模型组相当,基本上抵消了穴位埋线的治疗效应。这一结果双重证明:下丘脑LepR 介导的JAK2/STAT3通路参与了穴位埋线降低DIO大鼠体质量的调节过程。
综上所述,穴位埋线对DIO 大鼠具有良好的减重降脂作用,其中枢作用机制可能与下调血清瘦素水平,激活下丘脑LepR 介导的JAK2/STAT3通路有关。本研究为临床上采用穴位埋线治疗肥胖症提供了一定的科学依据,但也存在一些不足,如虽采用公认的饮食诱导建立DIO 模型,但造模成功的评价标准较为单一,可能对实验结果有一定的影响,且观察指标中未纳入下丘脑相关的形态学指标进行分析。研究中还发现,抑制JAK2/STAT3通路后,LepR、JAK2 mRNA水平也有所改善,推测穴位埋线可能同时通过其他中枢或外周途径调节机体能量代谢,今后有待采用光遗传等先进科学技术进一步验证。

