栀子TPS基因家族鉴定及与萜类物质代谢的相关性分析
李金燃,张麒功,陈丝雨,陈淑颖,陈清海,邹双全
(1.福建农林大学林学院,福州 350002;2.南平市延平区东坑林业站,福建 南平 353000;3.自然生物资源保育利用福建省高校工程技术研究中心,福州 350002;4.泉州市城市森林公园发展中心,福建 泉州 362000)
栀子(Gardenia jasminoides)别名黄栀子、山栀子、红果树、林兰,是茜草科(Rubiaceae)、栀子属(Gardenia)常绿灌木。栀子花香浓郁,是我国著名的八大香花之一[1],其挥发油带有强甜味的水果香,属名贵的花香香料之一,用于多种香型化妆品、香皂和香精中[2]。栀子有着重要的药用及观赏价值,其植株适应性强,成活率高,植株内含有多种经济价值较高的萜类(主要为环烯醚萜类、三萜类)、黄酮类、栀子苷、绿原酸、藏红花素等药用成分及可食用的色素,具有解热镇痛、保肝利胆等多种功效[3]。其花洁白精致,具有一定的观赏及食用价值,以花入药具有清肺凉血之功效,主治肺热咳嗽鼻衄之症[4]。
萜类化合物是一类结构多样的植物次生代谢产物[5],是植物芳香物质的重要组成成分,也是植物花器官吸引昆虫传粉、进行自我防御的主要物质[6]。萜类化合物是植物体内数目和种类最丰富的一类化合物,究其原因,正是由于萜类合成酶(terpene synthase,TPS)的多样性造成的[7]。萜类合成酶(TPS),是萜类化合物生物合成的末端关键酶,可催化不同的前体物质最终生成不同的萜类化合物[8],直接决定萜类产物生成的种类和数量[9],在植物生长发育中起重要作用[10]。萜类合成酶的作用效果极其多样,不但能够调节花香、促进生长调节等,同时对于植物的防御机制也有着巨大的意义[7]。萜类合成酶分别以牻牛儿基焦磷酸(GPP)、橙花基焦磷酸(NPP)、法呢基焦磷酸(FPP)和牻牛儿牻牛儿基焦磷酸(GGPP)为直接前体底物合成相应的单萜、倍半萜、二萜等物质[11]。TPS基因家族含有以RRX8R为基序的PF01397(N-末端)及以DDXXD 为基序的PF03936(C-末端)[12],可分为TPS-a、TPS-b、TPS-c、TPS-d、TPS-e/f、TPS-g、TPS-h[13]这7个亚家族。其中TPS-a、TPS-b、TPS-g为被子植物特有,TPS-h只在卷柏属[13-14]中发现。近年来,全基因组TPS基因家族在拟南芥(Arabidopsis thaliana)[15]、大花蕙兰(Cymbidium faberi)[16]、山茶(Camellia sinensis)[17]、月季(Rosa chinensis)[18]、竹叶花椒(Zanthoxylum armatum)[19]、葡萄(Vitis vinifera)[20]等植物中已鉴定,其中葡萄具有已知的最大TPS基因家族,多达69个TPS基因家族成员[18]。
萜类化合物在栀子花及花香挥发物占据主导地位[21],其萜类合成酶TPS基因家族鉴定和分析还未见报道。随着基因组测序技术的成熟,栀子基因组测序已经完成[22]。因此,本研究对栀子TPS基因家族进行鉴定,利用生物信息学的手段深入剖析栀子TPS基因家族的基因结构、进化模式等方面;通过外源激素喷施试验进行转录组测序,分析不同激素水平栀子花朵的表达情况,结合顶空固相微萃取和气相色谱-质谱联用技术,测定不同激素水平栀子花朵中萜类物质含量;为今后探索栀子TPS基因结构和功能奠定基础,深入研究TPS基因家族成员在栀子花香代谢调控中的作用提供理论参考依据。
1 材料与方法
1.1 GjTPS基因家族成员鉴定
准备拟南芥的TPS 蛋白序列(Tair:Arabidopsis.org)和栀子全基因组数据(NCBI:https://www.ncbi.nlm.nih.gov/)。在InterPro 网站(https://www.ebi.ac.uk/interpro/)下载含有2 个特定的TPS结构域(PF01397、PF03936)的种子文件,使用TBtools软件筛选栀子TPS家族基因,保留含有2个结构域且Evalue≤1×10-5的基因;通过本地Blast V3 程序(https://www.ncbi.nlm.nih.gov/blast/executables/blast+/LATEST/)获得栀子同源蛋白序列。将以上两个蛋白序列文件进行合并后去重复,再进一步用HMMER(https://www.ebi.ac.uk/Tools/hmmer/)在线网站进行结构域验证,去除不含TPS两个结构域的基因。GjTPS家族成员理化性质由Expasy(https://web.expasy.org/protparam/)提供,亚细胞定位预测分析则采用Euk-mPLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/euk-multi-2/)的数据。
1.2 栀子系统发育树、保守基序及基因结构分析
使用MEGA5 软件以muscle 将栀子GjTPS 蛋白序列进行多序对比,用最大似然法以JTT+G 模型建树,Bootstraps 设置重复次数1 000 次,其余参数为默认构建系统发育树。MEME 网站(https://memesuite.org/meme/tools/meme)预测保守基序,TBtools 软件绘制基因结构图。将GjTPS 保守基序、基因结构、保守结构域结果按照系统发育树顺序用TBtools软件分别进行可视化。
1.3 栀子与不同物种的系统发育分析
从在线网站EnsemblPlants(https://plants.ensembl.org/index.html)中下载拟南芥、葡萄的基因序列;中粒咖啡[23](Coffee canephora)基因序列于中粒咖啡基因组数据库(https://coffee-genome-hub.southgreen.fr/)下载。将栀子、拟南芥、葡萄、中粒咖啡TPS 家族蛋白序列集合,用MEGA5 软件进行多序对比,采用最大似然法构建系统发育树。使用Adobe Illustrator CC 2020软件进行美化分类。
1.4 染色体定位、基因重复类型及物种间共线性分析
根据鉴定的GjTPS基因ID 名称,使用TBtools 软件进行GjTPS基因染色体定位可视化及Blast 得到基因重复文件。于在线网站EnsemblPlants 下载月季与番茄(Solanum lycopersicum)[24]基因组,使用TBtools软件对栀子与自身及拟南芥、中粒咖啡、月季、番茄进行一一比对,得到共线性分析结果,并在TBtools软件中进行可视化,高亮其产生共线性的基因连线。
1.5 启动子顺式作用元件分析
41 个GjTPS基因上游(2000 bp)的序列由TBtools 软件得到,用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测启动子元件,并进行可视化。
1.6 外源激素喷施试验
于2022年12月选取长势基本一致且健康的2年生栀子分关1 号进行盆栽定植,2023年4月开始参考张云峰[25]、刑勇翔[7]的方法进行外源激素喷施试验,具体用量见表1(IAA、MeJA 试剂购自上海麦克林生化科技有限公司)。试验共7 个处理,每个处理20 个重复;喷施用量每次每盆50 mL,每隔7 d喷1次,共喷施2次。于6月10日采取每个处理盛花期的栀子花朵,用液氮速冻后置冰箱(-80 ℃)中保存,用于测定不同外源激素浓度下栀子花朵TPS基因家族成员的表达量。

表1 试验处理水平Table 1 Experimental treatment level
1.7 不同外源激素浓度下栀子花朵萜类物质含量测定
参考MARIE 等[26]的方法并作修改,采用顶空固相微萃取(HS-SPME)结合气相色谱-质谱联用技术(GC-MS),测定不同外源激素浓度下栀子花朵TPS基因对应产物的含量。气相色谱仪质谱仪品牌为Agilent,型号为6890N-G5795B;色谱柱为HP-5MS(30 m×0.25 mm×0.25 μm)。称取适量样品至20 mL顶空瓶中,加入内标2-辛醇,使其上机浓度为5 mg·L-1,加入饱和氯化钠,放入80 ℃加热30 min,30 min后用将顶空微萃取进样针扎入顶空瓶中继续加热30 min后,250 ℃进样口解析5 min。
色谱条件:初始柱温50 ℃保持2 min,以5 ℃·min-1升至180 ℃保持5 min,再以10 ℃·min-1升至250 ℃,保持5 min;进样口温度为250 ℃;传输线温度为280 ℃;载气流速为1.0 mL·min-1;进样方式为不分流进样。
质谱条件:离子源温度为230 ℃,四级杆温度为150 ℃,质谱为EI源,全扫40~600 m/z。
1.8 栀子TPS基因家族成员表达模式及与萜类物质相关性检测
对外源激素喷施试验中保存的栀子花朵进行转录组测序,获得不同外源激素浓度下栀子TPS基因家族成员的表达量,利用TBtools软件绘制表达量热图,分析TPS基因家族成员在不同外源激素浓度下的表达模式;采用模糊数学隶属函数法分析外源激素喷施的最适浓度。根据栀子花朵中萜类物质的含量变化和TPS成员的相对表达量,使用SPSS 27.0 软件进行相关性分析后再用Origin 2022软件绘制相关性热图。
2 结果与分析
2.1 GjTPS基因家族鉴定与蛋白质特征
使用TBtools 软件分别筛选出53 条和66 条基因序列、本地Blast V3 程序得到72 条基因序列;经过手动筛选,最终一共鉴定并获得GjTPS基因家族成员41 个,并依次命名为GjTPS01~GjTPS41(表2)。栀子41 个GjTPS家族成员编码蛋白的理化性质分析结果如表2。GjTPS基因编码氨基酸数量为380~849 个,预测分子量范围为43.93~97.05 kDA。理论等电点为5.09~6.48,全部成员被认为酸性(pI<7)。不稳定指数为37.71~55.68,具有不稳定指数<40 的稳定蛋白7 个及不稳定指数>40 的不稳定蛋白34个。脂肪族指数为82.75~98.06,平均疏水性为-0.466~-0.148,均表现为亲水性。亚细胞定位结果显示栀子GjTPS基因均定位在叶绿体上。
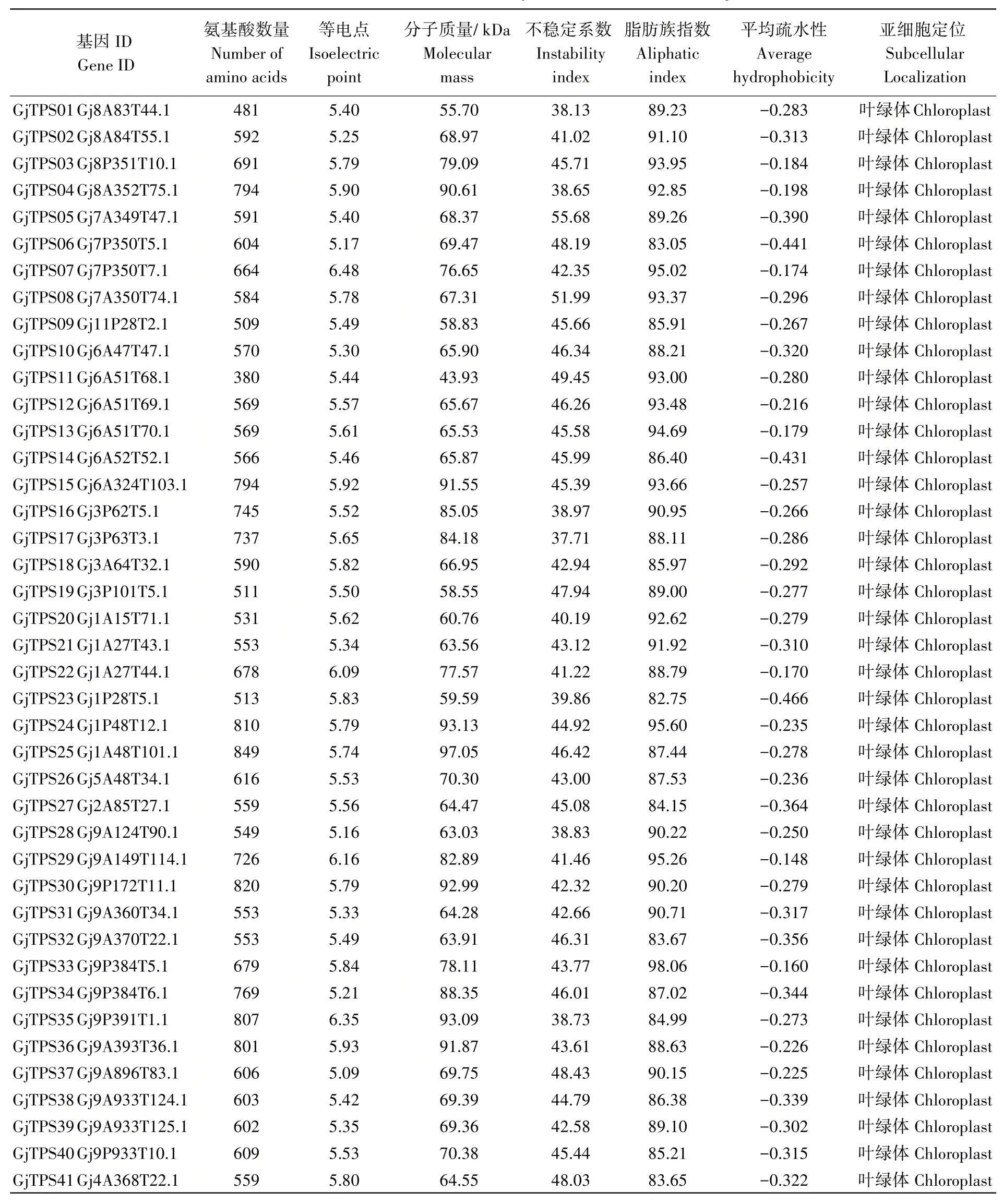
表2 栀子TPS基因家族特征信息Table 2 Characterization of TPS family identified in Gardenia jasminoides
2.2 栀子TPS基因家族保守基序、基因结构、保守结构域分析
TPS基因家族成员基本含有保守的DDXXD、RRX8W 的结构域。保守基序分析表明(图1A),同一亚家族中motif 结构大多相似,GjTPS基因家族蛋白含有基序9~17 个,其中GjTPS07含有基序17 个,GjTPS33、GjTPS34含有基序9 个;最保守的基序为motif1,除了GjTPS16、GjTPS17、GjTPS18不含此基序,其余GjTPS基因亚家族均含有,其基序含DDXXD结构域(图1B);motif8同样是TPS亚家族蛋白常见保守基序,其结构域为RRX8W(图1C),多数TPS亚家族含有此基序,但TPS-c、TPS-e/f 亚家族大多数基因不含motif8。
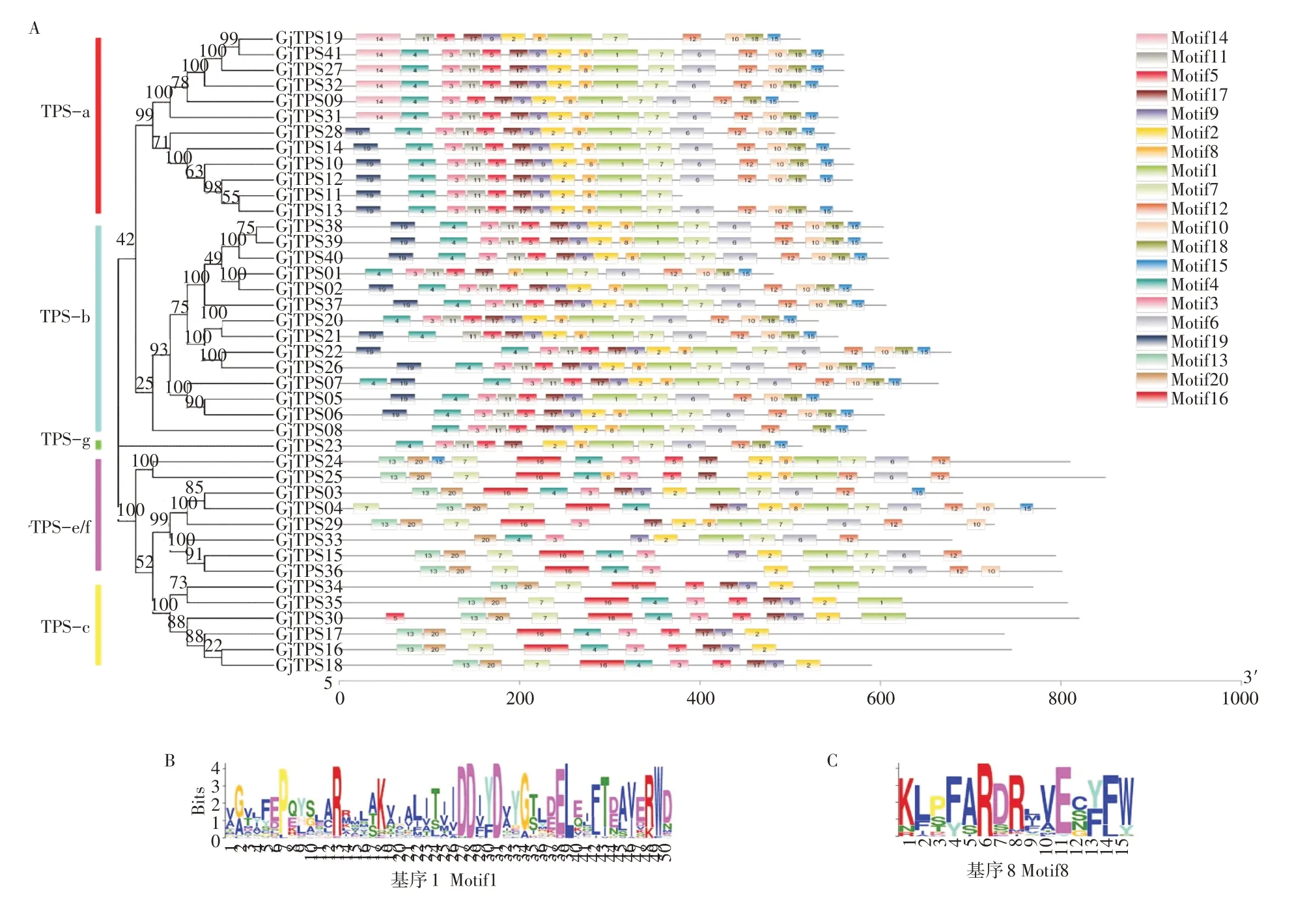
图1 栀子GjTPS基因家族成员保守基序分布Figure 1 Conserved motifs of GjTPS gene family members in G. jasminoides
由图2 可知,GjTPS家族的外显子数量在5~15 之间,内含子仅存在于GjTPS18、GjTPS36中。同一亚家族具有相似的外显子数目及结构。其中TPS-a亚家族含有外显子5~8个,TPS-b有6~10个,TPSc 有11~15 个,TPS-e/f 有12~14 个,TPS-g 有7 个,这与中粒咖啡的报道一致。对栀子TPS 家族的保守结构域进行分析,发现TPS-a 与TPS-b 亚家族为Terpene_cyclase_plant_C1 结构域,其余亚家族均有特定的结构域。
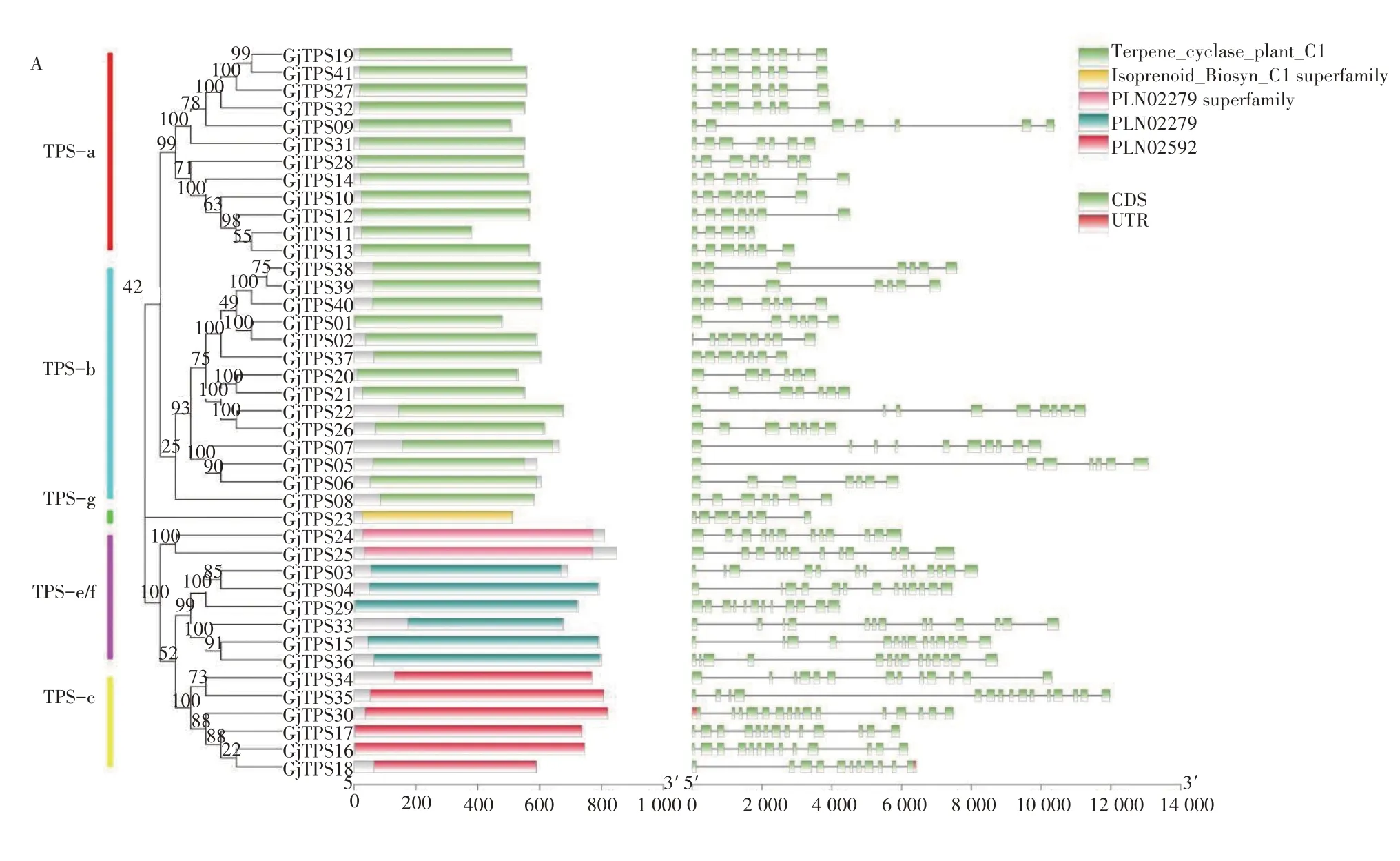
图2 栀子GjTPS基因结构、保守结构域分析Figure 2 Structure analysis of GjTPS gene in G. jasminoides
2.3 系统发育分析
使用栀子(41个)、拟南芥(32个)、葡萄(49个)与中粒咖啡(41个)TPS家族的蛋白序列构建ML 树(图3)。其中拟南芥为草本植物,葡萄为藤本植物,中粒咖啡为小乔木且与栀子同为茜草科植物。依据拟南芥的TPS基因家族分类方法,将栀子、拟南芥、葡萄、中粒咖啡的163 个蛋白序列划分为5 个亚家族。在栀子中,TPS-b 亚家族成员最多,共有14个家族成员;TPS-a亚家族有12个成员,TPS-c亚家族有6个家族成员,TPS-e/f亚家族含有8个成员,而TPS-g亚家族仅有1个成员。与之相似,中粒咖啡中TPS-a、TPS-b 两个亚家族占据29/41的CcTPS 家族成员[23]。从上述保守基序分析中可知,几乎所有栀子TPS 家族成员具有高度保守的富含天冬氨酸的结构域DDXXD;除了TPS-c、TPS-e/f 亚家族几乎不存在RRX8W 结构域,其余家族具有此结构域。其中,DDXXD 在异戊烯基二磷酸底物的金属依赖电离中是重要的,RRX8W在单萜合酶的环化中是必不可少的[16]。
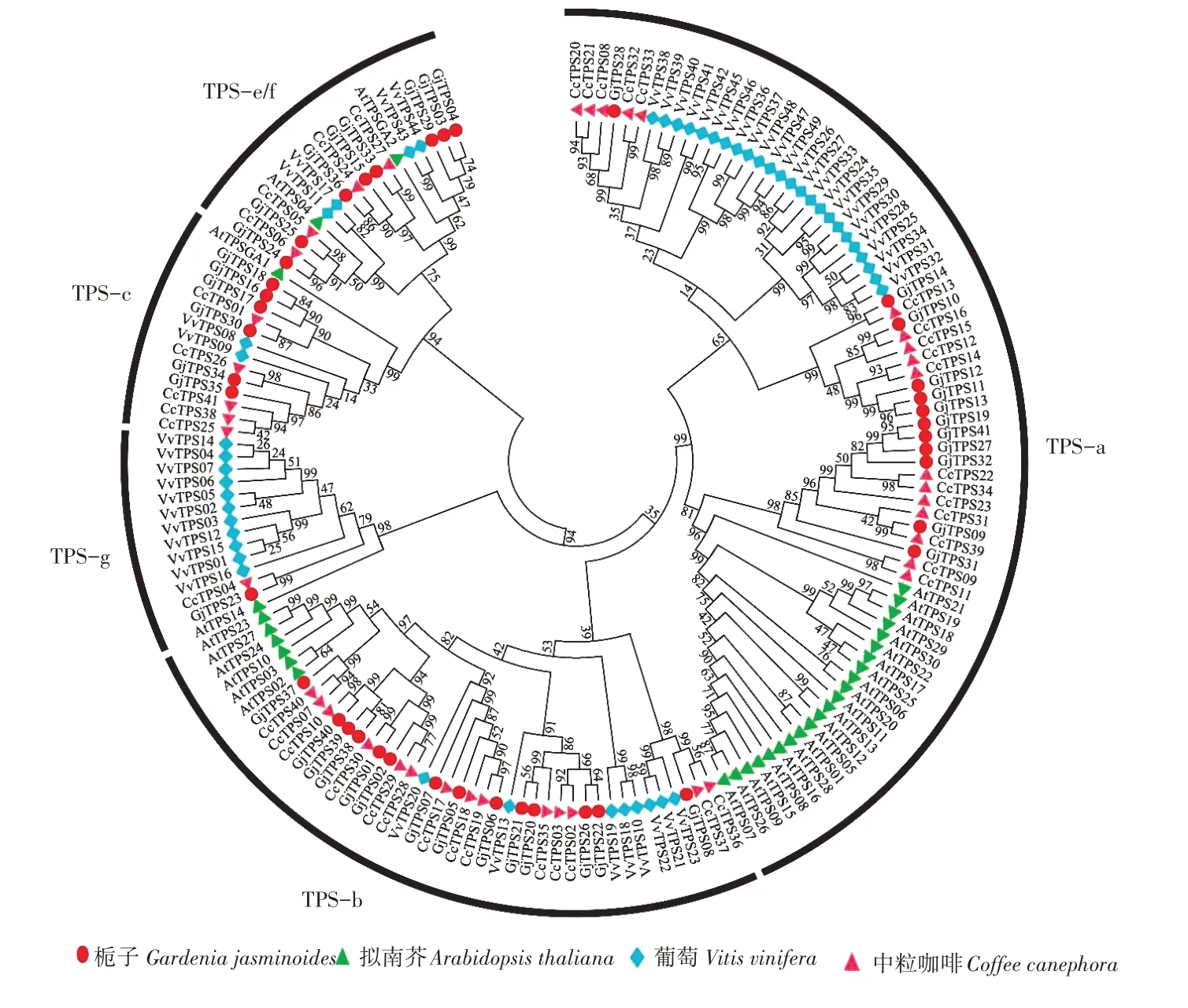
图3 栀子、拟南芥、葡萄、中粒咖啡的系统发育树Figure 3 Phylogenetic tree of TPS in G. jasminoides,A. thaliana, V. vinifera and C. canephora
2.4 染色体定位及进化类型分析
由图4可知,在10条染色体上不均匀地分布着栀子的41个GjTPS基因。栀子GjTPS基因在9号染色体上分布最多,共有13 个。2 号、4 号、5 号、11 号染色体只有1 个GjTPS基因;1 号和6 号染色体有6个GjTPS基因;最短的3 号染色体有4 个GjTPS基因。这表明染色体长短和GjTPS基因的分布没有明显的相关性。根据Tbtools软件Blast得到的基因重复文件,串联重复(36.59%)、近端重复(26.83%)、分散重复(26.83%)、全基因组重复或片段重复(9.76%)是栀子GjTPS基因家族扩张的主要驱动因素。其中串联重复在1号、6号、8号、9号染色体中形成小型基因簇,除标红的几个基因簇外,还有几个与其距离很近的基因,可能是由比较古老的串联重复形成[19]。
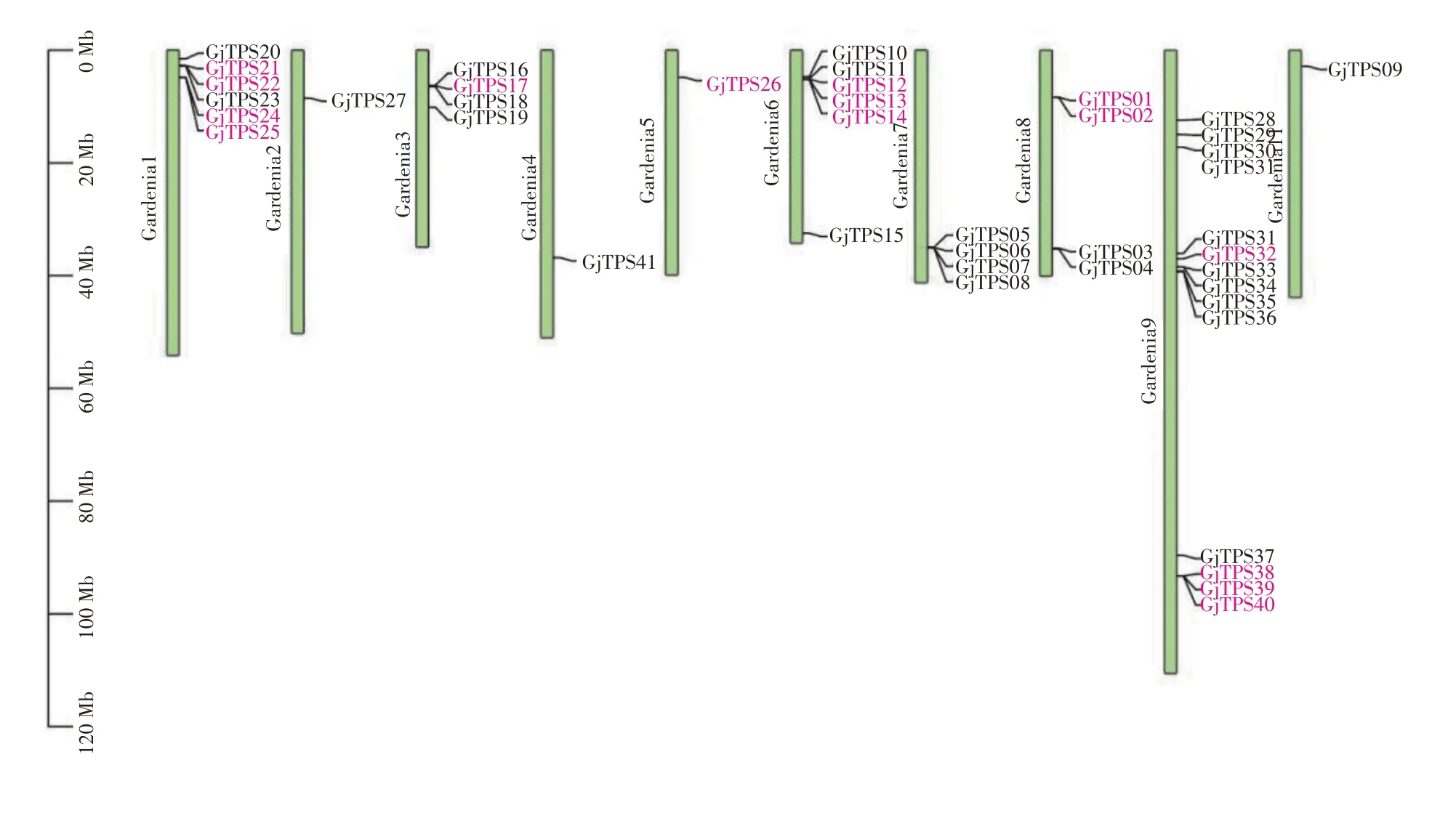
图4 栀子GjTPS基因家族染色体定位分析Figure 4 Chromosome locations of GjTPS gene family members in G. jasminoides
为进一步挖掘栀子TPS基因自身及与其他物种间的进化关系,本研究构建了栀子、拟南芥、中粒咖啡、月季与番茄的共线性分析(图5),分别产生2,4,17,6,5条共线性基因对。其中,栀子有5条染色体与中粒咖啡产生共线性关系,且存在的共线基因对数目将近为其他树种的3 倍及以上。同时,在APGⅣ分类系统中,栀子与中粒咖啡都属于茜草科植物,进一步证明了栀子与中粒咖啡拥有更近的亲缘关系。
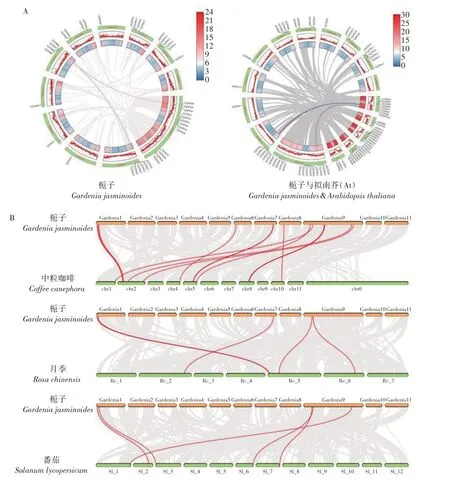
图5 栀子与4种不同物种的共线性分析Figure 5 Collinearity analysis of G. jasminoides and four other species
2.5 启动子顺式作用元件分析
使用PlantCARE网站分析栀子GjTPS基因起始密码子上游2 000 bp的核苷酸序列,鉴定出1 056个与先前报道的植物生长发育、植物激素响应和胁迫相关具有相似性的顺式作用调控元件[18](图6A)。参与植物生长发育的元件(201 个),主要包括开花调控、种子特异性表达、胚乳特异性表达等元件(图6B);植物激素响应元件(493 个),主要有赤霉素、茉莉酸甲酯、生长素等元件(图6C);胁迫响应元件(362 个)包括防御和应激反应、创伤反应、干旱反应等元件(图6D)。其中,大多数的顺式元件在植物激素响应(493/1056)类别中,且MYC 基序(185/493)的占比最大,与茉莉酸甲酯响应相关。综上,栀子GjTPS基因可能受到多种植物激素和非生物胁迫的调节[18],栀子TPS基因家族参与植物生长发育、激素、胁迫响应。
2.6 不同外源激素浓度下栀子TPS基因家族成员的表达模式
由图7 可知,大部分的栀子TPS基因家族成员在不同外源激素浓度下表达量不高,但有6 个成员在不同外源激素浓度作用下出现高表达,这6个基因均为TPS-a与TPS-b亚家族成员。吲哚乙酸低浓度与茉莉酸甲酯高浓度,TPS基因家族成员表达量均出现上调现象;结合表3可见,吲哚乙酸25 mg·L-1与茉莉酸甲酯1.25 mmol·L-1这两个浓度分别为两种外源激素的最适喷施浓度。GjTPS02、GjTPS12、GjTPS14、GjTPS20、GjTPS21、GjTPS22在各个处理中均高度表达,推测这些TPS基因可能与栀子花香有关。
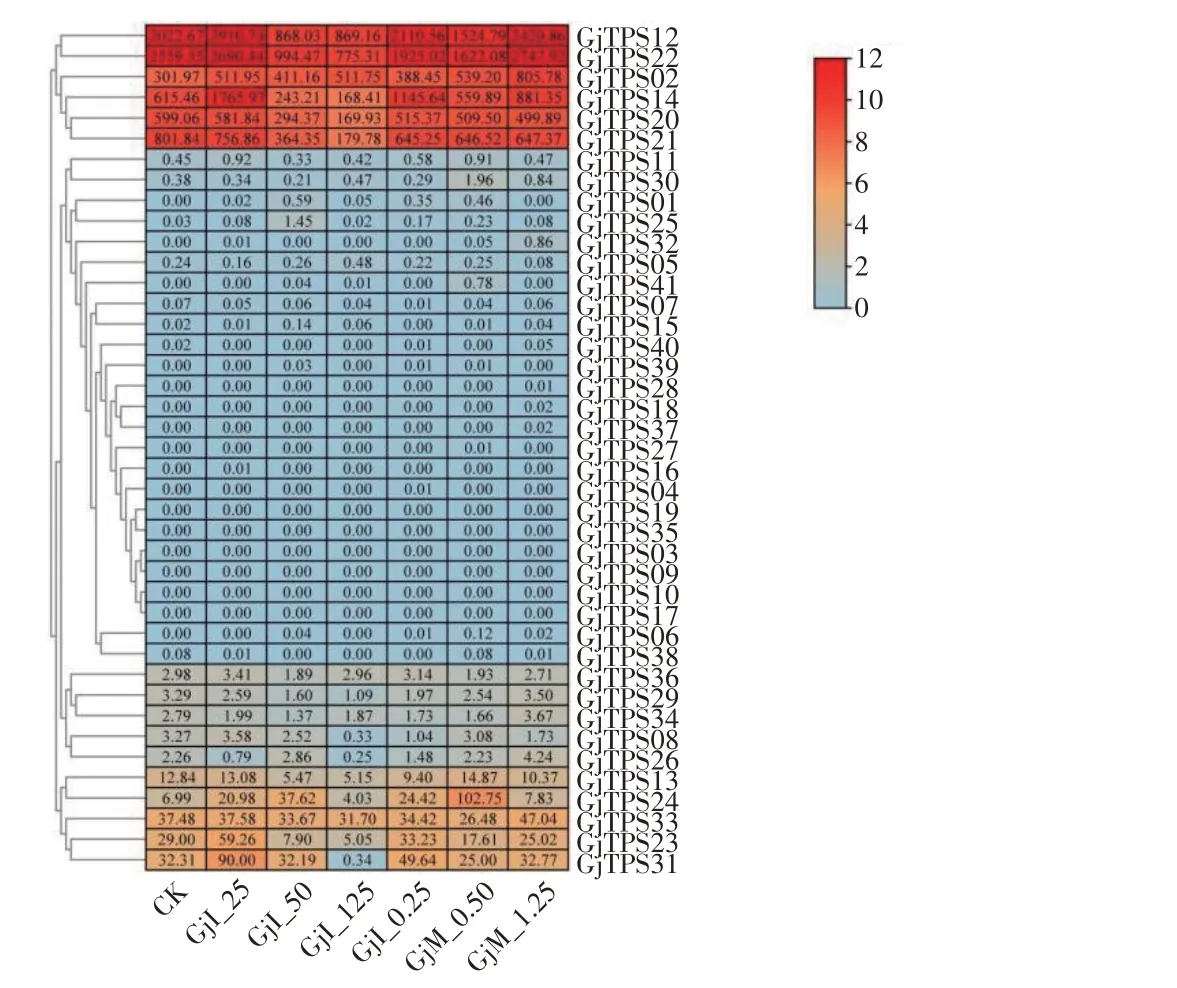
图7 栀子TPS基因在不同外源激素浓度下的表达情况Figure 7 The expression of TPS family genes of G. jasminoides at different concentrations of exogenous hormones

表3 不同外源激素浓度下栀子TPS基因的隶属函数平均值Table 3 Subordinate function values of TPS family genes of G. jasminoides at different concentrations of exogenous hormones
2.7 不同外源激素浓度下栀子花朵萜类物质含量分析
对不同外源激素浓度下栀子花朵挥发性成分进行鉴定分析,分析其中的萜类物质,并绘制热图,使栀子花朵萜类物质的释放结果可视化。根据GC-MS检测出的10种含量最多的萜类物质分析,不同外源激素浓度下栀子花朵的萜类物质释放量不同。由图8可知,在所有浓度下栀子萜类物质释放量中,芳樟醇释放量最高;茉莉酸甲酯0.25 mmol·L-1和1.25 mmol·L-1时芳樟醇、α-松油醇和香叶醇的含量都较高,0.25 mmol·L-1时,未检测出橙花醇。在对照组中只检测出7种含量较大的萜类物质;吲哚乙酸处理中,浓度从低到高分别检测出8,9,10种萜类物质,呈逐渐上升趋势;茉莉酸甲酯处理中,浓度从低到高分别检测出8,10,10种萜类物质。说明茉莉酸甲酯1.25 mmol·L-1是本试验萜类物质释放的最适浓度。
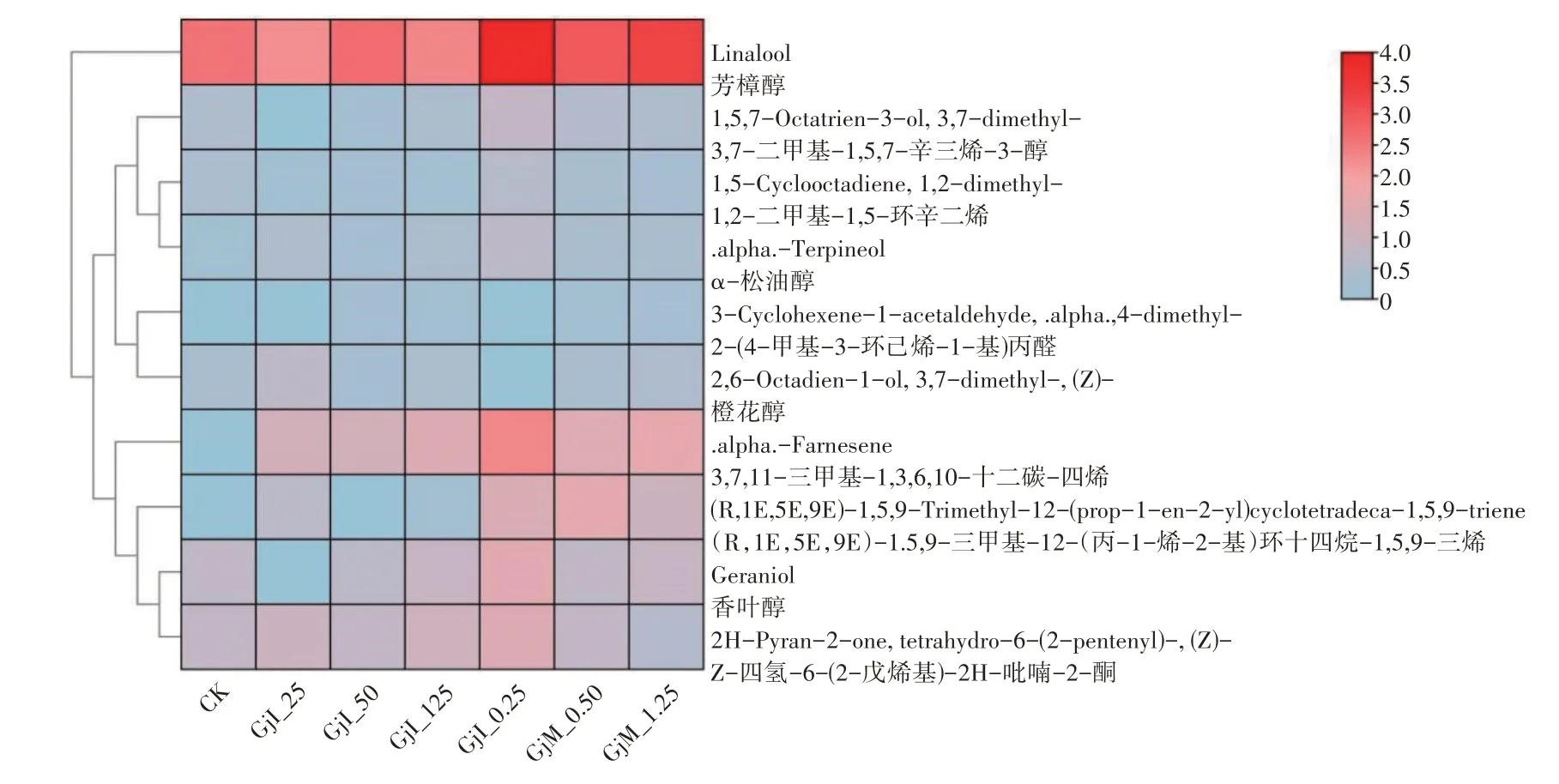
图8 不同外源激素浓度下栀子萜类物质释放Figure 8 The release of terpenoids in the flowers of G.jasminoides at different concentrations of exogenous hormones
2.8 TPS表达量与萜类物质挥发量的相关性分析
栀子花朵TPS表达量与萜类物质挥发量的相关性分析结果表明(图9),GjTPS12、GjTPS14、GjTPS23、GjTPS31、GjTPS36与7 种萜类物质呈正相关;GjTPS20、GjTPS21、GjTPS24与6 种萜类物质呈正相关;GjTPS22与5种萜类物质呈正相关;其余均与小于5种萜类物质呈正相关。其中GjTPS08仅与橙花醇挥发量呈正相关,与其余萜类物质均为负相关;橙花醇仅与GjTPS24呈负相关,其余TPS基因家族成员均为正相关;芳樟醇与GjTPS12、GjTPS14、GjTPS20、GjTPS21、GjTPS22的相关性较大,其余均较小或为负相关;GjTPS23与2-(4-甲基-3-环己烯-1-基)丙醛呈显著性负相关。结合栀子花朵转录组TPS 基因表达情况,最终得到5 个可能参与栀子花香调控的基因,分别为GjTPS12、GjTPS14、GjTPS20、GjTPS21和GjTPS22。
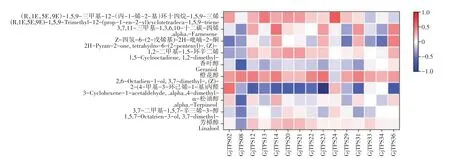
图9 栀子TPS家族成员基因表达与挥发性萜类物质含量相关性Figure 9 Correlation analysis of gene expression and content of volatile terpenoids in TPS family members of G. jasminoides
3 讨论与结论
TPS基因家族是个中等规模的基因家族,其TPS基因数量范围为20~150[15]。例如,江南卷柏有14个SmTPS,山茶有23 个CsTPS,拟南芥有32 个AtTPS,葡萄有69 个VvTPS。根据TPS N 端和C 端结构域,本研究一共鉴定出41个GjTPS基因,分为5个亚家族,不含TPS-d与TPS-h亚家族。TPS-b是栀子最大的亚家族,本结果与铁皮石斛、大花蕙兰的结果一致,但与拟南芥、月季、中粒咖啡的结果不一样。在与拟南芥、中粒咖啡、葡萄的比较分析中,栀子在TPS-b、TPS-c、TPS-e/f 亚家族发生了选择性的扩张,是由近端重复、分散重复与串联重复导致。基因家族的扩张一般与植物的生物学特性相关,如葡萄TPS-a 亚家族的扩张带来巨大的旁系同源簇,使其与来自其他物种的TPS基因关系更密切。拟南芥与葡萄中TPS-b 亚家族是单萜合酶的主要来源,负责催化多种单萜化合物的形成。拟南芥中的AtTPS04被证实是香叶基芳樟醇合酶[27];葡萄TPS-g 亚家族被证实与芳樟醇、香叶醇合成相关,TPS-b亚家族则可促进松油醇的合成[18]。栀子花朵的挥发性萜类物质鉴定中,单萜化合物芳樟醇、α-松油醇、香叶醇、橙花醇占比较大,其中芳樟醇是栀子花朵的主要挥发性成分之一;栀子含有更多的TPSb、TPS-e/f亚家族基因,能够合成更多芳香类化合物。
生长素作为一种不可或缺的植物激素,在植物生长发育的诸多进程中都发挥着重要的作用;柯艳果[28]发现使用吲哚乙酸处理后,姜花挥发性物质释放量均显著升高。茉莉酸甲酯是由硬脂酸途径产生的脂肪酸衍生物,也是茉莉中特殊香味的重要组成成分;姜一凡[29]发现茉莉酸甲酯长期处理(24 h)能显著提高毛果杨叶中萜类物质的释放量。本研究采用吲哚乙酸与茉莉酸甲酯进行喷施试验,发现吲哚乙酸低浓度与茉莉酸甲酯高浓度,TPS基因家族成员表达量均出现上调现象,GjTPS02、GjTPS12、GjTPS14、GjTPS20、GjTPS21、GjTPS22这6 个基因在各处理的表达量较高;1.25 mmol·L-1的茉莉酸甲酯对栀子花朵萜类物质释放影响较大,芳樟醇是栀子花朵的主要挥发性萜类物质。结合转录组和GCMS 分析结果,对栀子TPS基因表达水平和萜类物质含量进行相关性分析,GjTPS12、GjTPS14、GjTPS20、GjTPS21、GjTPS22分别与7,7,6,6,5 种萜类物质呈正相关,这5 个基因可能参与栀子花香代谢的调控。
RRX8W 在异戊烯基二磷酸底物的金属依赖电离中和单萜合酶的环化中是必不可少的[16]。其中,TPS-a 家族的第2 个R 是不保守的[20],在TPS-b 亚家族中是保守的,TPS-c 亚家族不含有RRX8W 结构[13],本研究结果与其保持一致。RRX8W 与单萜合酶质粒转运肽相关,拟南芥的TPS-b亚家族成员中的AtTPS10被表征为月桂烯与罗勒烯合酶[13]。在GjTPS基因的启动子区域观察到很多的顺式作用元件,大多数在植物激素响应类别中,茉莉酸甲酯响应相关的MYC 基序占据大部分的位置。结果表明,栀子GjTPS基因的表达模式可以通过茉莉酸甲酯来调控,并且可以响应多种环境胁迫调控。
萜类合成酶基因形成基因簇有助于基因组合的共遗传和共表达,减少单一通路基因在重组后丢失的可能性[30]。染色体定位显示,1,3,5,6,8,9号染色体都存在串联重复,且8号和9号染色体的基因簇都为TPS-b家族成员,推测这加强了基因的共表达。共线性可以反映物种间的进化关系,远缘物种经历更大程度的基因组重排,使得共线性区域的数量和范围均减少,而近缘物种的基因组间往往蕴藏着丰富的共线性区域[31]。共线性分析表明,栀子与其同科植物中粒咖啡有更近的亲缘关系,两者的共线性基因对高达17 对;栀子GjTPS的基因中也存在2 条基因对,说明栀子这2 条GjTPS基因对有着很强的亲缘关系。
本研究通过对栀子TPS基因家族成员的鉴定及与功能分析,结合外源激素喷施试验进行转录组与挥发性萜类物质含量测定,发现栀子TPS基因在TPS-b亚家族发生了选择性扩张,家族成员达到拟南芥的2.3 倍;1.25 mmol·L-1的茉莉酸甲酯有助于栀子TPS基因家族成员的表达及萜类物质的释放;GjTPS12、GjTPS14、GjTPS20、GjTPS21和GjTPS22这5个基因可能与栀子萜类化合物的合成、释放相关。本研究结果为后续研究栀子TPS家族基因调控花香提供了一定的理论依据,为进一步解析栀子GjTPS基因功能提供了一定的方向。

