外源H2O2对NaCl胁迫下豌豆种子萌发和幼苗抗氧化酶活性的影响
王志科, 关伟龙, 李志伟, 孙于卜
(陇东学院生命科学与技术学院/甘肃省陇东生物资源保护利用与生态修复重点实验室,甘肃 庆阳 745000)
中国盐碱地总面积达9.913×107hm2,主要分布在西北、华北、东北、滨海新区及长江中上游[1]。盐碱化导致植物体代谢受到影响,同时促进毒害物质积累、叶绿体分解、植物光合作用能力下降、有关酶活性降低致使有机物合成速率降低,从而影响植物体的正常发育,造成植株生长纤弱、滞育,阻碍了农业生产的发展[2]。研究结果表明,高盐浓度的土壤会抑制植物种子的萌发[3],因此如何预防土壤盐碱化、科学治理盐碱地以及对已被盐碱侵蚀的土壤进行修复,成为当前国内外研究热点。
利用外源物质刺激植物体产生抗逆性反应来提高植物抵抗外界胁迫是有效路径之一。过氧化氢( Hydrogen peroxide,H2O2)是细胞有氧代谢的产物,也是植物体细胞内应答逆境胁迫的信号分子,广泛参与植物体的抗性反应[4],且对植物体生理作用有双重性(迫害和保护),即低浓度H2O2则会提高植物的抗逆性,而高浓度H2O2会对植物体的生长发育起着抑制作用,甚至会导致植物体的死亡[5]。已有大量研究结果证明H2O2能促进种子萌发:外源H2O2浸种可以明显提高小白菜种子耐盐性[6];过氧化氢浸种预处理通过降低ABA含量和提高GA含量来提高棉花种子萌发的耐盐性[7];外源H2O2浸种能增强皂角种子的萌发率[8];过氧化氢浸种预处理可以明显缓解低温对花生种子的伤害[9]。
豌豆(PisumsativumL.)是一年生或越年生草本植物[10],也是世界上第四大食用豆类作物。中国是蔬菜豌豆主要生产国[11],种植范围遍布全国多个省份,且豌豆是深受人们喜爱的豆类食品之一。在食品功效方面,研究发现豌豆具有抗氧化、降血压、免疫调节等作用[12]。近年,土壤安全问题越来越受到关注,其中土壤盐碱化成为全球热点问题。随着土壤盐碱化程度的增加,豌豆种子萌发和幼苗生长受到抑制,从而导致其产量和品质大幅度下降[13]。因而通过外源物质提高豌豆种子萌发对盐的耐受性[14],缓解盐胁迫对豌豆种子萌发的毒害作用变得非常重要。目前有关外源H2O2在豌豆抗盐方面的研究报道很少。因此,本试验研究外源H2O2对豌豆种子萌发和幼苗生长盐胁迫的缓解机制,确定适宜的外源H2O2浓度,旨在为农业生产中使用外源物质提高作物抗盐碱能力提供实践指导和理论依据。
1 材料与方法
1.1 材料与试剂
试验所用豌豆种子,由甘肃省陇东生物资源保护利用与生态修复重点实验室提供。氯化钠和30%过氧化氢等药品均为分析纯。
1.2 试验设计与方法
1.2.1 NaCl浓度的筛选 NaCl溶液浓度设定参考达海兰[15]的方法,模拟盐胁迫。选择大小均一品质良好的豌豆种子,用10 ml含量0.5%的NaClO溶液消毒15 min,然后用自来水冲洗3次,用滤纸吸干种子表面的水分,将种子播于铺有双层滤纸的培养皿中,每只培养皿播50粒种子。分别取10 ml不同浓度(17 mmol/L、34 mmol/L、68 mmol/L、85 mmol/L、102 mmol/L、136 mmol/L、170 mmol/L)的NaCl 溶液加入培养皿中,以蒸馏水为对照,共8个处理,每个处理重复3次,操作重复3次。将所有处理放于(25±1) ℃恒温培养箱中培养。每日观察和统计发芽数,补充相应的溶液,7 d后对其相关指数进行计算。
1.2.2 外源H2O2浸种处理 由不同浓度NaCl溶液对豌豆种子的处理结果可知,170mmol/L浓度NaCl溶液胁迫效果最佳。选择大小均一、品质良好的豌豆种子,用10 ml含量0.5%的NaClO溶液消毒15 min,然后用自来水冲洗3次,用滤纸吸干种子表面的水分,分别用170 mmol/L浓度NaCl溶液及5 mmol/L、10 mmol/L、20 mmol/L、40 mmol/L、80 mmol/L浓度H2O2溶液将豌豆种子浸种8 h,同时以蒸馏水浸种为对照浸种相同时间。之后用蒸馏水冲洗3次,用虑纸吸干种子表面残留的水分,将种子分别放入铺有双层滤纸的培养皿中,每只培养皿放50粒种子,分别加入等量170 mmol/L浓度NaCl溶液。以蒸馏水为对照,共7个处理组,每组至少重复3次,操作重复3次。处理分别为CK:蒸馏水;CG:170 mmol/L NaCl溶液;T1:5 mmol/L H2O2溶液+170 mmol/L NaCl溶液;T2:10 mmol/L H2O2溶液+170 mmol/L NaCl溶液;T3:20 mmol/L H2O2溶液+170 mmol/L NaCl溶液;T4:40 mmol/L H2O2溶液+170 mmol/L NaCl溶液;T5:80 mmol/L H2O2溶液+170 mmol/L NaCl溶液。
将所有处理放于(25±1)℃恒温培养箱培养。每日观察并统计发芽数,补充相应的溶液,7 d后对其相关指数进行计算。此外,7 d后取豌豆根和芽用于相关生理指标测定。
1.3 相关指数测定及方法
1.3.1 种子萌发期指标的测定 以根长大于2 mm作为豌豆种子发芽标准,种子的发芽率、发芽势、发芽指数和活力指数、抗盐性指数和根相对盐迫害率计算参考李志萍等[16]的方法。
发芽率=(N7/N)×100%
式中,N7为第7 d的发芽个数,N为所供试豌豆种子数。
发芽势=(N3/N)×100%
式中,N3为第3 d发芽个数,N为所供试豌豆种子数。
发芽指数(Gi)=∑Gt/Dt
式中,Gt为在时间t日的发芽数,Dt为发芽天数。
活力指数=S×Gi
式中,S为幼苗平均根长,Gi为发芽指数。
抗盐性指数=(S×Gi)*/(S×Gi)×100%
式中,(S×Gi)*为CG、T1~T5处理活力指数,(S×Gi)为CK活力指数。
相对盐迫害率=(L-L*)/L×100%
式中,L*为CG、T1~T5处理根长,L为CK根长。
1.3.2 各项生理指标的测定 种子的发芽试验结束后,每组随机挑取15株豌豆苗,用直尺和棉线测定幼苗的芽长和根长,计算平均长度(cm);用千分之一天平称量芽鲜质量和根鲜质量,计算平均值(g)。
1.3.3 脯氨酸、可溶性糖和丙二醛含量的测定 脯氨酸、可溶性糖和丙二醛含量的测定参照李志萍等[16]的方法。
1.3.4 抗氧化酶活性的测定 待测液的提取:用称量纸称取0.1 g待测品,放入研钵中,加入预冷的适量50 mmol/L磷酸缓冲溶液(含有5.0 mmol/L DTT、0.1mmol/L EDTA、1% PVP,pH=7.0)研磨充分,迅速转移到离心管中,10 000g离心15 min。去除离心管中沉淀即为所需酶液。
超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢(CAT)测定参照李志萍等[16]的方法。
1.4 数据处理
利用Microsoft Excel 2016 进行数据处理,利用 SPSS 26.0进行单因素方差分析,利用Duncan’s法进行多重比较及差异显著性分析(α=0.05)。表中数据为平均值±标准差。
2 结果与分析
2.1 不同浓度NaCl溶液对豌豆种子萌发的影响
由表1可知,与CK相比,17 mmol/L、34 mmol/L、68 mmol/L、85 mmol/L、102 mmol/L、136 mmol/L、170 mmol/L浓度NaCl溶液处理豌豆种子的发芽率分别降低14.74%、18.59%、21.72%、24.05%、24.81%、27.79%及48.82%;发芽势分别降低了14.14%、21.69%、50.03%、53.67%、56.99%、64.60%及75.52%; 根长分别降低了5.35%、11.29%、11.68%、14.06%、16.63%、29.90%及47.13%;发芽指数分别降低了15.80%、17.32%、20.34%、21.94%、26.23%、39.08%及56.41%;活力指数分别降低了20.30%、26.66%、29.65%、31.99%、38.51%、57.30%及76.95%。与CK相比,170 mmol/L浓度NaCl溶液处理显著抑制了豌豆种子的发芽率、发芽势、根长、发芽指数及活力指数(P<0.05),其对发芽率、根长、发芽指数的抑制程度为50.0%左右,因此选择170 mmol/L浓度NaCl溶液作为豌豆盐胁迫的最佳浓度。

表1 不同浓度NaCl溶液对豌豆种子萌发的影响
2.2 外源H2O2对NaCl胁迫下豌豆种子萌发的影响
由表2可知,与CK相比,CG处理显著抑制了豌豆种子的发芽率、发芽势、发芽指数、活力指数(P<0.05), 发芽率、发芽势、发芽指数、活力指数分别降低了48.84%、75.48%、56.41%、76.95%。与CG处理相比,T1~T4处理豌豆种子的发芽率和发芽势显著提高(P<0.05)。与CG处理相比,T1处理豌豆种子的发芽率、发芽势、发芽指数和活力指数分别提高了105.13%、833.70%、201.38%和683.32%。随着H2O2浓度的增大,T1~T5处理豌豆种子的萌发各项指标呈现先升高后降低的趋势。结果表明,外源5 mmol/L H2O2处理(T1)能有效缓解盐对豌豆种子萌发的抑制,并存在浓度效应,表现为在盐胁迫下,低浓度H2O2促进豌豆种子萌发。

表2 外源H2O2对NaCl胁迫下豌豆种子发芽率、发芽势、发芽指数和活力指数的影响
2.3 外源H2O2对NaCl胁迫下豌豆幼苗生长的影响
由表3可知,与CK相比,CG处理豌豆幼苗的根长和芽长显著降低(P<0.05),根长和芽长分别降低了47.13%、34.18%。随着H2O2浓度的增加,T1~T5处理豌豆幼苗的根长呈现先增加后降低的趋势。其中T1处理缓解豌豆盐胁迫效果最佳,与CG处理相比,T1处理豌豆幼苗根长显著增加159.93%(P<0.05)。T1~T5处理豌豆幼苗的芽长呈现先增加后降低的趋势。其中T1处理缓解豌豆盐胁迫效果最好,与CG处理相比, T1处理豌豆幼苗芽长显著增加150.00%。

表3 外源H2O2对NaCl胁迫下豌豆幼苗根长、芽长、根鲜质量及芽鲜质量的影响
由表3可知,与CK相比,CG处理豌豆幼苗的根鲜质量和芽鲜质量显著降低(P<0.05),且根、芽鲜质量分别降低了22.68%、12.97%。随着H2O2浓度的增加,T1~T5处理豌豆幼苗的根鲜质量呈现先增加后降低的趋势。其中T1处理缓解盐胁迫的效果最好,与CG处理相比,T1处理豌豆幼苗的根鲜质量显著增加87.52%(P<0.05)。而T5处理豌豆幼苗的根鲜质量低于CG处理。T1~T5处理豌豆幼苗的芽鲜质量呈现先增加后降低的趋势。与CG处理相比,T1、T2、T3处理豌豆幼苗的芽鲜质量分别显著增加了109.67%、97.75%、93.65% (P<0.05)。其中T1处理豌豆幼苗的芽鲜质量最高,而T5处理豌豆幼苗的芽鲜质量低于CG处理。表明外源H2O2缓解盐胁迫存在浓度效应,表现为低浓度H2O2促进豌豆幼苗生长。
2.4 外源H2O2对NaCl胁迫下豌豆种子萌发抗盐性指数和相对盐迫害率的影响
抗盐性指数是指种子萌发对不同浓度NaCl溶液的耐受能力。种子萌发后幼苗根长受盐胁迫的程度,称为根长相对盐迫害率。从表4可看出,CG处理豌豆种子萌发的抗盐性指数为CK的23.05% (P<0.05)。随着H2O2浓度的增加,T1~T5处理豌豆种子萌发抗盐性指数不断降低(P<0.05),且T1~T3处理豌豆种子萌发抗盐性指数高于CG处理,其中T1处理豌豆种子萌发抗盐性指数最高,比CG处理显著提高了683.30%(P<0.05)。T5处理抗盐性指数最小,为17.90%。随着H2O2浓度的增加,T1~T5处理相对盐迫害率呈上升趋势,其中T3~T5处理相对盐迫害率高于CG处理,T1处理相对盐迫害率最低,为-37.43%,表明低浓度外源过氧化氢不仅能缓解盐胁迫对豌豆根造成的损伤,还能促进根的生长,这与表3的结果相一致。

表4 外源H2O2处理对NaCl胁迫下豌豆种子萌发抗盐性指数和相对盐迫害率的影响
2.5 外源H2O2对NaCl胁迫下豌豆幼苗渗透调节物质和丙二醛含量的影响
脯氨酸和可溶性糖是重要的渗透调节物质,其含量的高低直接影响植物体的抗逆性[9]。由表5可知,T1~T4处理豌豆幼苗根和芽中脯氨酸和可溶性糖含量均高于CG处理,其中T1处理豌豆幼苗根和芽中脯氨酸含量和可溶性糖含量最高。相较于CG处理,T1处理豌豆幼苗根和芽中脯氨酸含量分别提高了40.00%、70.27%,可溶性糖含量分别提高了21.03%、11.53%。
丙二醛是膜脂过氧化的主要产物,其含量的高低可反映植物过氧化损伤的程度。由表5可知,与CK相比,CG处理的豌豆幼苗根和芽中丙二醛含量显著升高(P<0.05),T1处理豌豆幼苗的根和芽中丙二醛含量显著低于CG处理,说明低浓度H2O2处理可明显缓解NaCl胁迫对豌豆组织的损伤,随着H2O2浓度的不断升高,作用缓慢削弱。各个处理相比较,T1处理根和芽中丙二醛含量最低。

表5 外源H2O2对NaCl胁迫下豌豆幼苗根和芽中脯氨酸、可溶性糖及丙二醛含量的影响
2.6 外源H2O2对NaCl胁迫下豌豆幼苗抗氧化酶活性的影响
由表6可知,与CK相比,CG处理显著抑制了豌豆幼苗芽中CAT活性(P<0.05),T1处理豌豆幼苗根和芽中CAT的活性最高。与CG相比,T1、T2处理豌豆幼苗根和芽中CAT的活性显著提高(P<0.05)。但高浓度的H2O2处理CAT活性降低。
由表6可知,与CK相比,CG处理豌豆幼苗根和芽中的SOD、POD活性均显著提高(P<0.05)。T1处理豌豆幼苗根和芽中的SOD、POD活性最高,与CG处理相比分别提高了45.53%、28.07%,21.06%、28.48%(P<0.05)。随着H2O2浓度的升高,豌豆幼苗根和芽中的SOD、POD活性均先升高后降低,但都高于CK。
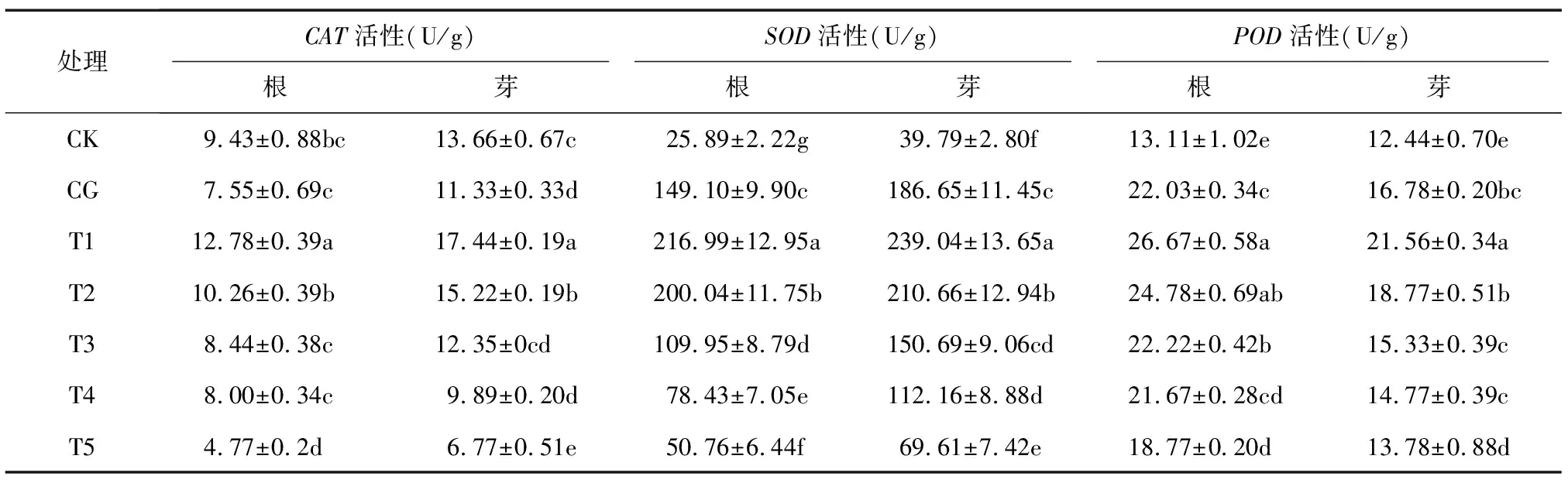
表6 外源H2O2对NaCl胁迫下豌豆根和芽中CAT、SOD和POD活性的影响
3 讨 论
土壤盐渍化是全球农业生产过程中影响作物产量的因素之一,会导致植物体对养分的难以吸收、土壤板结造成植物体无法生长发育[17]。盐胁迫会直接影响种子的发芽和幼苗生长,进而会影响其后期的产量[18]。本研究结果表明,不同浓度NaCl溶液处理,豌豆种子的萌发均受到抑制。170 mmol/L浓度NaCl溶液处理显著抑制了豌豆种子的发芽率、发芽势、发芽指数、活力指数和幼苗的生长。这与NaCl处理对甜高粱[18]、小白菜[19]和油菜[20]种子萌发的影响一致。
H2O2是一种重要的抗逆信号分子[21],参与种子萌发、各种胁迫响应、植物生长发育和细胞程序性死亡等生理过程[22]。本研究结果表明,5 mmol/L浓度H2O2能够显著缓解NaCl胁迫对豌豆种子的萌发和幼苗生长的抑制,并存在浓度效应,表现为低浓度促进。这与外源H2O2浸种能缓解NaCl胁迫对燕麦[23]、小白菜[19]和小麦[24]幼苗生长的抑制结果相一致。
非生物胁迫使活性氧的产生和清除机制失衡,造成自由基产生过多,膜脂氧化严重,最终对植物种子的萌发和幼苗生长造成伤害[25]。本研究发现,与CK相比,170 mmol/L浓度NaCl溶液处理(CG)显著抑制了豌豆幼苗中CAT的活性,提高了SOD和POD活性,这表明豌豆幼苗启动抗氧化酶系统来抵抗更多活性氧的产生。H2O2可以激活非生物胁迫下,植物细胞内抗氧化酶系统来抵抗更多活性氧对机体造成的伤害[21]。已有研究结果表明,在盐胁迫下,外源H2O2提高了苦菜幼苗中SOD、POD、CAT和APX酶的活性及可溶性蛋白质、可溶性糖和脯氨酸含量,降低了细胞内H2O2和丙二醛含量[26]。外源H2O2增强了盐胁迫下小白菜幼苗中SOD、CAT和APX的活性,降低丙二醛含量,以此来抵抗盐胁迫带来的氧化损伤[19]。本研究结果与前人的研究结果一致,表明H2O2是参与豌豆抗氧化酶系统的重要信号分子。
植物在遭受非生物胁迫时,会发生渗透胁迫[27]。脯氨酸[28-32]和可溶性糖[33-35]是重要的细胞渗透调节物质,参与多种非生物胁迫[36]。已有研究结果表明,在遭受碱胁迫后,水稻通过可溶性糖含量的变化,调节脯氨酸含量,来提高自身的抗逆性[37]。盐胁迫下,桑树叶片中的脯氨酸大量积累[38]。低温下,塔胞藻胞内的脯氨酸和可溶性糖含量增加[39]。NADPH氧化酶介导的H2O2通过调节脯氨酸的生物合成和降解来减轻盐胁迫诱导的氧化损伤[40]。由NADPH氧化酶产生的过氧化氢增加了拟南芥在盐或甘露醇胁迫过程中脯氨酸的积累[41]。本研究发现,与CG相比,外源5 mmol/L H2O2浸种能提高盐胁迫下豌豆幼苗中脯氨酸和可溶性糖含量,增强了细胞的渗透调节能力,提高了豌豆幼苗的抗盐能力。
4 结 论
综上所述,与CG相比,外源5 mmol/L H2O2能够显著提高豌豆幼苗中SOD、CAT和POD的活性,降低丙二醛含量,促进渗透调节物质的积累,减轻盐胁迫造成的氧化损伤,因此显著提高了豌豆种子萌发的耐盐性,促进其幼苗生长。

