不同水稻品种OsVDAC8的表达模式比较与亚细胞定位分析
蒋晓涵 覃永华 刘学群 李开 王春台


摘要 [目的]研究OsVDAC8的理化性質和表达模式,为探究OsVDAC8的功能提供基础。[方法]用生物信息学分析OsVDAC8的结构特征及表达谱,然后通过定量PCR对3个不同水稻品种日本晴(NIP)、粤泰A(YTA)、粤泰B(YTB)不同发育时期的不同组织中OsVDAC8的表达模式进行分析,并通过BiFC对亚细胞定位进行验证。[结果]OsVDAC8编码区全长1 014 bp,编码337 aa,生物信息学分析结果显示,OsVDAC8是具有1个结构域的稳定的定位于线粒体的亲水蛋白,通过11次跨膜形成特异的桶状结构。在ATG上游含有13个与水稻生长发育及胁迫应答相关的顺式作用元件。RiceXPro和 MSU Rice Genome Annotation Project水稻基因表达数据库分析结果表明,NIP中OsVDAC8在生殖生长期的茎和花序出现前后幼穗中表达水平最高,在胚乳和根中的表达量较低。对NIP、YTA、YTB 3个水稻品种中OsVDAC8的表达谱分析结果显示,OsVDAC8在3个水稻品种四叶期的叶鞘表达水平都非常高,在花粉内容物充实期都很低,但幼穗发育的不同时期3个品种中表达水平差异很大,NIP中幼穗发育的整个时期表达量比较稳定,YTB中表达量较低,而在YTA幼穗发育的中后期表达水平逐渐下降。亚细胞定位结果显示,OsVDAC8定位于线粒体,与预测结果一致。[结论]OsVDAC8在3个水稻品种中表达模式不同,YTB中整个幼穗发育过程中表达量较低,YTA幼穗发育的中后期表达水平逐渐下降,而NIP中幼穗发育的整个时期表达量都比较稳定。OsVDAC8定位于线粒体。
关键词 水稻;OsVDAC8;表达模式;亚细胞定位
中图分类号 S511 文献标识码 A
文章编号 0517-6611(2024)04-0081-06
doi:10.3969/j.issn.0517-6611.2024.04.017
开放科学(资源服务)标识码(OSID):
Comparison of Expression Patterns in Different Rice Varieties and Subcellular Localization Analysis of OsVDAC8
JIANG Xiao.han,QIN Yong.hua,LIU Xue.qun et al
(Hubei Provincial Key Laboratory for Protection and Application of Special Plants in Wuling Area of China,Key Lab for Biotechnology of State Ethnic Affairs Commission,College of Life Science,South.Central University for Nationalities,Wuhan,Hubei 430074)
Abstract [Objective]To study the physical and chemical properties and expression patterns of OsVDAC8 for providing a basis for further investigation of the function of OsVDAC8.[Method]The structural characteristics and expression profile of OsVDAC8 were analyzed by bioinformatics.The expression patterns of OsVDAC8 in different tissues of three rice varieties,Nipponbare (NIP),Yuetai A (YTA) and Yuetai B (YTB) at different developmental stages were analyzed by quantitative PCR,and the subcellular localization was verified through BiFC.[Result]There were 1 014 bp and encodes 337 aa in the OsVDAC8 coding region.The results of bioinformatics analysis showed that OsVDAC8 is a stable hydrophilic protein with one domain localized to mitochondria,and forms a specific barrel.like structure through 11 transmembrane.There are 13 cis.acting elements related to rice growth and development and stress response in the upstream of ATG.Analysis via rice XPro and MSU Rice Genome Annotation Project rice gene expression database showed that OsVDAC8 was expressed in the stem and panicle before and after the appearance of inflorescences during the reproductive growth period,and the expression was low in the endosperm and root in NIP.The expression profile analysis of OsVDAC8 in three rice varieties NIP,YTA and YTB showed that the leaf sheath expression level of OsVDAC8 was very high in the four.leaf stage of the three rice varieties and very low in the pollen content enrichment stage,but very different in the three rice varieties at different stages of young panicle development.In NIP,the expression level was relatively stable during the whole stage of young panicle development,while in YTB,the expression level was low,and in YTA,the expression level decreased gradually during the middle and late stage of young panicle development.The subcellular localization results showed that OsVDAC8 was localized to mitochondria,which was consistent with the prediction results.[Conclution]The expression patterns of OsVDAC8 were different in different rice varieties.OsVDAC8 was localized to mitochondria.
Key words Rice;OsVDAC8;Expression pattern;Subcellular localization
基金项目 国家自然科学基金项目(31170226 )。
作者简介 蒋晓涵(1999—),女,湖北荆门人,硕士研究生,研究方向:分子遗传学。*通信作者,教授,博士,硕士生导师,从事分子遗传学研究。
收稿日期 2023-03-19
电压依赖性阴离子通道 (VDAC)是定位于线粒体外膜的主要转运蛋白,最初从酵母中分离出来,存在于从真菌到动物和植物的所有生物体中[1]。哺乳动物和昆虫 VDAC是一个由19条反向平行反向链组成的桶状结构,其中N端螺旋折叠到孔中[2]。所有生物体的VDAC具有相似的基本电生理特性(电导、选择性和电压依赖性)[3]。线粒体和细胞质之间的无机离子和代谢物的交换对于许多线粒体功能是必不可少的。多种转运蛋白(离子通道、载体和ABC转运蛋白)介导通过线粒体内膜(MIM)的选择性转运[4]。相比之下, VDAC是线粒体外膜(MOM)中多种化合物的主要转运途径,如无机离子(如K+、Na+和Cl-)、代谢物(如ATP和AMP)和大分子(如tRNA)等[5]。VDAC的開放状态对多价阴离子代谢物(如ATP)具有阴离子选择性和渗透性。而VDAC的关闭状态使通道有阳离子选择性。然而,通道仍然具有足够的电导性,可以传输小离子[6]。VDAC的开放/关闭对机体的细胞器代谢具有重要的调节作用。除了调节代谢物转运的功能外,VDACs还参与了细胞的程序性死亡[7]。
植物VDAC不仅参与植物发育过程,还参与环境应激反应[8]。拟南芥 AtVDAC2和AtVDAC4中的T-DNA插入敲除突变导致成熟叶片的生长严重迟缓。除atvdac3外,所有敲除突变体的花粉粒数、花粉发芽率和发芽花粉管长度均显著降低[9]。AtVDAC1 能调节拟南芥对农杆菌感染的能力[10],AtVDAC2参与盐胁迫反应途径[11]。小麦TaVDAC1 的过表达(OE)增强了转基因拟南芥对盐胁迫的耐受性并降低了对干旱的抗性[12]。AtVDAC3 和硫氧还蛋白m2(AtTrx m2)之间存在相互作用均调节ROS的积累,且 AtVDAC3 的过表达增加了H2O2的积累,而AtTrx m2的过表达减少了NaCl处理中H2O2的积累[13]。因此,植物VDACs在调节植物生长及应对压力方面发挥关键作用[14]。
通过水稻全基因组扫描鉴定出了8个OsVDAC 基因[15],并利用生物信息学网站分析了OsVDAC1-8基因精细结构[16]。OsVDAC3在生殖生长期的茎、花序出现前后幼穗及雄蕊成熟花粉中表达水平最高,OsVDAC3的表达可能与雄性的育性相关[17]。OsVDAC5在水稻各个部位不同时期均有高表达[18], OsVDAC6可能与水稻耐盐和耐旱有关[19];osvdac4纯合突变体幼苗对ABA胁迫具有更好的抗性[20]。OsVDAC家族中OsVDAC8鲜见报道。笔者通过生物信息学方法分析其表达谱、预测其顺式作用元件,并以3个水稻品种(日本晴、红莲型不育系粤泰A和保持系粤泰B)不同发育时期幼穗以及四叶期幼苗根、鞘和叶为材料,对OsVDAC8基因表达模式进行分析,旨在为研究OsVDAC8的功能提供参考。
1 材料与方法
1.1 材料
水稻品种日本晴(NIP)、红莲型不育系粤泰 A(YTA)及保持系粤泰 B(YTB)种子,HBT-GFP质粒、DH5α菌株均来源于中南民族大学生物技术国家民委重点实验室。
1.2 生物信息学分析
1.2.1 OsVDAC8蛋白的理化性质。使用线上工具ExPASy-Protparam(https://web.expasy.org /protparam/)进行理化性质分析,Protscale线上软件(https://web.expasy.org/protscale/)进行亲水性、疏水性分析,CDD软件(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行蛋白保守功能区分析,SOPMA(https://npsa.prabi.ibcp.fr/cgi.bin/npsa_automat.pl?page=npsa_sopma.html)进行蛋白二级结构分析,Swissmodel(https://www.expasy.org/resources/swiss-model)进行蛋白三级结构预测,Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)行蛋白亚细胞定位分析。
1.2.2 顺式作用元件预测。
在 NCBI数据库下载 OsVDAC8(Chr3 LOC_Os03g20750)起始ATG前5 000 bp的DNA序列,利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线分析预测顺式作用元件。
1.2.3 表达模式分析预测。
从水稻 4-44K基因表达芯片RAPDB中提取NIP OsVDAC8(Chr3 LOC_Os03g20750)在不同生长发育阶段不同组织中的表达谱(RiceXPro,http://ricexpro.dna.affrc.go.jp/)[21],通过Hierarchical cluster分析[22]使用MeV (MultiExperiment Viewer)表示基因的表达模式。在MSU Rice Genome Annotation Project水稻基因表达数据库中 (http://rice.plantbiology.msu.edu/expression.shtml)下载基因的表达数据,用omega作图软件绘图分析基因的表达模式。
1.3 不同水稻品种表达模式分析
1.3.1 RNA提取与反转录。
水稻种子按常规方法萌发及种植。分别取NIP、YTA和YTB四叶期根、叶鞘和叶, 5个不同发育时期的幼穗[23](穗生长期 I:小穗长度小于0.4 cm;穗生长期 Ⅱ:小穗长度0.5~1.0 cm;穗生长期Ⅲ:小穗长度1.5~4.0 cm;穗生长期 IV:小穗长度5.0~<10.0 cm;穗生长期V:小穗长度大于10.0 cm),加液氮磨碎成粉末状,用TriZOL法提取总RNA并反转。利用CorYeabio公司反转试剂盒反转得到cDNA(体系:All-in-One First-Strand Synthesis MasterMix 4 μL,dsDNase 1 μL,Total RNA 3 μg,加Nuclease-Free Water up to 20 μL),将反应体系放置于 PCR仪,50 ℃,15 min;85 ℃,5 s;处理完后立即置于冰上。将cDNA原液稀释5倍,混匀,吸取1 μL作为模板,用actin引物检测cDNA质量(15 μL体系:ddH2O 5.7 μL, Fast Mix 1.5 μL,引物各 0.4 μL,cDNA 1.3 μL),PCR反应程序:96 ℃预变性4 min,96 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,34個循环,72 ℃延伸6 min。反应结束后,取6 μL产物进行电泳检测。引物序列见表1。
1.3.2 荧光定量PCR。
用水稻actin为内参基因 ,每个样品3个重复,15 μL反应体系:水4.7 μL,2× qPCR SYBR Green Master Mix 7.5 μL,引物各0.4 μL,cDNA 2.0 μL。反应程序:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s;0 ℃保存。根据仪器生成的数据计算该基因在 3种水稻材料不同组织中的表达量。
1.4 OsVDAC8的亚细胞定位
1.4.1 HBT-GFP-OsVDAC8载体构建。
以NIP cDNA为模板,用设计好的HBT-VDAC8-F和HBT-VDAC8-R进行扩增,PCR体系同cDNA检测,反应程序:97 ℃预变性5 min,97 ℃变性30 s,68 ℃退火30 s,72 ℃延伸1 min,35个循环,72 ℃延伸8 min。用Axygen切胶回收试剂盒回收后得到目的片段,用BamHI酶切HBT-GFP载体和目的片段,将酶切产物进行回收,用CorYeabio公司同源重组试剂盒重组后再转化至DH5α感受态细胞中,涂布含有氨苄青霉素(100 μg/mL)的LB固体培养基,并挑取饱满的单克隆,扩大培养后提取质粒DNA进行PCR及酶切鉴定,将阳性克隆测序。
1.4.2 水稻原生质体的转化和亚细胞定位分析。
通过聚乙二醇介导法将质粒导入水稻原生质体。使用暗培养 10~13 d NIP的黄化苗浸泡于0.6 mol/L Mannitol 溶液中,在培养皿中用新刀片将黄化苗快速切割成2 mm左右的小片段,静置8 min 后过滤,加入酶解液(10 mL 酶解液含 7.5 mL 0.8 mol/L Mannitol,1.0 mL 0.1 mol/L MES,0.150 g Cellulose 和0.075 g Macerozyme),置于28 ℃摇床50 r/min振荡酶解6 h,加入 10 mL W5(50 mL W5 溶液含 5.00 mL 1.54 mol/L NaCl,6.25 mL 1 mol/L CaCl2,1.25 mL 0.2 mol/L KCl 和 1.00 mL 0.1 mol/L MES,加入 ddH2O 定容至 50 mL)后放置10 min,用W5溶液将裁剪好的6层纱布润湿,通过纱布将酶解液过滤到新的洁净离心管中,1 000 r/min加减速度均为1,室温离心5 min,弃上清。加入1 mL W5溶液轻摇重悬原生质体,冰上静置30 min,取20 μL悬液镜检观察原生质体质量。1 000 r/min加减速度均为1,离心5 min,弃上清,加入预冷的400 μL MMG溶液(10.0 mL MMG 溶液含7.5 mL 0.8 mol/L Mannitol,0.3 mL 0.5 mol/L MgCl2和 0.4 mL 0.1 mol/L MES,加ddH2O 至 10 mL),重悬原生质体后置于冰上。将质粒加入2 mL EP管底,吸取200 μL原生质体悬液加入离心管中,将质粒和原生质体混匀,加入等体积的PEG-CaCl2溶液(1 mL PEG-CaCl2 含 0.55 mL 0.8 mol/L Mannitol,0.4 g PEG 4 000,置于55 ℃孵育3 h,加入 100 μL CaCl2 和50 μL ddH2O),混匀后避光静置20 min进行转化。加入4倍体积W5溶液,轻摇混匀以停止转化,1 000 r/min加减速度均为1,离心5 min。弃上清,加入3倍体积的W5溶液清洗原生质体去除残留的PEG-CaCl2,1 000 r/min加减速度均为1,室温离心5 min。重复该步骤1次。弃上清,加入500 μL W1溶液重悬原生质体,25 ℃避光过夜培养,制片及染色处理后置于CLSM下观察荧光情况。
2 结果与分析
2.1 OsVDAC8蛋白生物信息学分析
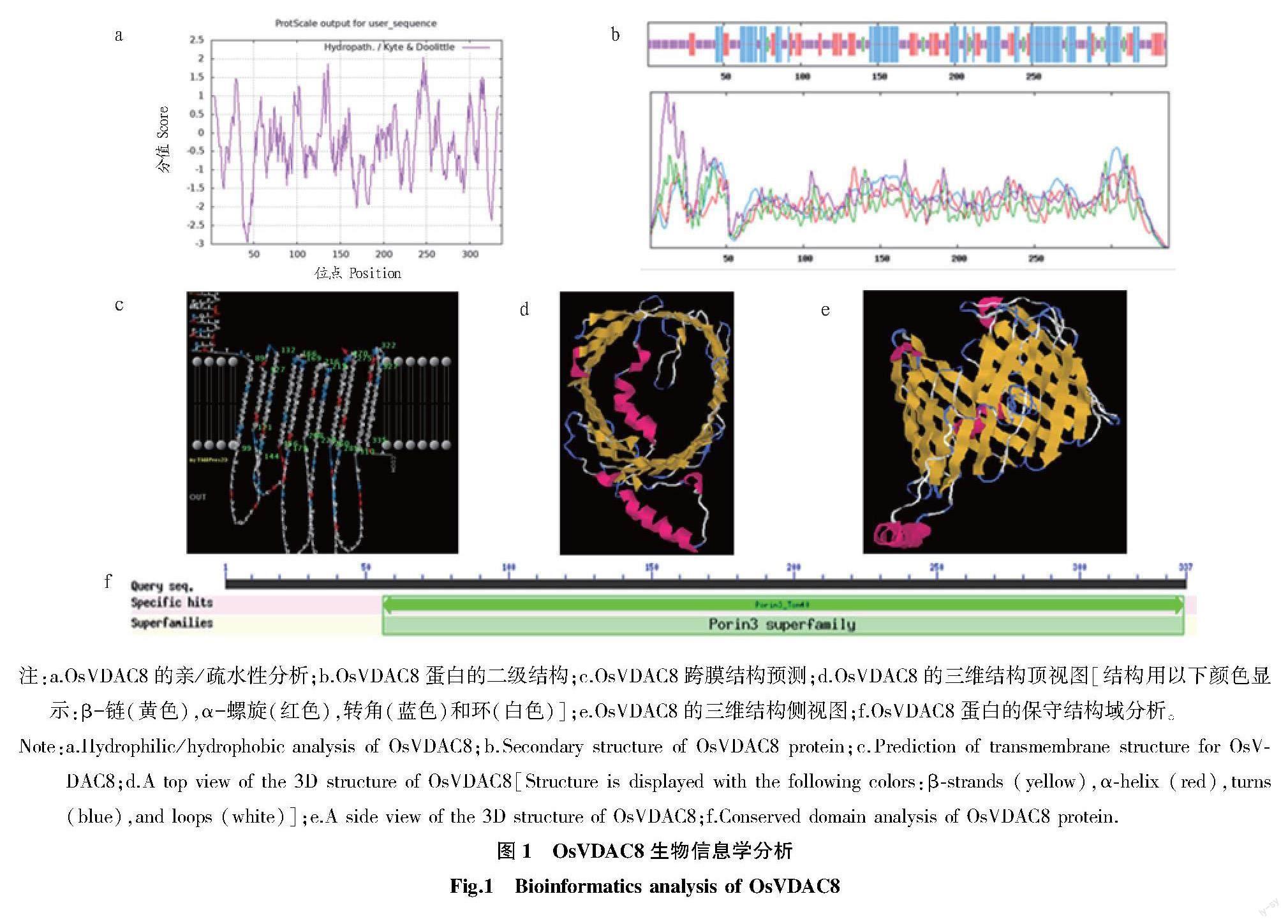
ExPASy-Protparam线上软件的分析结果表明,OsVDAC8是1个由337 aa构成,分子式为C1617H2577N443O497S16,相对分子量为37 337.47,理论等电点为6.46的蛋白质(图1)。该蛋白的不稳定指数为36.40,表现出稳定性,其脂肪系数为72.64,总平均亲水系数为-0.316。用Protscale线上网站对OsVDAC8蛋白的亲水性进行预测,结果显示,信号图中峰值散布于负值的信号明显大于正值部分(图1a),OsVDAC8蛋白是一个稳定的具有亲水性的蛋白。SOPMA结果表明,OsVDAC8蛋白的空间构象可能主要由无规则卷曲结构构成(图1b)。Swissmodel结果显示,OsVDAC8蛋白含有1个Porin3_Tom40结构域,11次跨膜(图1c),且折叠形成特异的桶状结构(图1d和图1e)。CDD结果表明,该蛋白属于Porin3超家族(图1f)。Cell-PLoc2.0结果显示其定位于线粒体。
2.2 顺式作用元件预测
用PlantCARE (http:∥bioinformatics.psb.ugent.be/webtools/plantcare/html/) 对OsVDAC8 起始ATG前5 000 bp的序列进行生物信息学分析,发现了13种可信度较高的顺式作用元件(表2)。该启动子含有多种与植物发育相关顺式作用元件,推测这个基因在水稻的生长发育过程中可能具有重要作用。基因含有与发育相关的顺式作用元件为ABRE、ARE、CAT-box、CGTCA-motif、P-box、LTR、MBS、TC-rich repeats、GATA-motif、TCA-element、TGA-element等。
2.3 表达谱的生物信息学分析
利用RiceXpro(http:∥ricexpro.dna.affrc.go.jp/GGEP/sample.list.php)分析了OsVDAC8在水稻品种NIP中48个发育阶段的表达谱。该基因平均信号值对数的层次聚类结果(图2)表明,其在不同生长发育阶段表达差异显著,OsVDAC8在所有组织和时期都表达,在胚乳中表达水平最低,OsVDAC8在花序出现前后及子房中表达量较高。
2.4 OsVDAC8在3个水稻品种中表达模式比较
分别取NIP、不育系 YTA和保持系 YTB四叶期根、叶鞘和叶片, 5个不同发育时期幼穗,用 TriZOL法提取总 RNA,反转后的cDNA用actin引物检测,结果显示,cDNA不含基因组DNA,且能扩增出特异条带(图3)。图4显示,OsVDAC8在这3个水稻品种的表达模式差异显著,不育系YTA中OsVDAC8在四叶期叶、叶鞘和幼穗发育的前期表达水平都较高,根及幼穗发育花粉内容物充实期表达水平最低;保持系YTB中在四叶期叶鞘表达水平非常高,根、叶及幼穗发育过程中都是低水平表达; NIP的四叶期叶鞘和枝梗原基分化期中都有非常高的表达,其他时期的表达差异不大,幼穗发育的整个时期表达量都比较稳定。
2.5 OsVDAC8的亚细胞定位分析
用BamHI酶切HBT-GFP质粒DNA并回收,通过同源重组技术将OsVDAC8全长CDS整合到HBT-GFP线性化载体上转化大肠杆菌,涂布含有氨苄青霉素(100 μg/mL)的LB 固体培养基,挑取单克隆扩大培养后提取质粒 DNA,进行 PCR 及酶切鉴定,将阳性克隆测序(图 5),结果显示,HBT-OsVDAC8-GFP 载体构建成功。HBT-OsVDAC8-GFP 转化水稻黄化幼苗原生质体,培养 10 h 后用线粒体染料染色 15 min,制片后在激光共聚焦显微镜下观察荧光分布,结果显示,OsVDAC8 定位于线粒体(图 6)。
3 讨论与结论
拟南芥中有4个VDAC基因,AtVDAC1、AtVDAC2和AtVDAC4在植物生长、叶片和花粉发育及维持线粒体膜电位的稳定状态方面发挥了重要作用。多项证据表明,线粒体深度参与雄性配子体发育,许多线粒体基因突变影响雄性配子体发育,甚至导致细胞质雄性不育。AtVDAC1突变影响雌配子发育。AtVDAC1普遍存在于拟南芥的根、茎、叶、花序、角果、幼苗和种子中,且表达水平都很高[24]。笔者前期研究了OsVDAC4和OsVDAC6的表达谱,发现OsVDAC6在幼穗早期发育时期,Nip 与YTB 中OsVDAC6維持较低的表达,而YTA 中OsVDAC6表达水平出现高峰,OsVDAC4在Nip、YTB和YTA中均在花粉粒充实成熟期时OsVDAC4表达量达到最高,推测其可能参与调控水稻花粉粒的成熟过程。OsVDACs在调控水稻育性中的作用尚不清楚,有待深入研究其作用机理。
为了研究OsVDAC8的功能,首先对其进行了生物信息学分析,OsVDAC8是一个稳定的亲水蛋白,二级结构主要由
无规则卷曲构成,可能定位在线粒体上;预测的启动子序列含有与植物生长发育、繁殖及胁迫应答等密切相关的元件,推测其在水稻生长发育的不同时期及组织的表达模式可能有差异。RiceXpro结果表明,OsVDAC8在NIP不同生长发育阶段表达差异显著,在生殖生长期的叶鞘、花序出现前后幼穗中表达水平最高,在胚乳和根中的表达量较低。
分析了OsVDAC8在3个不同品种 NIP、YTA和 YTB幼穗发育的不同时期和组织中的表达,结果表明,在3个水稻品种中表达模式不同。在NIP中OsVDAC8在根中的表达量最低,在叶鞘到枝梗分化期的表达量较高,在雌雄蕊开始分化到花粉充实完熟期的表达量差别不大;OsVDAC8在YTB与NIP的幼穗发育时期的表达模式大同小异,而在YTA中随着雌雄蕊的形成和颖花的发育OsVDAC8的表达量逐渐降低,YTB和NIP都是雄性可育品种,而YTA是细胞质雄性不育品种,这些结果可能说明OsVDAC8的表达可能与水稻的育性有关联。亚细胞定位结果显示,OsVDAC8定位于线粒体,与预测结果一致。该研究初步分析了OsVDAC8的特性,为深入研究OsVDAC8基因的功能提供基础。
参考文献
[1]LI Z Y,XU Z S,HE G Y,et al.The voltage.dependent anion channel 1 (AtVDAC1) negatively regulates plant cold responses during germination and seedling development in Arabidopsis and interacts with calcium sensor CBL1[J].Int J Mol Sci,2013,14(1):701-713.
[2]ZINGHIRINO F,PAPPALARDO X G,MESSINA A,et al.VDAC genes expression and regulation in mammals[J].Front Physiol,2021,12:1-14.
[3]NAJBAUER E E,BECKER S,GILLER K,et al.Structure,gating and interactions of the voltage.dependent anion channel[J].Eur Biophys J,2021,50(2):159-172.
[4]ASHRAF M,MAO Q L,HONG J,et al.HSP70.16 and VDAC3 jointly inhibit seed germination under cold stress in Arabidopsis[J].Plant Cell Environ,2021,44(11):3616-3627.
[5]SRIVASTAVA S R,MAHALAKSHMI R.Evolutionary selection of a 19-stranded mitochondrial β.barrel scaffold bears structural and functional significance[J].J Biol Chem,2020,295(43):14653-14665.
[6]TAKAHASHI Y,TATEDA C.The functions of voltage.dependent anion channels in plants[J].Apoptosis,2013,18(8):917-924.
[7]RAVI B,KANWAR P,SANYAL S K,et al.VDACs:An outlook on biochemical regulation and function in animal and plant systems[J].Front Physiol,2021,12:1-15.
[8]KARACHITOS A,GRABIN′SKI W,BARANEK M,et al.Redox.sensitive VDAC:A possible function as an environmental stress sensor revealed by bioinformatic analysis[J].Front Physiol,2021,12:1-10.
[9]HEMONO M,UBRIG ,AZEREDO K,et al.Arabidopsis voltage.dependent anion channels (VDACs):Overlapping and specific functions in mitochondria[J].Cells,2020,9(4):1-14.
[10]KWON T.Mitochondrial porin isoform AtVDAC1 regulates the competence of Arabidopsis thaliana to Agrobacterium.mediated genetic transformation[J].Mol Cells,2016,39(9):705-713.
[11]LIU Z,LUO Q H,WEN G Q,et al.VDAC2 involvement in the stress response pathway in Arabidopsis thaliana[J].Genet Mol Res,2015,14(4):15511-15519.
[12]YU M,YU Y,SONG T Q,et al.Characterization of the voltage-dependent anion channel (VDAC) gene family in wheat (Triticum aestivum L.) and its potential mechanism in response to drought and salinity stresses[J].Gene,2022,809:1-11.
[13]KANWAR P,SAMTANI H,SANYAL S K,et al.VDAC and its interacting partners in plant and animal systems:An overview[J].Crit Rev Biotechnol,2020,40(5):715-732.
[14]KANWAR P,SANYAL S K,MAHIWAL S,et al.CIPK9 targets VDAC3 and modulates oxidative stress responses in Arabidopsis[J].Plant J,2022,109(1):241-260.
[15]夏春皎,劉学群,王春台.水稻线粒体渗透性转换孔相关基因家族的系统发育研究[C]//湖北省植物生理学会第十五次学术研讨会论文集.黄冈:湖北省植物生理学会,黄冈师范学院,2007:60.
[16]罗凤燕.水稻 vdac、ant及 HL-SP1 基因的表达研究[D].武汉:中南民族大学,2010.
[17]王亚楠.水稻OsVDAC3及其互作蛋白亚细胞定位和功能初步分析[D].武汉:中南民族大学,2019.
[18]XU X,TAN Y P,CHENG G,et al.Genomic survey and gene expression analysis of the VDAC gene family in rice[J].Genet Mol Res,2015,14(4):15683-15696.
[19]龚秋涵.水稻OsVDAC6功能及调控机制的初步研究[D].武汉:中南民族大学,2020.
[20]马明月.水稻OsVDAC4与其互作蛋白功能的初步研究[D].武汉:中南民族大学,2022.
[21]SATO Y,TAKEHISA H,KAMATSUKI K,et al.RiceXPro version 3.0:Expanding the informatics resource for rice transcriptome[J].Nucleic Acids Res,2013,41:D1206-D1213.
[22]EISEN M B,SPELLMAN P T,BROWN P O,et al.Cluster analysis and display of genome.wide expression patterns[J].Proc Natl Acad Sci USA,1998,95(25):4863-14868.
[23]广东省德庆县永丰中学农科组.利用倒五叶观察水稻幼穗分化[J].农业科技通讯,1977(7):6.
[24]潘晓迪.拟南芥电压依赖性阴离子通道基因AtVDACs功能分析[D].北京:中国农业大学,2014.

