植物14-3-3蛋白结构与功能的研究进展
孙熔谦, 晋欢欢, 张 静, 王 琴, 张 莉
(1.福建农林大学生命科学学院;2.福建农林大学基础林学与蛋白质组学研究中心,福建 福州 350002)
14-3-3蛋白在1967年首次被Moore和Perez分离获得,是一种酸性可溶蛋白,分子质量为 25~32 ku[1]。14-3-3蛋白广泛存在于真核生物中,动物14-3-3蛋白通常有7个亚型,包括τ、ε、β、γ、σ、η和ζ,植物14-3-3蛋白的亚型更多[2]。例如,拟南芥(Arabidopsisthaliana)中有13个亚型[3],番茄(Solanumlycopersicum)中有12个亚型[4],烟草(Nicotianatabacum)中有17个亚型[5],香蕉(MusaacuminataL.)中有25个亚型[6]。
虽然不同物种中14-3-3蛋白种类数目不同,但前人根据14-3-3蛋白保守核心区域差异进行系统发育分析,将14-3-3蛋白家族分为两大类:ε类群和非ε类群[7]。非ε类群成员基因结构中包含高度保守的4个外显子和3个内含子,ε类群成员基因的N端还含有两个额外的内含子。已有研究表明这两个类群14-3-3蛋白与同种靶蛋白的结合区域存在差异,导致它们与同种靶蛋白的亲和能力也存在差异[8]。拟南芥中的14-3-3蛋白具有两种命名法:第1种被称为一般调节因子(general regulatory factor, GRF),以阿拉伯序号表示,如GRF3;第2种以希腊字母表示,如14-3-3λ[2]。目前这两种命名法均在使用。拟南芥14-3-3蛋白家族中的ε亚型包括GRF9~13,非ε亚型包括GRF1~8[7]。拟南芥14-3-3蛋白家族的分类如图1所示。

图1 拟南芥14-3-3蛋白家族的分类Fig.1 Classification of Arabidopsis 14-3-3 protein family
1 14-3-3蛋白结构
14-3-3蛋白在不同物种中高度保守,整体上可分为3个区域(图2A):可变N端(NTD)、保守核心区(core domain)和可变C端(CTD)。不同14-3-3蛋白的N端和C端高度可变,其N端参与14-3-3蛋白二聚体的形成,C端参与与靶蛋白的相互作用。不同物种14-3-3蛋白的结构类似,以同源或异源二聚体的形式存在,形成的杯状二聚体具有两个极性沟槽(图2B),14-3-3蛋白与靶蛋白互作的关键氨基酸残基通常位于极性沟槽内[9]。14-3-3蛋白通常与磷酸化的靶蛋白相互作用,目前已知与14-3-3蛋白结合的靶蛋白磷酸化基序有3类:基序Ⅰ为R(S/X)XpSXP;基序Ⅱ为RXXXpSXP;基序Ⅲ为pS/pTX1-2-COOH。其中,p代表磷酸化的氨基酸残基,X代表任意的氨基酸残基[10]。基序Ⅰ和Ⅱ是14-3-3蛋白的主要结合基序,基序Ⅲ与14-3-3蛋白的亲和力较弱[11]。
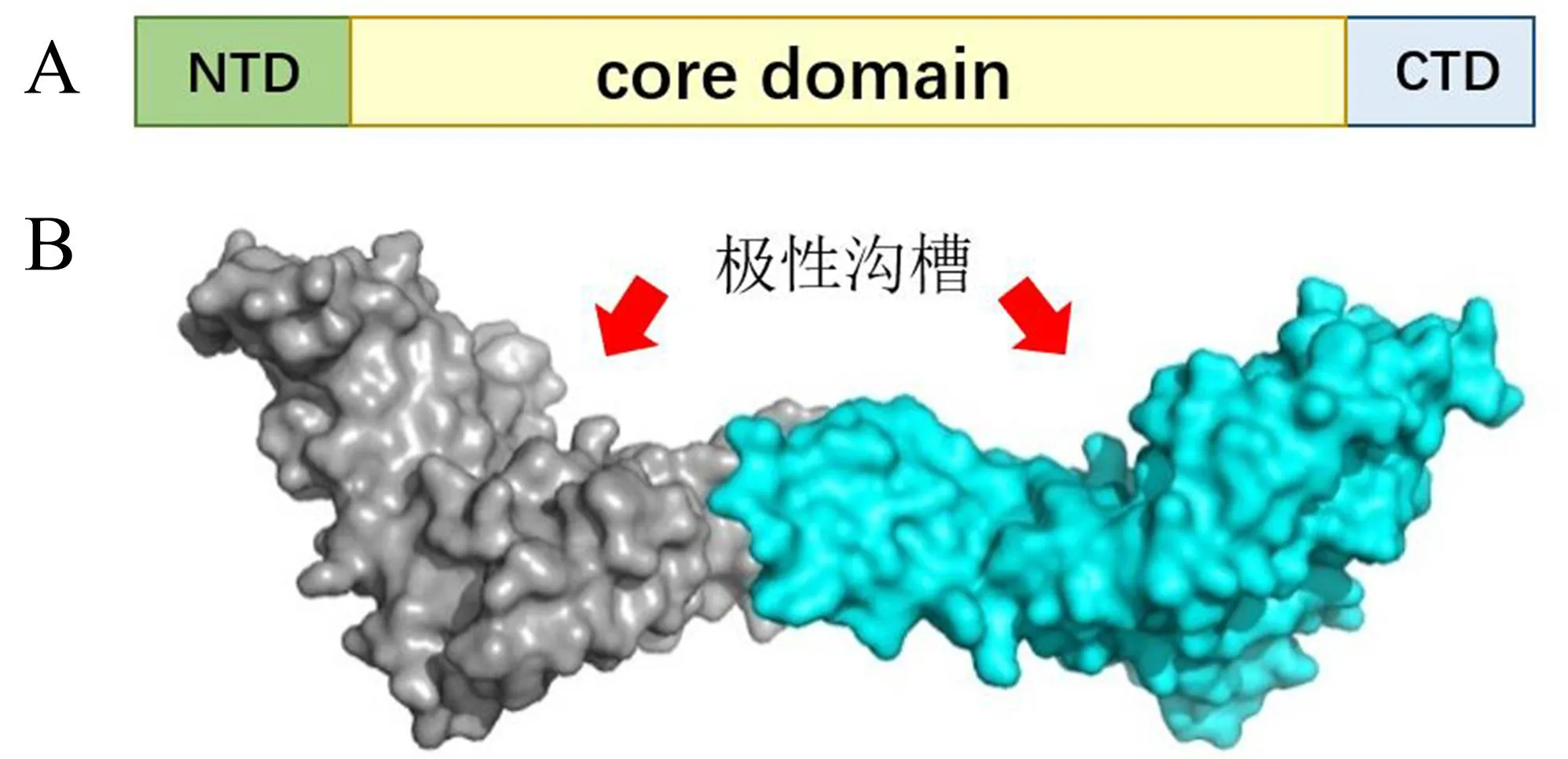
修改自微小隐孢子虫14-3-3蛋白结构[12]。A:14-3-3蛋白结构域(NTD:可变N端;core domain:保守核心区;CTD:可变C端); B:14-3-3蛋白二聚体结构模型(红色箭头 指示14-3-3蛋白的极性沟槽)。
2 植物14-3-3蛋白家族的功能
14-3-3蛋白主要通过与靶蛋白的相互作用,改变靶蛋白的折叠、定位来发挥功能。目前已报道的与植物14-3-3蛋白互作的靶蛋白超过300个[13],互作机制如表1所示。
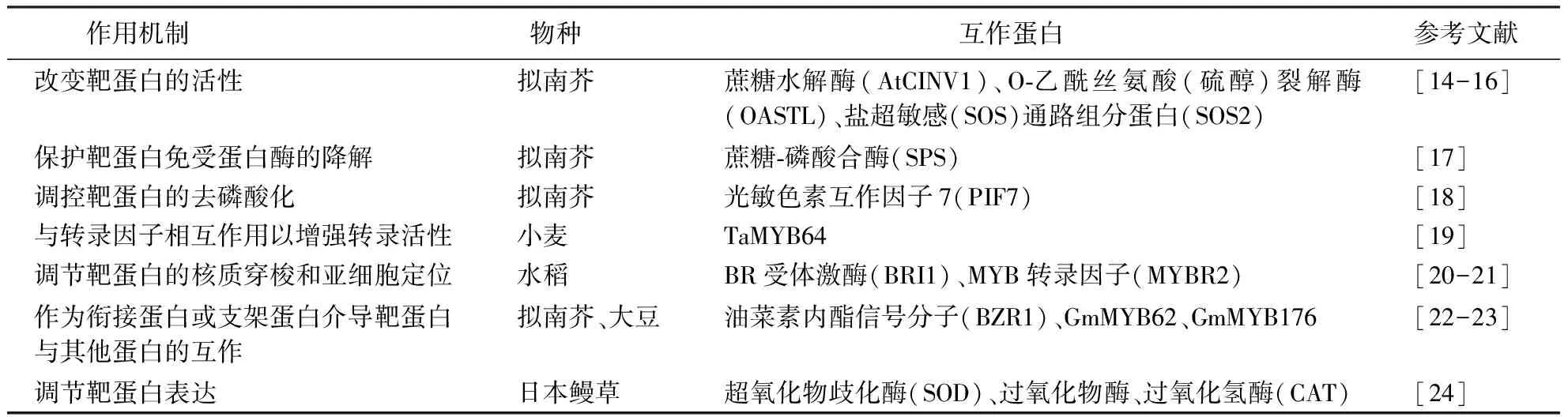
表1 植物14-3-3蛋白家族的作用机制Table 1 Regulatory mechanism of 14-3-3 protein family in plants
2.1 14-3-3蛋白参与调节植物生长发育
14-3-3蛋白主要分布于细胞质中,在细胞核、高尔基体、叶绿体和线粒体中也有分布,参与调节植物诸多生长发育过程[25],如植物开花、根伸长、气孔开放、下胚轴伸长、植物器官发育等(图3)。
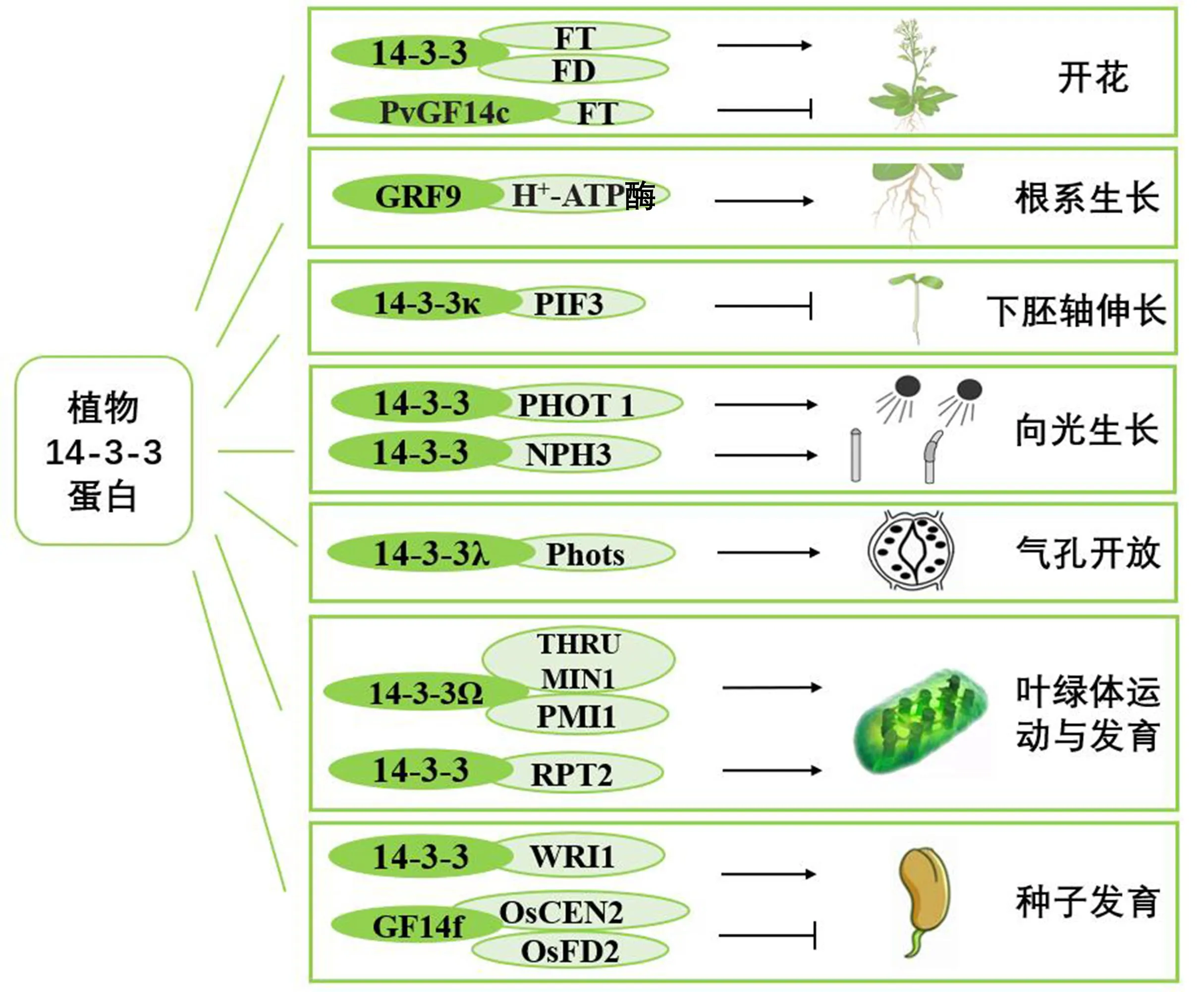
图3 植物14-3-3蛋白的功能Fig.3 Function of 14-3-3 proteins in plants
2.1.1 14-3-3蛋白调控植物开花 成花素开花位点T(flowering locus T, FT)在植物光周期开花途径中起重要作用,FT蛋白与开花位点D(flowering locus D, FD)蛋白结合形成蛋白复合体进而调控一系列开花相关基因的表达,促进植物开花[26]。如:水稻14-3-3蛋白与OsHd3a、OsFD1蛋白相互作用,形成三元复合物后能够激活下游OsMADS15基因的转录,促进水稻开花[27-28];棉花(Gossypiumspp.)GhGRF蛋白与GhFT、GhFD蛋白相互作用,三者形成的复合体能够激活下游花器官发育相关基因的表达,GhGRF14基因异源表达的拟南芥开花提前,说明棉花GhGRF蛋白也可正向调控开花[29];早竹(Phyllostachysviolascens)PvGF14c蛋白与PvFT相互作用,使PvGF14b、PvGF14c和PvGF14e基因异源表达的拟南芥开花延迟,说明早竹PvGF基因可能负调控植物开花[30]。关于不同14-3-3蛋白调控植物开花的机制还需进一步阐明。
2.1.2 14-3-3蛋白调控植物根系生长 根系是植物的重要营养器官,通过吸收水分和养分、固定植物体、储存养分和进行同化作用等方式,为植物的生长发育提供必要条件。14-3-3蛋白家族成员参与调控植物根系的生长。如:拟南芥14-3-3μ、14-3-3μ-1和14-3-3υ突变体植株在红光下根系生长受到抑制,暗示14-3-3蛋白可能参与光对植物根系生长的调控过程[31];毛竹(Phyllostachysedulis)Pe14-3-3b基因异源表达拟南芥后,植株根系变长,表明Pe14-3-3b促进了转基因拟南芥根系的生长发育[32];烟草过表达GRF9基因后,植株H+-ATPase活性增强,并且通过促进低磷条件下根系H+的流出,促进磷转运基因的表达和根系生长[33]。14-3-3蛋白调控植物根系生长的相关机制还有待深入研究。
2.1.3 14-3-3蛋白调控植物下胚轴伸长 植物幼苗的形态建成分为暗形态建成和光形态建成。暗中生长的植物的下胚轴长、子叶闭合,植物顶端形成弯钩(称为暗形态建成);而光下生长的植物的下胚轴短、子叶打开,无顶端弯钩形成(称为光形态建成)[34]。植物的这种生长方式由光信号转导通路调控。14-3-3突变体幼苗在红光下呈现长下胚轴表型[35],GRF4过表达植物呈现短下胚轴表型[22],说明14-3-3蛋白能够促进植物的光形态建成。目前已知14-3-3蛋白主要通过与磷酸化的光敏色素互作因子3(phytochrome lnteracting factors 3, PIF3)相互作用,促进PIF3降解,从而正向调控植物光形态建成[36]。
2.1.4 14-3-3蛋白调控植物向光生长 向性生长是植物在生长发育的过程中对外部环境的物理或化学因素做出的反应,由此调节自身的生长方向。向光生长是向性生长的其中一种,光线是影响植物向光生长的重要因素之一,植物可以感知光线的方向和强度,当植物受到一侧光线的照射时,该侧的生长速度会减慢,导致植物向另一侧弯曲[37]。拟南芥的向光性主要由蓝光受体向光素(phototropin, PHOT)控制,非向光性胚轴3(nonphototropic hypocotyl 3, NPH3)蛋白是向光性通路的重要信号蛋白,PHOT能够磷酸化NPH3蛋白[38]。目前已知拟南芥14-3-3蛋白能够通过两种机制对植物的向光生长进行调控:(1)14-3-3蛋白直接与磷酸化的PHOT1发生蓝光依赖的互作,互作后可能通过影响PHOT1与其他蛋白的互作来调控植物向光生长[39];(2)14-3-3蛋白在蓝光下与磷酸化的NPH3蛋白相互作用,诱导NPH3蛋白的去磷酸化和定位状态的变化,从而调控NPH3的活性[38,40]。
2.1.5 14-3-3蛋白调控植物气孔开放 植物气孔能够感知外界的环境变化,如光照、温度和二氧化碳浓度等变化,并在这些因素的刺激下做出相应反应,从而调节水分和气体交换。14-3-3蛋白参与调控拟南芥向光素PHOT2介导的气孔开放过程,通过与磷酸化PHOT2蛋白相互作用,促进气孔开放[41-42]。另外,14-3-3蛋白也参与调控植物在高温下的气孔开放,拟南芥14-3-3突变体植株叶片的气孔导度在高温下显著变小,说明14-3-3蛋白功能的缺失会阻断其与下游蛋白相互作用,从而抑制高温诱导的气孔开放[43]。
2.1.6 14-3-3蛋白调控植物叶绿体运动与发育 光依赖的叶绿体运动是一种肌动蛋白依赖的细胞对光环境变化的反应,可帮助植物最大限度地进行光合作用,并减少光损伤。蓝光下,拟南芥PHOT蛋白能够激活THRUMIN1蛋白、质膜运动受损(plastid movement impaired, PMI)蛋白PMI1和根向光性(root phototropism, RPT)蛋白RPT2等与叶绿体运动相关的质膜结合蛋白的磷酸化,14-3-3κ/λ蛋白通过与磷酸化的PMI1、THRUMIN1和RPT2蛋白的互作来调控叶绿体在细胞质或细胞膜上的锚定位置,从而调控叶绿体光下的运动[44-46]。除了参与调控叶绿体运动外,14-3-3蛋白还参与调控叶绿体发育。14-3-3μ和14-3-3ν的TDNA插入突变体幼苗见光后,原本无叶绿体的根系产生大量叶绿体,且叶绿体数目显著多于野生型,说明14-3-3蛋白参与调控叶绿体发育[31],但其中的分子机制并不清楚。
2.1.7 14-3-3蛋白调控种子发育 14-3-3蛋白调控植物的种粒大小和种子中油类物质的积累。水稻14-3-3蛋白GF14f能够与籽粒大小的负调控因子CENTRORADIALIS2、OsFD2相互作用,负调控籽粒大小[47]。14-3-3蛋白能够与植物油生物合成的关键转录因子WRINKLED1相互作用,增强WRINKLED1蛋白的稳定性和转录活性,从而促进植物油类物质的合成[48]。此外,14-3-3蛋白还调控小麦(Triticumaestivum)淀粉合成[49]、水稻灌浆[50]和玉米(ZeamaysL.)籽粒发育[51]等。
2.2 14-3-3蛋白参与调控植物胁迫响应
植物在生长发育的过程中经常会受到高温、低温、盐碱、干旱和病原体等内外胁迫因素的影响,植物无法像动物一样迁徙以躲避危害,只能通过自身调控来适应不利的环境条件。目前已知14-3-3蛋白参与调控植物的胁迫响应(图4)。
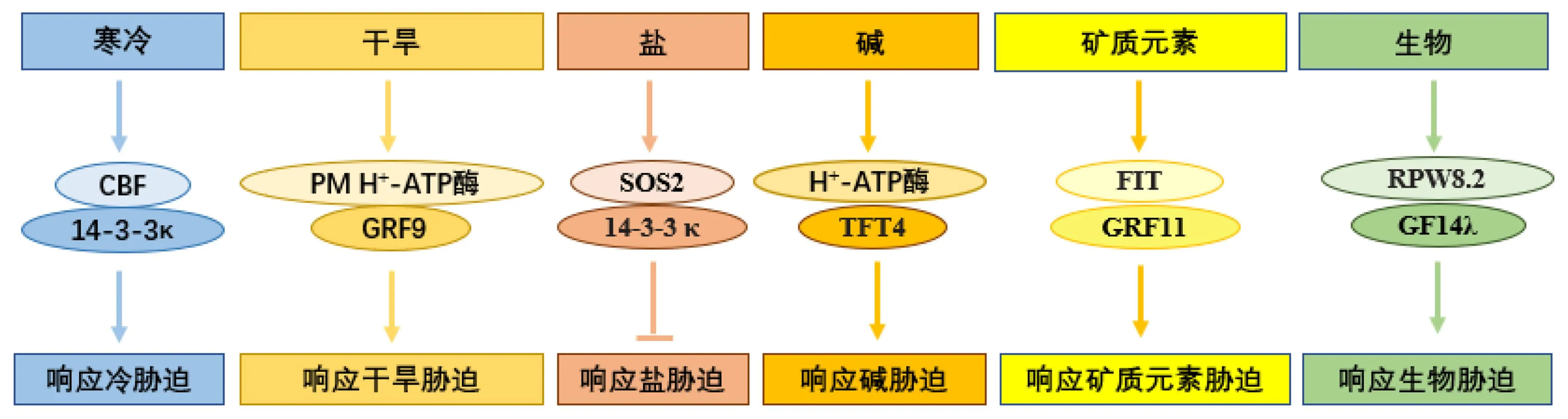
图4 14-3-3蛋白参与调控植物的胁迫响应Fig.4 Plant 14-3-3 proteins involved in stress response
2.2.1 14-3-3蛋白参与调控植物干旱胁迫响应 干旱胁迫是全球面临的一个严重问题,会导致植物水分亏缺、氧化应激和营养失衡等一系列生理生化变化,从而影响植物的生长发育[52]。14-3-3蛋白主要通过两种机制调控植物干旱胁迫响应。(1)调控物质运输和气孔开放等过程。如:拟南芥过表达GRF9基因后,植株根系生长区的H+分泌增强,自身耐旱性也提高[33];拟南芥GF14λ基因异源表达在棉花中,能够增大植株叶片的气孔导度,提高蒸腾速率和光合速率,增强植株的耐旱性[53-54];玉米ZmGF14-6基因异源过表达于水稻中,能够诱导干旱相关基因的表达,增强对干旱胁迫的耐受性[55]。(2)与干旱响应关键因子相互作用。如:大麦(Hordeumvulgare)14-3-3蛋白家族5个成员的转录均受到干旱胁迫的高度诱导,14-3-3蛋白能够与干旱响应关键因子,如气孔开放(open stomata, OST)蛋白HvOST1、慢阴离子通道(slow anion channel, SLAC)蛋白HvSLAC1、热激蛋白(heat shock proteins, HSP)HvHSP90-1/2/5和脱水响应元素结合(dehydration-responsive element-binding, DREB)蛋白HvDREB3等相互作用[56],但它们互作后如何调控干旱胁迫响应的机制尚不明确。目前已知大麦Hv14-3-3A蛋白表达降低后,可通过提高气孔密度和蒸腾压差(vapor pressure deficit, VPD)、降低光合作用来提高幼苗的干旱敏感性[56]。
2.2.2 14-3-3蛋白参与调控植物冷胁迫响应 温度是影响植物生长发育最重要的环境因素之一。与野生型相比,拟南芥14-3-3λκ双突变体植株表现出更强的抗冻性。14-3-3蛋白主要通过两种机制调控植物的冷胁迫响应。(1)与冷胁迫相关因子相互作用。低温下,冷响应蛋白激酶1(cold-responsive protein kinase 1, CRPK1)通过磷酸化14-3-3蛋白,使其从细胞质转移至细胞核中,与冷胁迫关键转录因子(C-repeat binding factor, CBF)相互作用,促进CBF降解,从而抑制冷胁迫响应[57]。(2)调控自身在冷胁迫中的稳定性。冷胁迫和热胁迫处理上调或下调葡萄(Vitisvinifera)体内14-3-3蛋白的表达[58],但相关机制并不清楚。
2.2.3 14-3-3蛋白参与调控植物盐碱胁迫响应 植物盐碱胁迫是指在高盐和高碱环境下,植物所受到的逆境压力。盐碱胁迫是全球面临的一个严重问题,会影响植物的生长发育,进而影响全球粮食安全。植物的耐盐性受多种信号,如盐超敏感(salt overly-sensitive, SOS)通路调控。其中,盐超敏感蛋白SOS2是SOS通路的关键组分,在盐胁迫下被激活以增强植物的耐盐性。14-3-3蛋白参与植物负调控盐胁迫响应过程,14-3-3λk双突变体植株的耐盐能力增强。在无盐或低盐条件下,拟南芥14-3-3λ、14-3-3κ与SOS2蛋白相互作用,抑制SOS2蛋白激酶活性;盐胁迫促进14-3-3λ和14-3-3κ降解,14-3-3蛋白与SOS2蛋白解离,SOS通路被激活,植物耐盐性增强[59-60]。
番茄14-3-3家族基因TFT1、TFT4、TFT6和TFT7的表达受碱胁迫调控。TFT4蛋白通过调控质膜H+-ATPase介导的H+输出、吲哚-3-乙酸(indole-3-acetic acid, IAA)运输等过程,帮助植物根尖应对碱胁迫并维持初生根的伸长[5]。
2.2.4 14-3-3蛋白参与矿物质稳态调节 植物生长需要一定量的矿物质营养元素,如氮、磷、钾等,这些元素缺乏会造成胁迫响应,影响植物生长发育。番茄14-3-3家族基因TFT正向调控植物的低磷酸胁迫响应,TFT6和TFT7异源表达的拟南芥对低磷的耐受性均显著下降。TFT6主要作用于叶片,能够调控叶片的碳分配,促进韧皮部蔗糖的转运,从而促进植株对低磷条件的响应;TFT7直接作用于根系,能够激活根系质膜的H+-ATPase促进质子转运,从而提高植物对低磷条件的耐受性[5]。拟南芥GRF11在铁元素缺乏反应中起重要作用。类缺铁诱导转录因子(FER-like Fe deficiency-induced transcription factor, FIT)与GRF11的启动子结合并影响其转录[61]。镁离子对H+-ATPase的水解至关重要,微摩尔的镁离子可以通过诱导蚕豆(ViciafabaL.)质膜H+-ATPase2(vicia faba plasma membrane H+-ATPase 2, VHA2)的磷酸化,促进VHA2与蚕豆vf14-3-3b蛋白相互作用以减轻环境中铝元素的毒性[62]。
2.2.5 14-3-3蛋白参与植物生物胁迫响应 生物胁迫是指病原菌、寄生虫、草食性动物和竞争者等生物因素对生物体造成的压力。在许多生物胁迫响应中,尤其在防御病原体方面,14-3-3蛋白发挥了重要作用。在拟南芥中发现,白粉病抗性蛋白RPW8.2含14-3-3蛋白的靶蛋白磷酸化基序Ⅲ,GF14λ蛋白能够与RPW8.2的C端相互作用,进而正向调控拟南芥对白粉病的抗性[63]。烟草14-3-3G蛋白通过调节DNA结合蛋白磷酸酶1(DNA-binding protein phosphatase 1, DBP1)的核质穿梭对协调植物-病毒互作(compatible plant-virus interaction, CEVI)基因CEVI1的转录进行调控。正常条件下,DBP1与其靶基因CEVI1的启动子结合并抑制其转录;当受到病毒侵袭时,14-3-3G被快速地诱导入核并与DBP1结合,促进DBP1从细胞核转移到细胞质中,CEVI1基因的抑制得以解除[64]。番茄14-3-3蛋白TFT7通过与丝裂原活化蛋白级联蛋白激酶(mitogen-activatedprotein kinase kinasekinaseα, MAPKKKα)相互作用正向调控与免疫相关的程序性细胞死亡[65]。水稻14-3-3蛋白Gf14f、Gf14g能够与水稻黄单胞菌蛋白(xanthomonas outer protein, Xop)XopQ相互作用,参与调控植物先天免疫的信号转导。将XopQ中14-3-3结合基序的丝氨酸突变为丙氨酸后,XopQ与Gf14f、Gf14g的互作被抑制,植株丧失先天免疫的能力[66],但相关机制尚不明确。
3 展望
14-3-3蛋白广泛存在于几乎所有的植物物种中,通过形成同源或异源二聚体发挥作用,二聚体的14-3-3蛋白与众多靶蛋白相互作用影响靶蛋白的定位、结构或活性,从而调控植物诸多的生长发育过程及胁迫响应,帮助植物更好地适应环境变化。目前,虽然已报道14-3-3蛋白调控众多的生物学过程及其调控相关的生物学机制,但14-3-3蛋白如何受相关信号通路的调控并不清楚。如:14-3-3蛋白能够与光信号通路蛋白(PHOT、PIF3等)相互作用调控植物的光形态建成、叶绿体运动及向光生长,但光信号通路如何调控14-3-3蛋白的表达、活性和定位等并不明确;同时,目前也尚不明确胁迫信号通路如何调控14-3-3蛋白的变化。这些问题仍需进一步研究。
由于14-3-3蛋白调控植物生长发育和胁迫响应等过程,分离鉴定调控14-3-3蛋白活性的新型互作蛋白或药物是研究14-3-3蛋白调控的有效途径。调节14-3-3蛋白活性将有望改变植物开花时间、光合效率和抗逆性等,为培育生育周期短、高光效及抗逆的农林作物提供依据。

