酒瓶椰子叶枯病病原菌鉴定
范绍斌, 苏济钰, 樊改丽, 阮志平, 张华峰, 胡艳萍, 贾 悦, 梁欣妤, 王宗华, 胡红莉
(1.福建农林大学植物保护学院,福建 福州 350002;2.闽江学院地理与海洋学院,福建 福州 350108; 3.厦门市绿化中心,福建 厦门 361004;4.厦门市园林植物园,福建 厦门 361003)
酒瓶椰子[Hyophorbelagenicaulis(L. H. Bailey) H. E. Moore]是棕榈科酒瓶椰子属中一种非常珍贵的观赏植物,其干形奇特、树姿秀美、叶姿婆娑,下部的茎干膨大,形状宛如酒瓶。酒瓶椰子的适应性较强,既可作为盆栽装饰植物,也可作为园林绿化树种。其原产于热带地区,我国台湾、广西、海南、广东和福建等地均进行了引种栽培[1]。随着其种植规模逐渐扩大,病害问题日益严重,主要包括心腐病、叶枯病等[2]。
近年来,厦门市园林植物园中酒瓶椰子的叶片出现了大量褐色病斑,随着病情的加重,病斑向外扩张并互相连接,形成不规则的褐色大病斑,最终导致全叶枯死,严重影响了植株的正常生长,降低了其观赏价值。由于该病害引起的症状与前人报道的酒瓶椰子叶枯病的发病症状[2]类似,本研究将该病害归为酒瓶椰子叶枯病。
有关酒瓶椰子叶枯病的研究主要集中在其发病症状的描述方面,对造成该病害的病原菌的研究较少。植物病害综合防治的基础是查明病因。本研究从厦门市园林植物园内采集12份染病的酒瓶椰子叶片样品,对其病原菌进行分离和纯化,并通过形态特征观察和基于3个基因(ITS、TUB2和TEF1)的系统发育分析,对所获得的病原菌菌株进行鉴定,为酒瓶椰子叶枯病的绿色防控提供依据。
1 材料与方法
1.1 病原菌的分离与纯化
2017年8月在厦门市园林植物园(24°27′N,118°05′E)内采集典型的酒瓶椰子发病叶片,通过常规组织分离法分离病原菌菌株[3],随后将这些菌株保存在装有马铃薯葡萄糖琼脂(PDA)斜面培养基(200 g马铃薯、20 g葡萄糖、20 g琼脂、1 L蒸馏水)的5 mL冻存管中,待菌丝长满PDA斜面培养基后再将冻存管放入4 ℃冰箱中保存备用。
1.2 病原菌的形态鉴定
观察、记录菌株在PDA培养基上培养7 d后的性状(包括菌落直径、颜色、质地、是否产孢等),在体视显微镜(奥林巴斯SZX-16)下观察子实体形态特征,在显微镜(奥林巴斯BX-53)下观察产孢结构和分生孢子(大小、颜色、形状等)的形态特征。根据形态特征,查阅相关的资料[4]进行初步鉴定。
1.3 病原菌的分子鉴定
参考朱仰艳等[3]的DNA提取、PCR扩增和琼脂糖凝胶电泳检测等方法,并根据实际情况进行调整。本研究所用的3对引物:真菌核糖体基因内转录间隔区ITS为ITS1-F/CTTGGTCATTTAGAGGAAGTAA和ITS4/TCCTCCGCTTATTGATATGC[5-6];微管蛋白TUB2为Bt2a/GGTAACCAAATCGGTGCTGCTTTC和Bt2b/ACCCTCAGTGTAGTGACCCTTGGC[7];转录延伸因子TEF1为EF1-728F/CATCGAGAAGTTCGAGAAGG 和EF2/GGARGTACCAGTSATCATGTT[8-9]。
将PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,在NCBI数据库中,通过BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对将所得菌株鉴定到属,选取已发表文章中相似度和可信度较高的参考序列,以及Hyde et al[10]和Gualberto et al[11]研究中所用的部分序列用于本研究的系统发育分析。使用PhyloSuite v1.2.1软件[12]以最大似然法和贝叶斯法构建3个基因的联合系统发育树,将菌株鉴定到种。用Figtree v.1.4.0软件(http://tree.bio.ed.ac.uk/software/figtree/)对系统发育树进行适当调节后,再用Adobe Acrobat DC和PowerPoint软件进行编辑与美化。
1.4 菌株致病性测定
为了确定所获得的菌株是否为酒瓶椰子叶枯病的病原菌,本研究采用柯赫式法则进行验证。选取健康的酒瓶椰子叶片,先用清水洗净叶片表面,并用无菌滤纸擦干表面水分,再用75%(体积分数)酒精对叶片进行消毒,随后将叶片放入透明培养皿中(皿内放2张用水润湿过的滤纸),用润湿的棉花包裹叶柄部,保持培养皿内湿润但无积水。然后用无菌的20 μL枪头在叶片表面轻微造伤,每片叶造伤4处,每处放置一块直径为5 mm的菌饼。每个菌株做3组重复试验,以接种无菌的PDA培养基作为空白对照。最后将其放入恒温培养箱(12L∶12D、25 ℃)中进行培养,观察并记录7 d后的发病情况。之后取植物组织的病健交界处,再次按组织分离法分离、纯化菌株,并对其进行鉴定,与最初分离获得的菌株进行形态特征比较和系统发育分析。
2 结果与分析
2.1 病原菌的初步鉴定
共采集了12份酒瓶椰子的发病叶片(图1),分离、纯化得到5个类拟盘多毛孢属(Pestalotiopsis-like)真菌菌株。类拟盘多毛孢属真菌包含拟盘多毛孢属(Pestalotiopsis)、新拟盘多毛孢属(Neopestalotiopsis)和假拟盘多毛孢属(Pseudopestalotiopsis)[4]。综合该类真菌特有的形态特征(分生孢子中间3个细胞的颜色等)[4]和3个基因(ITS、TUB2和TEF1)序列在NCBI数据库中的比对结果,将其中3个菌株(ZL11、ZL14和ZL29)归为拟盘多毛孢属,1个菌株(ZL45)归为新拟盘多毛孢属,1个菌株(ZL30)归为假拟盘多毛孢属。

图1 酒瓶椰子(A)及其病叶(B)Fig.1 H.lagenicaulis (A) and symptoms of leaf blight (B)
2.2 病原菌的分子鉴定
用最大似然法和贝叶斯法构建了3个基因串联(ITS+TUB2+TEF1)的系统发育树。结果表明,最大似然树和贝叶斯树的拓扑结构是一致的。因此,选择3个基因的贝叶斯树(图2)进行展示。
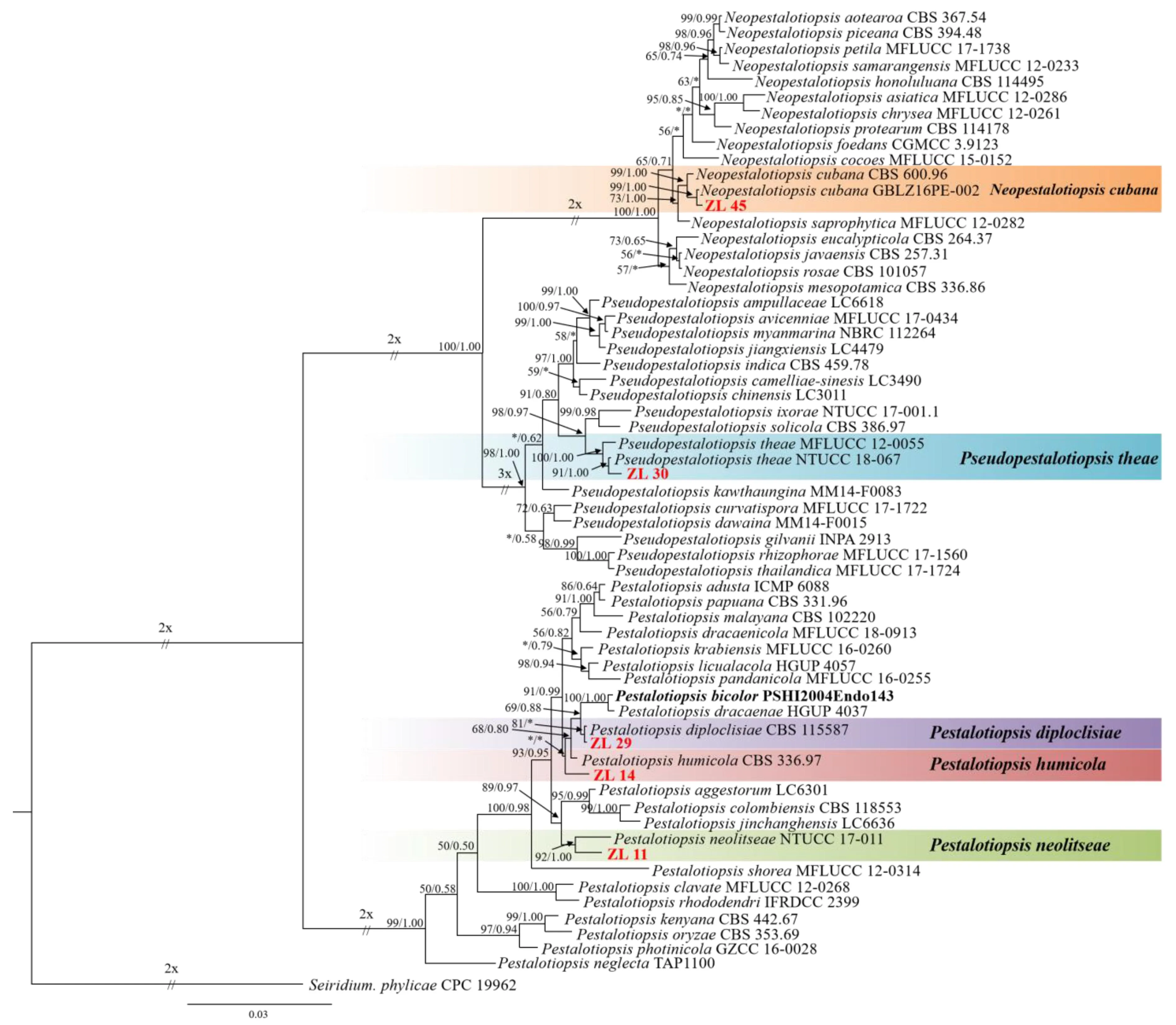
最大似然支持率≥50%或贝叶斯后验概率≥0.50显示在系统发育树上;最大似然支持率低于 50%或贝叶斯后验概率低于 0.50用“*”表示。本研究所分离的菌株用红色字体标出;标尺表示每个位点的核苷酸替换的预期数量。
3个基因DNA序列的总长度为1 304 bp,即ITS为482 bp,TUB2为416 bp,TEF1为406 bp。ITS最适模型为GTR+I,TUB2最适模型为HKY+G,TEF1最适模型为GTR+I+G。系统发育树被分为3个支系,分别对应Neopestalotiopsis、Pestalotiopsis和Pseudopestalotiopsis。在Neopestalotiopsis分支中, ZL45与N.cubana以99%的支持率和1.00的后验概率聚在一起。在Pestalotiopsis分支中:ZL29与P.diploclisiae聚类,支持率为81%,而后验概率小于0.50;ZL11与P.neolitseae聚在一起,支持率为92%,后验概率为1.00;ZL14为一个单独的类群,但支持率和后验概率都很低。在Pseudopestalotiopsis分支中, ZL30与Ps.theae聚类,支持率为91%,后验概率为1.00。
2.3 病原菌的形态特征
2.3.1 菌株ZL45 (N.cubanaMaharachch, K.D. Hyde &Crous) 培养性状:PDA培养基上的菌丝生长速度较快,培养7 d后,菌落直径达到8.0 cm;菌落正面颜色雪白,绒毛状,边缘较规则,具有同心轮纹,但不明显;背面为蜂蜜色(图3A-3B)。PDA培养基上的子实体为黑色墨汁状,埋生或半埋生,单独或聚生(图3C)。

A-B.PDA培养基上培养7 d后的菌落(A为正面,B为反面);C.分生孢子堆;D.分生孢子盘、产孢细胞及未成熟的分生孢子; E-F.分生孢子。单位长度:20 μm。
显微特征:分生孢子盘上的分生孢子梗不明显,通常退化为产孢细胞,产孢细胞无色透明、群生,呈保龄球形状(图3D);分生孢子5个细胞,梭形,直或稍弯曲,大小为(23.0~27.5) μm×(7.0~8.8) μm;中间3个细胞异色,长度为15.3~18.9 μm,从基部起第2个细胞呈淡褐色,第3个和第4个细胞呈暗褐色;顶端细胞呈圆锥状、无色透明,长度为3.5~5.0 μm,顶端着生2~4根管状附属丝(通常为2或3根),长度为22.5~28.8 μm;基部细胞圆锥形、无色透明,长度为4.4~6.3 μm,基部附属丝通常有1根,长度为4.9~7.5 μm(图3E-3F)。
ZL45与N.cubana在系统发育树上聚在一起,支持率和后验概率都比较高;同时,ZL45的形态特征与N.cubana[4]比较相似。故将ZL45鉴定为N.cubana。
N.cubana是Maharachchikumbura et al[4]在古巴不知名植物上发现的种,该种真菌可引起泰国橡胶树(Heveabrasiliensis)发生落叶病[13]。本研究首次在我国发现该种真菌(地理新记录),同时,酒瓶椰子是该种真菌的新寄主(寄主新记录)。此外,先前未见酒瓶椰子发生新拟盘多毛孢属真菌的报道,这是酒瓶椰子作为新拟盘多毛孢属真菌寄主的首次报道。
2.3.2 菌株ZL29 (P.diploclisiaeMaharachch, K.D. Hyde &Crous) 培养性状:PDA培养基上的菌丝生长速度一般,培养7 d后,菌落直径达到6.5 cm;菌落正面颜色雪白,绒毛状,边缘不规则,没有同心轮纹;背面为淡橙色(图4A-4B)。PDA培养基上的子实体为黑色墨汁状,埋生或半埋生,单独或聚生(图4C)。

A-B.PDA培养基上培养7 d后的菌落(A为正面,B为反面);C.分生孢子堆;D.分生孢子盘、产孢细胞及未成熟的分生孢子; E-F.分生孢子。单位长度:20 μm。
显微特征:分生孢子盘上的分生孢子梗不明显,通常退化为产孢细胞,产孢细胞无色透明、群生,呈保龄球形状(图4D);分生孢子5个细胞,梭形,直或稍弯曲,大小为(23.3~30.0) μm×(5.0~6.6) μm;中间3个细胞同色,均为浅褐色,长度为14.5~18.8 μm;顶端细胞呈圆锥状、无色透明,长度为4.2~5.0 μm,顶端着生2~4根管状附属丝,长度为11.9~20.7 μm;基部细胞圆锥形、无色透明,长度为4.8~6.3 μm,基部附属丝通常有1根,长度为2.5~5.0 μm(图4E-4F)。
ZL29与P.diploclisiae在系统发育树上聚在一起,支持率为81%,后验概率小于0.50;但ZL29的形态特征与P.diploclisiae[4]总体相似。故将ZL29鉴定为P.diploclisiae。
P.diploclisiae是Maharachchikumbura et al[4]在苍白秤钩风(Diploclisiaglaucescens)和假九节(Psychotriatutcheri)上发现的种,该种真菌是我国桉树(Eucalyptusrobusta)的主要内生真菌之一[14]。这是酒瓶椰子作为该种真菌寄主的首次报道(寄主新记录),并且首次提出了该种真菌可以作为病原菌危害植物。
2.3.3 菌株ZL14 (P.humicolaMaharachch, K.D. Hyde &Crous) 培养性状:PDA培养基上的菌丝生长速度较快,培养7 d后,菌落直径达到8.0 cm;菌落正面颜色雪白,绒毛状,边缘不规则,具有同心轮纹;背面为淡黄褐色(图5A-5B)。PDA培养基上的子实体为黑色墨汁状,埋生或半埋生,单独或聚生(图5C)。

A-B.PDA培养基上培养7 d后的菌落(A为正面,B为反面);C.分生孢子堆;D.分生孢子盘、产孢细胞及未成熟的分生孢子; E-F.分生孢子。单位长度:20 μm。
显微特征:分生孢子盘上的分生孢子梗不明显,通常退化为产孢细胞,产孢细胞无色透明、群生,呈保龄球形状(图5D);分生孢子5个细胞,梭形,直或稍弯曲,大小为(19.8~25.0) μm×(5.0~7.5) μm;中间3个细胞同色,均为浅褐色,长度为12.2~15.1 μm;顶端细胞长度为3.5~5.0 μm,顶端着生1~3根管状附属丝,长度为7.7~20.6 μm;基部细胞长度为4.0~5.0 μm,基部附属丝通常有1根,长度为3.8~6.3 μm(图5E-5F)。
ZL14在系统发育树中为一个独立的分支,然而支持率小于50%,后验概率小于0.50;ZL14与P.bicolor、P.diploclisiae、P.dracaenae和P.humicola是姊妹分支。通过查阅文献发现, ZL14的形态特征与P.humicola[4]非常相似,因此,将其鉴定为P.humicola。
P.humicola是Maharachchikumbura et al[4]在我国香港的灰冬青(Ilexcinerea)果实上发现的种,目前,关于该种真菌的报道很少。本研究首次报道酒瓶椰子是该种真菌的寄主(寄主新记录),并且首次提出了该种真菌可以作为病原菌危害植物。
2.3.4 菌株ZL11 (P.neolitseaeH.A. Ariyawansa &K.D. Hyde) 培养性状:PDA培养基上的菌丝生长速度较快,培养7 d后,菌落直径达到8.0 cm;菌落正面颜色雪白,绒毛状,边缘较规则,具有同心轮纹,但不明显;背面为淡橙色(图6A-6B)。PDA培养基上的子实体为黑色墨汁状,埋生或半埋生,单独或聚生(图6C)。
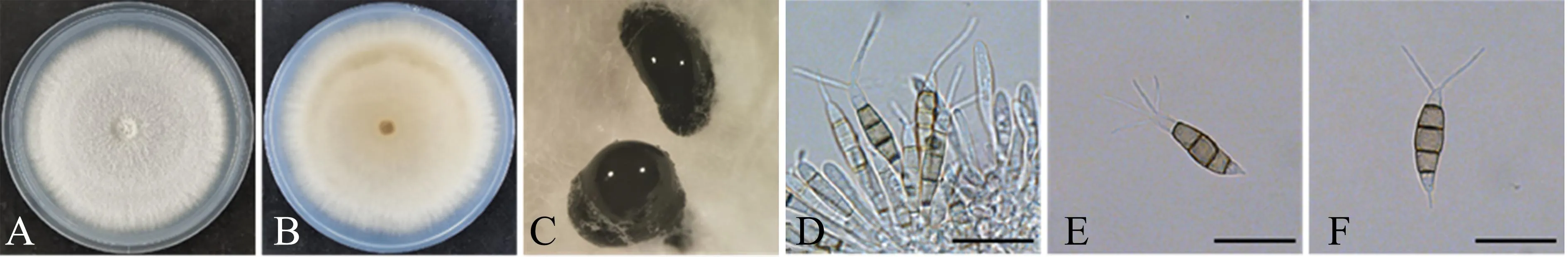
A-B.PDA培养基上培养7 d后的菌落(A为正面,B为反面);C.分生孢子堆;D.分生孢子盘、产孢细胞及未成熟的分生孢子; E-F.分生孢子。单位长度:20 μm。
显微特征:分生孢子盘上的分生孢子梗不明显,通常退化为产孢细胞,产孢细胞无色透明、群生,呈保龄球形状(图6D);分生孢子5个细胞,梭形,直或稍弯曲,大小为(19.0~26.3) μm×(4.8~7.5) μm;中间3个细胞同色,均为浅褐色,长度为11.1~16.3 μm;顶端细胞圆锥状、无色透明,长度为3.7~6.3 μm,顶端着生2~4根管状附属丝,长度为8.8~18.8 μm;基部细胞长度为3.8~5.4 μm,基部附属丝通常有1根,长度为1.2~5.1 μm(图6E-6F)。
ZL11与P.neolitseae在系统发育树上形成姊妹分支,支持率92%,后验概率1.00,都比较高;同时,ZL11的形态特征与P.neolitseae[15]大体相似。故将ZL11鉴定为P.neolitseae。
P.neolitseae是Ariyawansa et al[15]在我国台湾兰屿新木姜子(Neolitseavillosa)上发现的种,其能引起兰屿新木姜子发生叶斑病。酒瓶椰子是该种真菌的新寄主(寄主新记录)。
2.3.5 菌株ZL30 [Ps.theae(Sawada) Maharachch, K.D. Hyde &Crous] 培养性状:PDA培养基上的菌丝生长速度较快,培养7 d后,菌落直径达到8.5 cm;菌落正面颜色雪白,绒毛状,边缘规则,具有同心轮纹;背面为淡橙色(图7A-7B)。PDA培养基上的子实体为黑色墨汁状,埋生或半埋生,单独或聚生(图7C)。

A-B. PDA培养基上培养7 d后的菌落(A为正面,B为反面);C.分生孢子堆;D.分生孢子盘、产孢细胞及未成熟的分生孢子; E-F.分生孢子。单位长度:20 μm。
显微特征:分生孢子盘上的分生孢子梗不明显,通常退化为产孢细胞,产孢细胞无色透明、群生,呈保龄球形状(图7D);分生孢子5个细胞,梭形,直或稍弯曲,大小为(22.0~26.4) μm×(7.2~8.8) μm;中间3个细胞异色,长度为14.5~18.2 μm,从基部起第2个细胞浅褐色,第3个和第4个细胞褐色;顶端细胞圆锥状、无色透明,长度为3.4~4.1 μm,顶端着生2~3根管状附属丝,长度为15.9~30.6 μm;基部细胞长度为3.6~4.5 μm,基部附属丝通常有1根,长度为3.5~8.7 μm(图7E-7F)。
ZL30与Ps.theae在系统发育树上聚在一起,支持率91%,后验概率1.00;同时,ZL30的形态特征与Ps.theae[16]较为相似。故将ZL30鉴定为Ps.theae。
Ps.theae是Sawada[16]在茶树上发现的种,该种真菌为茶轮斑病的主要病原真菌[17-18]。本研究首次报道酒瓶椰子为该种真菌的寄主(寄主新记录);此外,先前没有酒瓶椰子上发生假拟盘多毛孢属真菌的报道,这是酒瓶椰子作为假拟盘多毛孢属真菌寄主的首次报道。
2.4 病原菌的致病性
本研究对所有获得的菌株进行柯赫式法则验证,发现N.cubana(ZL45)、P.diploclisiae(ZL29)、P.humicola(ZL14)和Ps.theae(ZL30)可以侵染酒瓶椰子叶片,并在接种3 d后出现了叶枯病的初期症状,接种7 d后,病斑直径大小分别为(1.18±0.24)、(0.81±0.06)、(1.39±0.13)、(0.57±0.05) cm(图8-9)。致病性从强到弱依次为P.humicola、N.cubana、P.diploclisiae和Ps.theae,而P.neolitseae不能侵染酒瓶椰子叶片。取被侵染叶片的病健交界处,分离、纯化菌株,通过形态观察和系统发育分析发现,其与最初得到的菌株均一致,证实N.cubana、P.diploclisiae、P.humicola和Ps.theae是酒瓶椰子叶枯病的病原菌。

图8 酒瓶椰子叶片接种5种类拟盘多毛孢属真菌和PDA(CK)7 d后的发病情况Fig.8 Pathogenicity test on H.lagenicaulis leaves inoculated with 5 Pestalotiopsis-like species and PDA (CK) at 7 d

误差线为标准差,柱上不同字母表示经单因素ANOVA检验具有显著差异(P<0.05),相同字母表示差异不显著(P>0.05)。
3 讨论
类拟盘多毛孢属真菌的3个属形态特征很相似,主要区别在于分生孢子中间3个细胞的颜色不同:拟盘多毛孢属的3个细胞同色,多为浅褐色;新拟盘多毛孢属的3个细胞异色;假拟盘多毛孢属的3个细胞同色,多为深褐色[4]。类拟盘多毛孢属真菌是能够侵染各类植物的常见病原菌,例如,N.chrysea可以侵染枫香(Liquidambarformosana),P.neglecta能够侵染柳杉(Cryptomeriajaponica),Ps.gilvanii可以侵染瓜拉那(Paulliniacupanavar.sorbilis)[11,19-20]。目前,类拟盘多毛孢属真菌中只有P.bicolor发生于酒瓶椰子的报道[21]。
本研究从酒瓶椰子病叶上分离得到5个类拟盘多毛孢属真菌菌株,即P.neolitseae、P.diploclisiae、P.humicola、N.cubana和Ps.theae,均首次在酒瓶椰子上被发现,并且这也是酒瓶椰子上发现新拟盘多毛孢属和假拟盘多毛孢属真菌的首次报道;同时,N.cubana首次在我国被发现。从系统发育树中可以看出,ZL29与P.diploclisiae以及ZL14与P.humicola的支持率和后验概率都较低;但因为形态特征相似,所以暂将ZL29和ZL14分别鉴定为P.diploclisiae和P.humicola。后续还需要通过更多模式菌株的参考序列或新的基因分子标记做进一步鉴定。
本研究中,N.cubana、P.diploclisiae、P.humicola和Ps.theae均被确定为病原菌;而P.neolitseae不能侵染酒瓶椰子的叶片,因此,暂不将其定义为酒瓶椰子叶枯病的病原菌。此外,P.humicola对酒瓶椰子叶片的致病性最强,下一步需要重点对P.humicola进行深入研究。

