CoFe-LDH/泡沫铜的制备及催化介质阻挡放电等离子体降解水中敌草隆性能与机制
沈天瑶 杨 怿 于海鹤 徐 鹏 张广山 王 鹏*
1(哈尔滨工业大学环境学院,哈尔滨 150090)
2(青岛农业大学资源与环境学院,青岛 266109)
介质阻挡放电等离子体(DBDP)作为一种新兴的高级氧化技术在环境修复[1]、材料制备[2]和化学合成[3]等领域均有广泛的应用研究。特别是在环境领域中,DBDP 对污染的水[4]、气体[5]和污泥[6]均有良好的净化效果。农业支撑着人类生存繁衍,为了保证农作物的产量,农药的施用不可避免。敌草隆(DUR,3-(3,4-二氯苯基)-1,1-二甲基脲)是一种苯基脲类除草剂,常用于农业领域,其化学性质稳定,在环境中具有持久性、致癌性和遗传毒性,被列入欧洲议会指令的优先控制物质清单[7]。DBDP 在放电过程中会产生多种活性物质,包括H2O2、O3、紫外光、·OH和e-/·H等,DBDP的氧化能力为水体中DUR的高效去除提供了可能性。然而,氧化还原作为核心的化学反应,其放电过程中生成氧化剂(H2O2和O3)的有效转化和活性自由基的生成效率成为限制DBDP氧化降解能力的重要因素[8]。因此,高效的DBDP催化剂对于反应体系整体氧化降解能力的提升起着重要作用。目前,金属离子或其氧化物粉末常被用在DBDP 体系内作为催化剂强化整个体系对污染物的降解过程[9-10],尽管其催化性能十分优异,但是以还原态金属离子为核心的均相体系面临着水体中离子浓度高的问题,而以粉体金属氧化物为核心的非均相催化体系则会因为催化剂流失而造成不必要的损耗[11]。因此,开发结构稳定易于回收的非均相金属氧化物催化剂成为了目前的研究焦点。
层状双金属氢氧化物(LDH)由于具有独特的薄层状结构,更有利于电子的传递而被广泛应用于高级氧化体系中促进自由基的生成和利用。在制备过程中多种元素可以自由组合,金属阳离子类型和摩尔比的可调节性(M2+/M3+)赋予LDH 可调控的灵活性[12-13]。此外,还可以通过“记忆效应”重建LDH 调控层间阴离子的种类,进而调控层间距和催化性能,掺杂第3种元素形成的三元LDH的催化活性可以进一步提升[14]。泡沫金属由于具有良好的延展性和导电性被广泛应用于催化剂的载体,在固定粉末催化剂的基础上还可以引入还原态金属元素,与表面催化剂形成良好的电子转移与价态循环,保持催化剂的稳定性和催化活性[15]。此外,泡沫金属优异的稳定性可以承受极端条件,使其在高温高压环境下也能保持稳定。
本文通过一步水热法制备了具有高DBDP 催化活性的三元CoFe-LDH/CuF(CFHC)催化剂,增加了催化剂结构内氧空位含量,通过调节金属盐及尿素的摩尔比,调控制备催化剂的水热温度和时间,系统地研究了制备条件对CFHC 催化活性的影响。研究使用CFHC 催化调整了DBDP 体系内的优势活性物种,并通过微观结构表征阐明催化剂结构-功能关系。研究结果对DBDP 催化剂的开发以及催化剂的功能-结构设计和活性物种的选择应用具有十分积极的作用。
1 实验部分
1.1 仪器和试剂
STA449F5 型热重分析-质谱仪(TGA-MS,德国Netzsch 公司);D8 Advance 型X 射线衍射仪(XRD,德国Bruker公司);Sigma500型扫描电子显微镜(SEM,德国Zeiss公司);QUADRASORB SI型自动表面积和孔隙率分析仪(美国Quantachrome 公司);Spectrum One 型傅里叶变换红外光谱仪(FT-IR,美国PerkinElmer 公司);ESCALAB 250Xi型X 射线光电子能谱(XPS,美国Thermo Fisher 公司);CHI660E 型电化学工作站(EIS&LSV,上海辰华公司);1290型高效液相色谱仪(HPLC,美国Agilent公司)。
100 mm×100 mm×1 mm泡沫铜(CuF)购自中国天津安诺合新能源科技有限公司。敌草隆(DUR)、对苯醌(p-BQ)、九水硝酸铁(Fe(NO3)3·9H2O)、六水硝酸钴(Co(NO3)2·6H2O)和糠醇(FFA)均为分析纯试剂,购自中国上海阿拉丁试剂有限公司。分析纯的无水乙醇(C2H5OH)、丙酮(C3H6O)、尿素、异丙醇(IPA)和硝酸银(AgNO3)购自中国上海国药化学试剂有限公司。所有试剂直接使用,未作其它处理。低溶解度DUR(42 mg/L,去离子水)搅拌48 h,确保完全溶解。实验用水均为去离子水。
1.2 CoFe-LDH/CuF催化剂的制备
LDHs系列材料的制备 将不同摩尔比的Fe(NO3)3·9H2O和Co(NO3)2·6H2O溶解在60 mL去离子水中,同时加入适量尿素,搅拌至澄清后将溶液转移至聚四氟乙烯内衬后密封在不锈钢水热反应釜内,在干燥箱中保持120 ℃反应18 h,得到CoxFe1-x-LDH,其中x是Co(NO3)2·6H2O 投加量占摩尔比,Co0.75Fe0.25-LDH记为CoFe-LDH。反应结束后将沉淀转移至离心管内,使用无水乙醇和去离子水交替洗涤数次后于70 ℃干燥箱内过夜烘干。
复合材料的制备 将CuF 片(10 mm×10 mm×1 mm)浸入0.1 mol/L Fe(NO3)3·9H2O、0.3 mol/L Co(NO3)2·6H2O和1 mol/L尿素的混合水溶液中;将混合物转移到四氟衬里的水热釜中,并在120 ℃下保持温度18 h;表面沉积有LDH的CuF薄片用去离子水和无水乙醇交替洗涤,标记为CFHC。
1.3 催化降解性能测试装置及实验方法
DBDP/CFHC 催化降解实验在实验室自制同轴圆筒形DBDP中进行[16],如图1所示,反应器分为放电反应区(主反应器)和催化反应区(辅助反应器)2 个区域。在辅助反应器内加入2 片CFHC 催化剂或0.04 g LDH 粉末后注入200 mL 10 mg/L 的DUR 溶液,打开气泵和水泵,待溶液流经整个反应体系后调节电压至16 kV,放电功率为3.06~4.02 W。间隔时间取样1.5 mL 过0.22 μm 水系滤膜后于4 ℃冰箱内保存待测。DBDP 空白催化降解实验在不加入CFHC 的条件下与DBDP/CFHC 催化降解实验步骤完全相同。

图1 同轴圆筒形DBDP反应器示意图Fig.1 Schematic diagram of coaxial cylindrical DBDP reactor
1.4 分析方法
实验中收集的样品用高效液相色谱设备检测,使用C18-P色谱柱(5 μm,4.6×150 mm)和检测波长为254 nm的紫外检测器。DUR去除效率计算如关系式(1)所示:
式中,ρ0是初始反应液中DUR的质量浓度(mg/L),ρt是降解反应时间t(min)时间后DUR的质量浓度(mg/L)。
反应遵循拟一级动力学模型,反应速率计算如关系式(2)所示:
式中,ρ0是初始反应液中DUR 的质量浓度(mg/L),ρt是降解反应时间t(min)时间后DUR 的质量浓度(mg/L),k是拟一级反应速率常数(min-1)。
2 结果与讨论
2.1 CFHC的一步水热法制备
为了得到具有高催化活性的DBDP催化剂,实验对LDH的元素配比和水热制备条件进行了优化,以确保负载在CuF 表面后得到的复合材料可以在DBDP 中稳定催化。如图2A 和2B 所示,加入LDH 后的DBDP/LDH 体系对DUR 的去除效率要高于空白的DBDP 体系,说明LDH 对DBDP 有催化作用。针对不同摩尔比(n(钴盐)∶n(铁盐)=2∶1~4∶1)的LDH分析,当Co盐和Fe盐的投加摩尔比从2∶1上升到3∶1时,DBDP/LDH 体系对DUR 的去除率由86.20%上升至93.63%,进一步提升Co 盐和Fe 盐的投加摩尔比至4∶1时催化效率明显下降,这可能是由于Fe含量过低,不能有效地形成双金属间的电子传递。降解速率常数使用拟一级动力学拟合(R2>0.99),投加n(Co)∶n(Fe)=3∶1的LDH 催化剂,相较于空白DBDP 体系拟一级速率常数由0.0684 min-1提升至0.1080 min-1(图2B)。测试结果与其它研究类似,在LDH 的研究中发现金属元素的摩尔比在3∶1左右时催化效果最佳[14]。

图2 金属元素摩尔比对LDH 催化DBDP 性能影响,DUR 的去除率(A)和拟一级反应动力学曲线(B);制备条件对LDH催化DBDP性能影响,DUR的去除率(C)和降解速率常数(D)Fig. 2 The effects of element molar ratio on the performance of LDH catalyzed DBDP,removal efficiency (A) and pseudo first-order reaction kinetis plots (B) of DUR;The effects of synthesis conditions on the performance of LDH catalyzed DBDP,removal efficiency (C) and degradation rate constant (D) of DUR
水热法制备LDH 过程中的温度、时间以及尿素投加量等制备条件均可能会影响催化剂的催化性能,实验设计了正交实验以评估各个因素对LDH 催化性能的影响,实验设计正交表如表1 所示,不同条件制备的LDH 催化DBDP 降解DUR 的去除率及降解速率常数见图2C 和2D,改变水热条件可以显著提升LDH 的催化能力。一般来说,水热温度越高晶体生长速度越快,水热时间越久晶体生长越成熟,而充足的尿素可以在高温高压下水解为体系提供碱度和。然而,水热时间和加热温度与能耗密切相关,在晶体生长成熟的条件下,应选择合适的时间和温度。当反应温度为120 ℃,反应时间为18 h,投加尿素的物质的量为铁盐的10 倍时,得到的LDH 具有最优的DBDP 催化性能,其催化DBDP 降解DUR 的降解率和降解速率常数分别达到了96.54%和0.1354 min-1。进一步采用如公式(3)所示的极差分析法对三水平三因素的水热制备条件分析,计算结果如表2 所示,发现它们对催化性能的影响为R水热时间(0.0267 min-1)>R水热温度(0.0168 min-1)>R尿素投加量(0.0111 min-1),水热时间过长或温度过高可能会使晶体在生长过程中团聚而降低活性位点暴露量,不足则会令晶体生长不完全。而尿素投加量过低会导致提供的碱度不足以生成LDH,过高又会争夺Co离子形成更多的CoCO3。通过条件优化实验得到了LDH的最优制备条件:n(尿素)∶n(Co)∶n(Fe)=10∶3∶1,水热温度120 ℃,时间18 h。并在此条件下制备由CuF 作为载体的CFHC 催化剂,由于泡沫金属优异的耐热耐压性能,因此水热环境对其理化性质不会产生过度的影响。

表1 CoFe-LDH的制备条件Table 1 The synthesis conditions of CoFe-LDH

表2 LDH催化DBDP降解DUR的合成条件影响因素比较Table 2 Comparison of synthesis conditions effect on LDH catalysis DBDP in DUR degradation
式中,Rj为实验因素下实验指标的变化幅度(j=温度、时间或尿素铁盐的投加摩尔比,min-1),Ki为实验水平下的实验指标(i=100/120/140 ℃、12/18/24 h或(5∶1)/(10∶1)/(15∶1)的摩尔比,min-1),Max为该实验因素下的实验指标最大值,Min为最小值。
如图3所示,为了验证适宜的合成条件会影响LDH的微观结构进而影响催化性能,对不同条件下合成的LDHs系列材料做了SEM和XRD表征以明确其微观结构,深入探究水热条件对催化剂形貌的影响。过长的水热时间和过高的水热温度会使片层变厚(图3A),相反的条件会使晶体生长结构细碎(图3B)。而水热温度和尿素投加量过高,LDH生长过度使层状结构消失(图3C)也不利于催化的进行。过度延长水热时间加大尿素投量则会导致催化剂表面被CoCO3覆盖,片层变厚变大(图3D 和3H)。当水热合成条件适宜的情况下催化剂片层厚度均匀(图3E),因此该条件下制备的催化剂性能较优。图3F 中的碳酸钴颗粒团聚且纳米片破碎粘连,这可能是由于高水热温度加速了催化剂的生长。当水热时间较短且尿素投加量较低时,得到的LDH 材料片层薄且面积小(图3G)。低水热温度和尿素投加量下生长的LDH 材料(图3I),XRD 衍射峰较弱,相应的SEM 图像中LDH 片层细小破碎,晶体生长不完全。研究表明,适宜的水热时间、温度和尿素投加量是保证LDH 材料合成的基础,即在120 ℃、水热时间18 h、n(尿素)∶n(Co)∶n(Fe)=10∶3∶1条件下合成的CoFe-LDH材料具有较适宜催化DBDP的微观形貌。

图3 不同水热条件合成LDHs系列材料1-9的XRD谱图及SEM图像(内插图)(A-I)Fig. 3 XRD and SEM (inset) images of LDHs series materials 1-9 synthesized under different hydrothermal conditions (A-I)
2.2 CFHC的结构表征与分析
2.2.1 SEM图像及XRD谱图分析
CoFe-LDH和CFHC的微观形态和晶面衍射图如图4所示。CoFe-LDH由薄片堆叠而成,构成结构的主体(图4A),之间夹杂着尿素在高温高压下水解与Co元素形成的碳酸钴,将薄片粘连的薄片分离形成夹层(图4B)。LDH 的薄片厚度在100 nm 左右,宽度为2~5 μm,纳米片层有利于电子传递,还原态金属元素的电子从内部沿片层转移至材料表面吸附的氧化剂,并协助催化生成氧化能力更强的自由基。在微米尺度下可以清晰地发现CFHC保留了CuF的类海绵骨架,CuF的骨架枝条宽度约为100 μm(图4C),这为LDH提供了充足的生长空间。如图4D所示,大量LDH生长在CuF表面。将CFHC的表面进一步放大得到图4E,发现LDH 片垂直生长于CuF 表面,向外发散呈花苞状,发散的形态使LDH 薄片接触的表面积更广。同时,由于Cu 元素的掺杂,三元CoFe-LDH 的表面相对于二元LDH 更加光滑,片层也更薄,可以预见催化性能会进一步提升。如图4F 所示,Co、O、Fe 和C 元素均匀地沿CuF 骨架分布,印证了CoFe-LDH 成功负载在CuF 表面。Cu 元素并未被完全掩盖,说明Cu 参与到了表面LDH 的形成,SEM 和EDS-mapping结果证明了三元CFHC的形成。
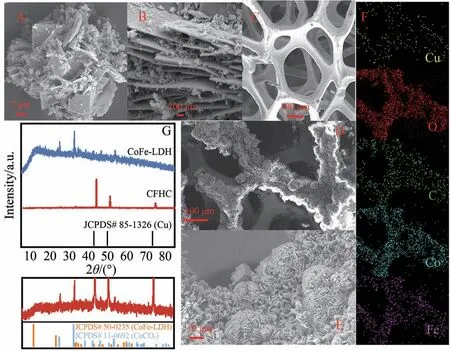
图4 CoFe-LDH(A、B)、CuF(C)和CFHC(D、E)的SEM图像;CFHC的EDS-mapping图(F);CoFe-LDH和CFHC的XRD图谱(G)Fig. 4 SEM images of CoFe-LDH (A,B),CuF(C) and CFHC (D,E);EDS-mapping diagram of CFHC(F);XRD patterns of CoFe-LDH and CFHC (G)
LDH 和CFHC 的XRD 谱图展示在图4G 中,CoCO3的晶面衍射峰(JCPDS# 11-0692,(104)、(012)和(116))和CoFe-LDH 的晶面衍射峰(JCPDS# 50-0235,(003)、(006))出现在CoFe-LDH 表面,说明采用水热法制备的CoFe-LDH 是以CoFe 为层板结构,为插层阴离子的LDH。然而,在CFHC 的衍射图谱中CoFe-LDH 的特征峰并不明显,这是由于Cu 的衍射峰(JCPDS# 85-1326,(111)、(200)和(220))过强导致CoFe-LDH 的衍射峰被掩盖。将图谱放大后可以在CFHC 的表面观察到CoFe-LDH 的弱衍射峰,说明CoFe-LDH被成功负载在CuF表面,这与SEM的结果互相印证。
2.2.2 XPS及TGA-MS分析
XPS可以展现催化剂的元素组成和价态分布,如图5所示,CoFe-LDH 和CFHC 的全谱图,O1s、Co2p、Fe2p和Cu2p的精细XPS图谱被展示在图5A-5E中。O1s在结合能532.9、531.1和529.3 eV处出现峰分别代表催化剂表面吸附水分子的—OH,吸附氧(记为OA,源自表面氧空位记为OV)和晶格氧(O2-,OL)[17-18]。结果说明,在CoFe-LDH 中大部分O 原子在结构中与周边金属原子成键,使得OL的摩尔分数高达71.85%。表面OV含量低使得催化剂表面电荷密度降低,不利于活性氧物种(ROS)的生成,因此需要通过调控增加催化剂表面OV的含量。将CoFe-LDH 负载在CuF 表面后,OA的含量增加至69.91%,有研究表明,还原态金属的引入可以增加OV的含量[18],这与我们的测试结果一致。Co2p在结合能780和796 eV附近的峰分别属于Co2p3/2和Co2p1/2,Co2p经过反卷积得到Co2+和Co3+的峰分别位于781.2和779.5 eV[19]。713.06和726.8 eV 附近的峰分别对应于Fe2p3/2和Fe2p1/2的结合能,Fe2+的峰位位于711.3 eV,Fe3+的峰位位于713.3 eV[20-21]。由于XPS测量深度在催化剂表面5~10 nm处,CFHC表面覆盖与粉末催化剂同条件生长的LDH。因此,在沿CuF骨架向外生长的LDH中,不同价态Co和Fe元素的相对摩尔分数与CoFe-LDH的元素及价态组成没有明显差异,Fe2+的摩尔分数约占61%,Co2+摩尔分数约占41%,丰富的低价还原态金属元素对DBDP 催化有积极作用。此外,由于CuF 的引入,CFHC 在结合能932.8 和934.3 eV 附近出现的反卷积峰属于还原性Cu0,+和氧化态Cu2+[22]。CFHC 中含有大量的Cu0,+为催化剂内部的价态循环和电子传递提供保证,可以预见CFHC具有优异的催化特性。

图5 CoFe-LDH 和CFHC 的XPS 谱图:全谱(A)、O1s(B)、Co2p(C)、Fe2p(D)和Cu2p(E);CoFe-LDH 的TGAMS曲线(F)Fig. 5 The XPS spectra of CoFe-LDH and CFHC:survey (A),O1s(B),Co2p (C),Fe2p (D) and Cu2p (E);TGA-MS curves of CoFe-LDH (F)
图5F是LDH材料的TGA-MS曲线图,100~300 ℃间微小的失重是LDH表面吸附的少量H2O,对催化剂结构并没有影响。300 ℃后,LDH开始发生相变,在结构上有较明显的转变,层板内的—OH和层间的以CO2和H2O的形式逸散,整个过程在温度上升至460 ℃左右结束,转化耗时16 min(升温速率10 ℃/min)。总体而言,LDH可以在300 ℃下保持稳定,同时热重-质谱测试也侧面证明了LDH的结构组成。
2.2.3 FT-IR、BET及电化学性质分析
CoFe-LDH 和CFHC 的官能团组成结构见图6A,3500 cm-1附近的吸收峰属于—OH 和表面残余尿素的N—H 震动伸缩峰,1450 cm-1附近的2 个吸收峰属于结构内和的碳氧伸缩振动。从FT-IR 分析,CoFe-LDH 和CFHC 的基础结构是由层板内—OH 层间构成的。FT-IR 图谱的差别主要位于波数较低的M—O 伸缩峰(<1000 cm-1),由于CuF 作为CFHC 的载体材料,CFHC 内有Cu—O 键,因此吸收峰(<1000 cm-1)要更丰富。
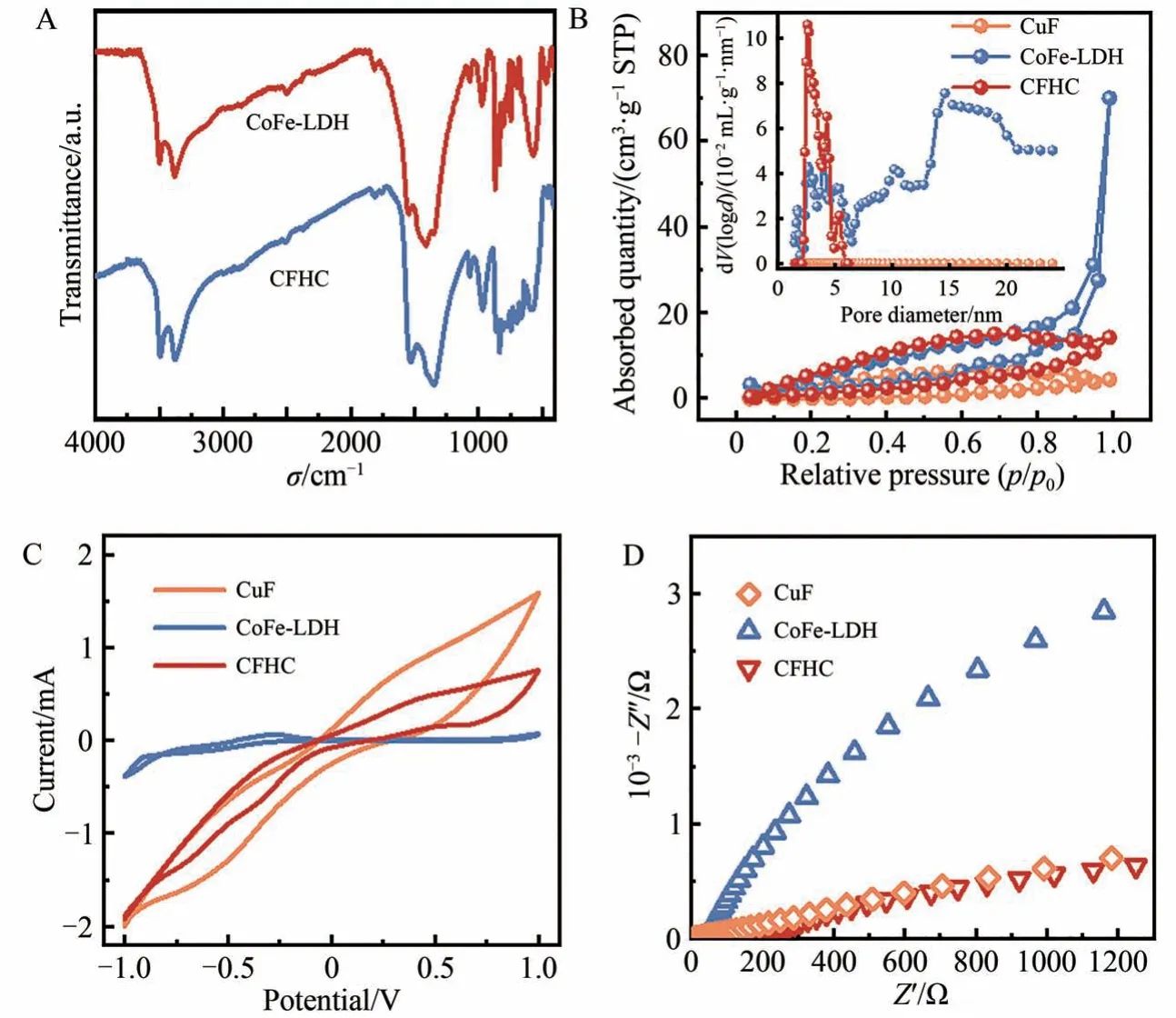
图6 CoFe-LDH 和CFHC 的FT-IR 谱图(A);CuF、CoFe-LDH 和CFHC 的N2-吸附脱附曲线及孔径分布图(内插)(B)、CV曲线(C)和EIS曲线(D)Fig. 6 FT-IR spectra of CoFe-LDH and CFHC(A);N2-adsorption desorption curves and pore-size distribution(inset) (B),CV curve (C) and EIS curves (D) of CuF,CoFe-LDH and CFHC
根据以往研究可知介孔结构对催化剂活性有积极影响[23],因此使用N2-吸附脱附测量催化剂的比表面积和介孔处孔径分布。如图6B所示,CoFe-LDH与CFHC的吸附曲线均属于IV类吸附曲线,平均孔径分别为3.02 和3.31 nm,证明催化剂具有介孔结构。然而,由SEM 可知,CuF 的孔径大于100 μm 且具有光滑的表面,因此其无法借助仪器进行介孔尺度的测量。CoFe-LDH 和CFHC 的比表面积分别为20.73和12.55 m2/g,负载后比表面积的下降可以归因于CuF疏松的海绵状泡沫金属结构限制了催化剂整体的比表面积,宏观面积更大的CuF载体更有利于催化剂和液体的分离。
电化学测试用以测量催化剂的电子传导能力,结果如图6C和6D 所示。CoFe-LDH 的电化学活性较低,电流强度低电化学阻抗高,因此催化过程可能受到电子传递能力的限制。铜作为优秀的导电材料其电流响应高电化学阻抗低,在与CoFe-LDH 复合后成功提升了复合材料的电化学活性。与CoFe-LDH 相比,CFHC 在电子传递性能上有了显著的提升,说明CuF 与CoFe-LDH 的结合有利于催化吸附在催化剂表面的氧化剂或直接将电子传递给水体中的有机污染物。
2.3 CFHC对DBDP体系的催化性能测试
将制备的催化性能最优的CoFe-LDH 负载在CuF 表面得到CFHC,将CFHC 应用于催化DBDP 降解DUR效率的结果如图7A和7B所示。在不使用任何催化剂的情况下,在25 min内DBDP对DUR的去除率和降解速率常数分别为78.38%和0.0684 min-1,CoFe-LDH 将这以效果进一步提升至96.54%和0.1354 min-1。当将催化剂替换为复合材料CFHC后,DBDP/CFHC体系只需要15 min就可以去除94.42%的DUR,在25 min时对DUR的去除率达到99.24%,降解速率常数提升至0.2175 min-1,分别是DBDP空白体系和DBDP/CoFe-LDH 体系的3.18和1.61倍。测试结果表明,CuF 和CoFe-LDH 的结合确实有利于催化性能的提升,说明丰富的氧空位,催化剂的元素丰富度和电化学活性对催化剂活性有积极影响。高效地催化DBDP中的氧化剂,短时间内产生大量活性物种是DUR在DBDP体系内降解速率提升的关键步骤。
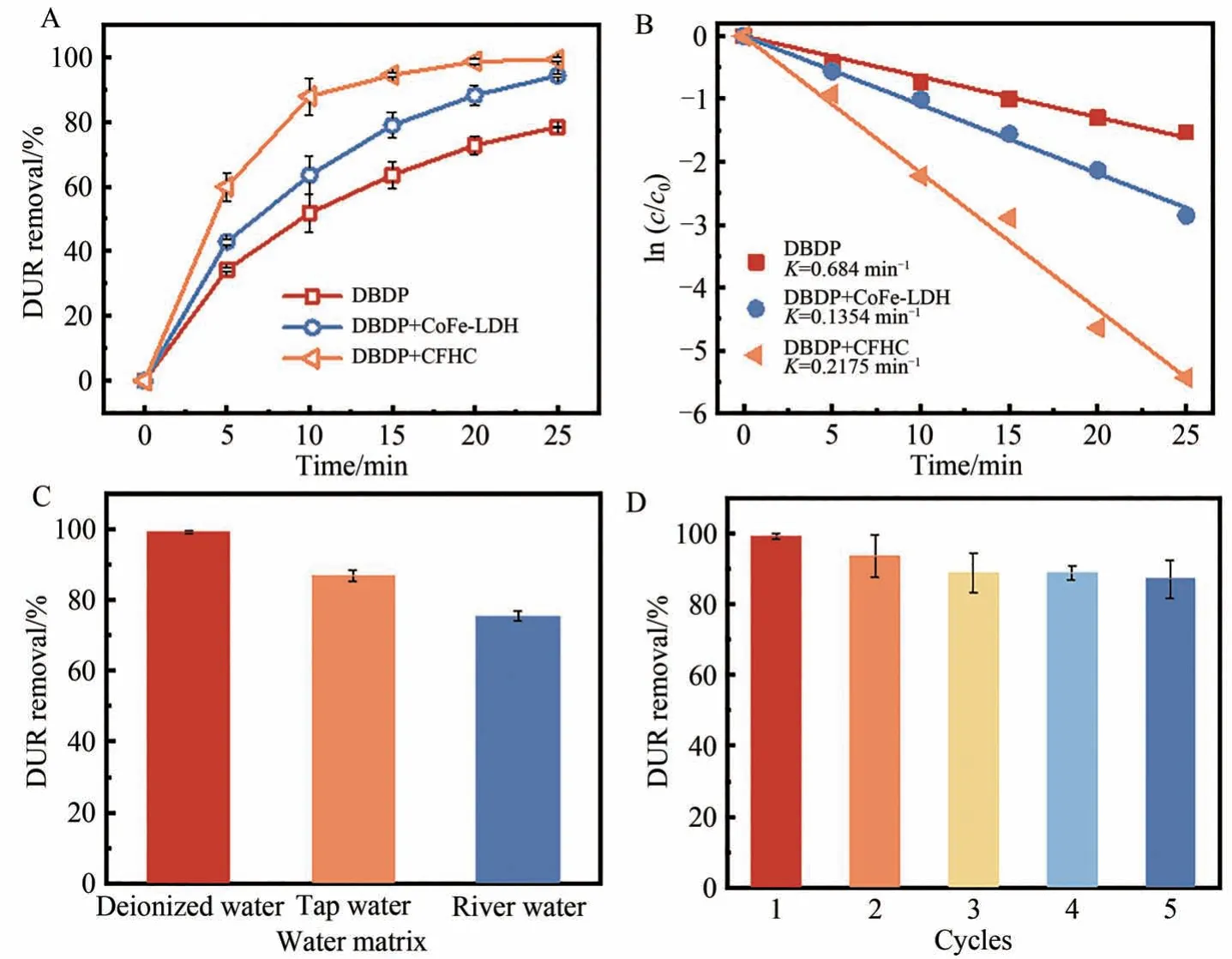
图7 CuF 载体对复合材料催化活性的影响,DUR 的去除率(A)和拟一级反应动力学曲线(B);水体基质对DBDP/CFHC的影响(C);重复利用对CFHC催化性能的影响(D)Fig. 7 Effect of CuF carrier on composites catalysis activity removal efficiency (A) and pseudo first-order reaction kinetics plots (B) of DUR;Water matrix effect on DBDP/CFHC (C);Recycle times effct on the CFHC catalysis performance(D)
体系在不同水质下对目标污染物的降解效率体现了其适用性,为了全面的评价CFHC 在自然水体下对DBDP 的催化性能,实验采用去离子水、自来水和松花江水为水体基质进行配水,结果如图7C 所示。由于上水管道的水中通常含有Cl-、和等无机阴离子,而这些阴离子会与DUR竞争活性自由基生成氧化性较低的Cl·、和等自由基,影响了体系的降解效率,因此在自来水中DBDP/CFHC对DUR 的去除率下降至86.85%[24]。江水是自然水体,除含有常见的共存阴离子外还含有包括腐殖酸和富里酸等天然有机质(NOM),这些大分子有机质中含有的芳香结构和富电子基团对活性自由基的吸引更强,因此在江水中体系对DUR 的降解率下降至75.50%。总的来说,虽然受到水体中不同共存物质的阻碍,DBDP/CFHC 体系仍可以保持去除DUR 的能力。重复利用实验用以评价CFHC 的稳定性,如图7D所示,初次使用的新鲜CFHC 催化DBDP 可在25 min 内降解99.20%的DUR,在连续使用5 次后,对DUR的去除率仍在87.00%以上,对比空白体系的78.40%,说明CFHC仍保有催化DBDP的能力。
2.4 CFHC对DBDP的催化机制探讨
相较于LDH,CFHC 表现出了更优异的催化活性,因此应当对催化剂在DBDP 体系内的作用机制进行分析研究。首先,明确DBDP 体系内可能存在的物质,如反应式(4)-(9)所示,在气液界面放电的过程中击穿电流会轰击背景分子而产生紫外光、和e-/·H[25]。之后采用淬灭实验以确定体系内的活性物种对降解DUR 的贡献度,使用FFA、IPA、p-BQ 和AgNO3作为1O2、·OH、和e-/·H 的淬灭剂。如图8A 所示,在DBDP 体系内活性物种对DUR 降解的贡献率为,而在DBDP/CFHC体系内活性物种对DUR降解的贡献率变化为,说明CFHC有诱导1O2生成的功能结构。
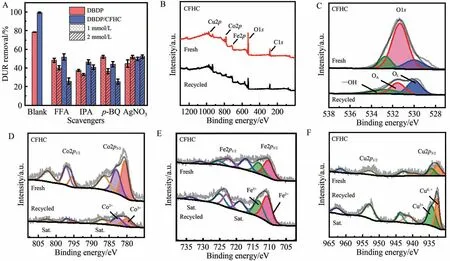
图8 捕获剂对DBDP和DBDP/CFHC体系降解DUR去除率的影响(A);使用前后CFHC的XPS图谱:总谱图(B)、O1s(C)、Co2p(D)、Fe2p(E)和Cu2p(F)Fig. 8 Effects of scavengers on DUR removal efficiency of DBDP and DBDP/CFHC system (A);XPS spectra of fresh and recycled CFHC:survey spectra (B),O1s (C),Co2p (D),Fe2p (E) and Cu2p (F)
为了深入探究CFHC 的作用机制,使用XPS 分析了CFHC 在使用前后的价态变化,以明晰催化剂中各元素在催化过程中的电子转移路径。如图8B-8F 所示,使用过的CFCH 在回收后元素组成没有明显变化,但是价态组成在催化DBDP 后有以下差异:1) OA(OV)摩尔分数由69.91%下降至34.39%;2) Co2+和Fe2+的摩尔分数有少量上升;3) Cu0,+摩尔分数由61.04%下降至55.18%。OV的摩尔分数显著下降是由于其不仅参与了活性氧的生成还用以维持催化剂表面整体的价态平衡,由于还原态低价金属元素的消耗,部分Ov向OL转化令催化剂保持稳定。其次是Cu0,+含量的大幅下降,3种金属元素氧化还原电势分别为E0(Cu2+/Cu+)=0.17 V(vs.NHE)<E0(Fe3+/Fe2+)=0.77 V(vs. NHE)<E0(Co3+/Co2+)=1.81 V(vs. NHE)。因此,还原态Cu0,+在如反应式(10)和(11)催化DBDP 的同时也辅助还原因催化反应消耗的Fe2+和Co2+(反应式(12)-(14))[27-29],仅依靠反应式(15)的反应是不足以补充Fe2+的消耗使催化反应持续进行的。因此,Co2+和Fe2+元素含量的少量上升是由于Cu0,+补充了铁钴在催化过程中的消耗。此外,如反应式(10)所示,Cu+对的生成有促进作用,根据反应式(16),会进一步转化为1O2,CFHC的加入调整了DBDP活性物种的贡献度,使以半衰期短的·OH为主导的氧化体系向以和1O2为主导的氧化体系转化[30]。根据淬灭实验和XPS测试可知,CuF不仅在宏观结构上有利于催化剂的固液分离,更在微观结构上加强了电子传递,在降解机理上促进了和1O2的形成。
综上所述,CFHC 催化DBDP 降解DUR 的机理可以由图9 概括。1)DBDP 在放电过程产生的击穿电流和紫外光等促进体系内H2O2和O3的生成,一部分在放电的作用下转化为·OH和,并随着活性物种的转化生成1O2等,形成以·OH 为主导的氧化体系降解DUR;2)部分H2O2、O3和溶解O2扩散到CFHC 表面,在金属离子和OV之间的电子转移作用下催化生成多种活性自由基,特别是由于Cu0,+的调控,体系中的活性物种向以和1O2为主导的氧化体系转化,以在水中半衰期更长利用率更高的1O2为主导的DBDP/CFHC 体系对DUR 的去除速率常数更高;3)CFHC 的内部在催化过程中不断消耗的还原态金属元素(Fe2+和Co2+)由载体Cu 通过电子传递予以再生维持催化活性,同时结构内的Ov向OL转化以维持催化剂整体的电荷平衡并促进活性氧的生成。
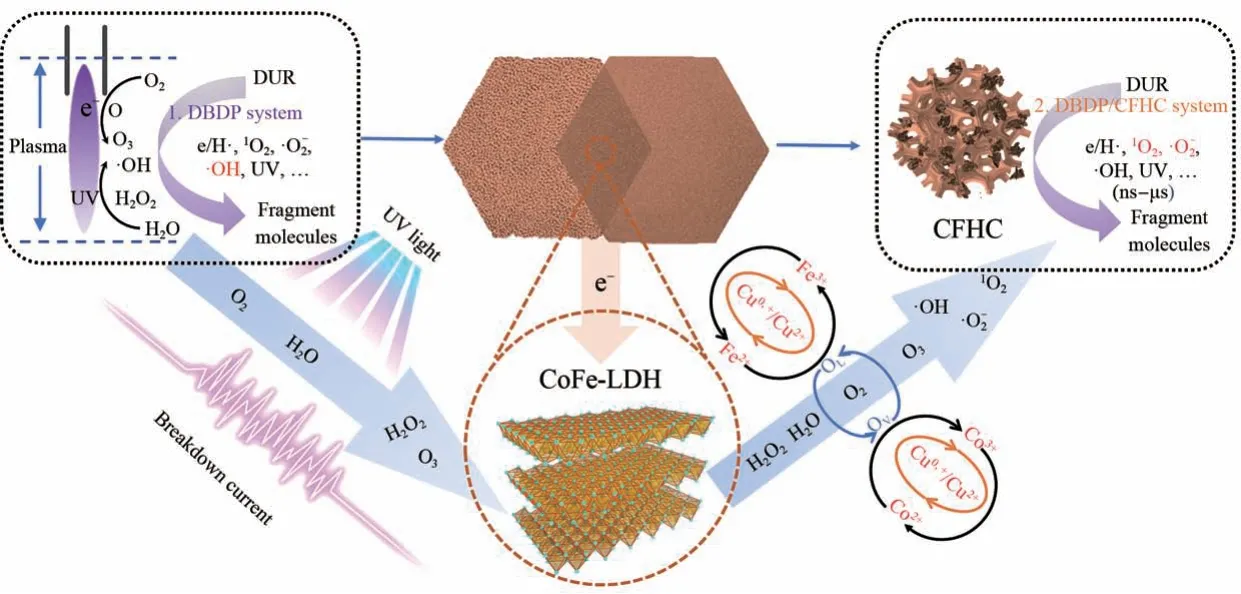
图9 DBDP/CFHC体系催化机理图Fig.9 The schematic diagram of catalysis mechanism over DBDP/CFHC system
3 结 论
DBDP 体系内同时具有多种活性物种共同作用,具有氧化性强、反应速率快和降解应用范围广等优势,在环境污染物去除领域具有发展潜力。本工作在保持DBDP 优势的基础上,通过开发新型催化剂强化提升了DBDP 体系内活性物种的利用率,提高污染物去除速率。采用一步水热法成功制备了CoFe-LDH 并优化其制备条件,通过调节元素比例和水热时间发现在n(尿素)∶n(Co)∶n(Fe)=10∶3∶1,水热温度为120 ℃,水热时间为18 h 条件下,制备的CoFe-LDH 催化性能最优,并将其负载在CuF 表面,成功构建了CoFe-LDH/CuF 三元LDH 片状催化剂。以DUR 作为目标污染物测试其催化性能,证明催化剂的科学设计及应用可以提升DBDP 体系降解性能,CuF 的引入极大地增强了催化剂表面OV含量和电子转移能力,15 min 内DBDP/CFHC 对DUR 的去除率高达94.42%,在25 min 时提升至99.24%,降解速率常数是单独DBDP 体系的3.18 倍。在此基础上探究催化剂的作用机制,元素价态分析结果显示CuF 作为载体增加了还原态Cu0,+的含量,在催化过程中通过电子转移增加了催化剂的可持续性。化学淬灭实验证实,CFHC 调整了DBDP 体系内优势活性物种,由高氧化性短半衰期的·OH 转化为利用率高的非自由基1O2。这项工作为催化剂的制备开发和科学调控提供了一种新的研究思路。

