酿酒专用小麦大曲中挥发性风味成分与微生物群落相关性分析
王 洋,谢 菲*,杜礼泉,范昌明,冯 波
(四川省绵阳市丰谷酒业有限责任公司,四川 绵阳 621000)
大曲是以小麦为主要原料,通过自然网罗环境中的微生物和控制生产工艺条件生产的微生态制品[1],其中含有丰富的代谢酶和微生物类群,具有糖化、发酵、生香等功能[2]。在白酒行业一直有着“曲为酒之骨”、“好曲酿好酒”、“曲定酒型”等说法[3],这充分说明了大曲在白酒酿造中扮演的重要角色,是酿酒发酵的原动力。大曲生产过程中本身产生的香气成分,它们可以直接进入酒体中,成为酒体中香气物质的直接来源,也可作为酒中香气物质的重要前驱物来源[4]。
固相微萃取(solid phase microextraction,SPME)法具有样品用量少、无需有机溶剂、操作简便、成本较低、灵敏度和准确度高等特点,能对微量的挥发性成分进行高效检测,克服了传统前处理方法的缺点,因而广泛应用于环境、食品、医药等方面。崔新莹等[5]利用固相微萃取结合气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用法对中高温大曲中香气成分进行检测,并基于主成分分析法(principal component analysis,PCA)构建中高温大曲香气品质评价模型等。赵东等[6]采用顶空固相微萃取结合气相色谱-质谱法测定大曲中的挥发性成分,由此揭开了大曲复杂香气成分的神秘面纱。随着检测技术的发展和萃取条件优化,固相微萃取技术在大曲中的运用越来越成熟。孟维一等[7]考察了萃取头、萃取时间、萃取温度和样品量对大曲样品中挥发性成分分析的影响,采用顶空(headspace,HS)-固相微萃取(SPME)结合气相色谱-嗅闻-质谱(gas chromatography-olfactometry-mass spectrometry,GC-O-MS)联用技术检出17种为香气化合物,定性出14种化合物,其中2-乙基-3,5-二甲基吡嗪、苯乙醛是香气活性值(ordor activity value,OAV)较大且香气强度较大的香气活性化合物,贡献了烤土豆香、蜂蜜香、甜香,综合组成了大曲独特的风味。而大曲中的一系列代谢物质与微生物群落具有密不可分的关系,故研究大曲中的微生物菌群多样性就显得极为重要。
随着大曲制备工艺的不断优化调整,制曲原料的选用已然成为影响大曲质量的关键环节。朱和琴等[8]研究了“宜麦”7号小麦(蛋白质和淀粉含量较高)和普通小麦分别制作偏高温大曲,结果表明“宜麦”7号可明显提高曲质和酒质。刘宇等[2]研究发现,使用软质小麦制作兰陵浓香大曲在感官质量和理化指标上均优于硬质小麦制曲。酿酒专用小麦为软质小麦,具有硬度低、淀粉和蛋白质含量较高、籽粒饱满、质地均匀等品质特征,使用酿酒专用小麦制曲,能明显提高曲质等级,同时经过模拟发酵后,酒质得到显著提升[9]。然而目前关于使用不同品种的小麦制曲对风味的影响研究极少,大曲是重要的酿酒生香剂,因此研究不同品种原料所制成品曲中的挥发性成分差异具有一定参考意义。本研究以普通小麦大曲为对照,分别采用顶空固相微萃取和高通量测序技术分析酿酒专用小麦大曲的挥发性成分和微生物群落组成,并基于多元统计分析方法探讨二者相关性,从微生物角度分析其挥发性成分差异来源,旨在为制定大曲质量评价标准提供理论支撑,为白酒行业的高质量发展蓄势赋能。
1 材料与方法
1.1 材料与试剂
酿酒专用小麦:丰谷酒业酿酒原粮种植示范基地;普通小麦:市售;酿酒专用小麦大曲、普通小麦大曲:四川省绵阳市丰谷酒业有限责任公司;2-辛醇标准品(色谱纯):上海阿拉丁生化科技股份有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国Omega BioTek公司;rTaqDNA聚合酶试剂盒、DNA Marker:北京全市金生物技术有限公司。
1.2 仪器与设备
8890-5977B气相色谱-质谱联用仪:安捷伦科技(中国)有限公司;57330-U手动SPME进样器、50/30 μm DVB/CAR/PDMS固相微萃取头、15 mL专用采样瓶:美国Supelco公司;SG-5405B-I数显恒温多头磁力搅拌器:上海硕光电子科技有限公司;BX3200HP超声波清洗仪:上海新苗医疗机械制造有限公司;Gene AmpR 9700型聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国ABI公司;DYY-8C型电泳仪:北京六一仪器厂;JS-6800C凝胶成像仪:上海培清科技有限公司。
1.3 方法
1.3.1 酿酒专用小麦大曲和普通小麦大曲的制备
两种小麦均按照常规中温曲生产流程制曲,生产过程中保持场地环境、工艺参数与操作培养条件基本一致,并在同一曲房贮存,取同一时间出库成品曲进行检测分析。
1.3.2 挥发性风味成分的检测
挥发性风味成分的检测采用HS-SPME-GC-MS法。
前处理:取样品2.0 g于15 mL采样瓶中,加入10 μL 2-辛醇溶液(终质量浓度为8.2 mg/L)后密封,在60 ℃下超声15 min,随后在60 ℃水浴下吸附30 min,最后于250 ℃下解吸5 min。样品均做3次平行,酿酒专用小麦大曲和普通小麦大曲的对应编号分别为SY1、SY2、SY3和CK1、CK2、CK3。
气相色谱条件:CP-WAX57CB色谱柱(50 m×0.25 mm×0.20 μm),进样口温度250 ℃,不分流进样,载气为高纯氦气(He)(99.999%),流速为1 mL/min。升温程序:40 ℃保持3 min,以4 ℃/min升温至150 ℃,保持2 min,再以7 ℃/min升温至220 ℃,保持5 min。
质谱条件:电离方式电子电离为电子电离(electronic ionization,EI)源,离子源温度230 ℃,四级杆温度150 ℃,接口温度250 ℃,质量扫描范围20~500 m/z。
定性定量分析:将未知挥发性成分所提取的质谱图与美国国家标准技术研究所(national institute of standards and technology,NIST)20.0标准谱库比对鉴定,对匹配因子>80的结果进行报道。以2-辛醇作为内标物,先计算出待测物峰面积与内标物峰面积的相对比值,再根据已知的内标物浓度换算出挥发性成分的含量。
1.3.3 微生物群落的检测
微生物群落的检测采用高通量测序技术。微生物检测委托上海派森诺生物科技有限公司完成,包括微生物DNA提取、聚合酶链式反应(PCR)扩增、纯化以及测序,其中大曲总基因组DNA的提取参考谢菲等[10]的方法。细菌序列扩增引物:F:5'-ACTCCTACGGGAGGCAGCA-3';R:5'-GGACTACHVGGGTWTCTAAT-3';测序区域:16S_V3~V4;数据库:Silva_132;主要方法:dada2。真菌序列扩增引物F:5'-GGAAGTAAAAGTCGTAACAAGG-3';R:5'-GCTGCGTTCTTCATCGATGC-3';测序区域:ITS_V1;数据库:Unite_8;主要方法:dada2。
1.3.4 数据处理
利用SIMCA 14.0软件进行主成分分析(PCA)、偏最小二乘-判别分析(partial least squares-discriminant analysis,PLS-DA),利用派森诺云平台(https://www.genescloud.cn/home)完成群落多样性分析,数据结果以“平均值±标准差”表示,用SPSS 20.0进行显著性分析和Spearman相关性系数计算,使用OriginPro 2018C软件进行绘图。
2 结果与分析
2.1 大曲挥发性风味成分分析
2.1.1 两种大曲挥发性风味成分分析
酿酒专用小麦大曲(SY)和普通小麦大曲(CK)挥发性风味成分HS-SPME-GC-MS检测结果见表1。由表1可知,在两组大曲中共鉴定出125种挥发性成分,其中SY组和CK组分别鉴定出108种和105种成分,共有88种成分在两组大曲中均有检出。两组大曲差异性成分分别有20种和17种,SY组独有成分(20种)含量由高到低为:2,6-二甲基壬烷、3-甲基己醛、正癸醛、3-甲基-3-丁烯-1-醇、3-甲基-2(5H)-呋喃酮、2,5-二甲基四氢呋喃、五甲基乙醇、2-苯基-1-丙醇、二甲基乙酰胺、2(5H)-呋喃酮、乙酸苯乙酯、DELTA-杜松烯、乙二醇、马兜铃烯、5-甲基糠醛、芳樟醇、1-异氰基-3-甲苯、N-甲基-2-吡咯甲醛、2,2,6-三甲基-1,4-环己二酮、3-苯基吡啶。CK组独有成分(17种)含量由高到低为:3-羟基-2-丁酮、3-丁烯基异硫氰酸酯、2-庚酮、异辛醇、异丁醇、2,6-二乙基吡嗪、丙酮酰胺、反式-2-辛烯-1-醇、环庚-4-烯醇、亚麻酸、1,2-己二醇、γ-壬内酯、3-甲基吡咯、1-苯基-2-丙醇、3,4-二甲氧基苯乙烯、2-吡啶甲醇、邻苯三酚三甲醚。

表1 两种大曲样品中挥发性风味成分含量GC-MS分析结果Table 1 Results of volatile flavor compounds contents in two kinds of Daqu samples analysis by GC-MS
酿酒专用小麦大曲(SY)和普通小麦大曲(CK)各挥发性风味成分类别见图1。由图1a可知,SY组各挥发性风味成分类别含量高低顺序为:醇类>吡嗪类>醛类>酸类>酮类,而CK组各挥发性风味成分类别含量高低顺序为:吡嗪类>醇类>酸类>酮类>醛类,且两组大曲在这几类化合物总含量上存在显著性差异(P<0.05)。两组大曲含量较高的均为四甲基吡嗪,SY组和CK组中含量分别为(533.53±43.83)ng/g和(869.45±104.25)ng/g,占各自样品总含量的14.40%和21.93%。四甲基吡嗪香气特征为烘烤香、甜香,可增强大曲的生香效果,在浓香型、酱香型、芝麻香型白酒中含量较高,是白酒中的重要香气成分[11]。徐岩等[12]对中国白酒中四甲基吡嗪的来源进行深入研究,并证实其主要产生途径为大曲中的枯草芽孢杆菌代谢反应,两种大曲该物质差异显著,可能与芽孢杆菌富集量有关。由图1b可知,SY组中的醛类、萜烯类、脂肪烃类、呋喃类以及其他含氮物类等的化合物数量要高于CK组。综合表1和图1的分析结果来看,酿酒专用小麦和普通小麦所制大曲在风味物质的种类和含量上有差异。

图1 两种大曲样品中挥发性风味成分的含量(a)及种类(b)比较Fig.1 Comparison of volatile flavor components types and contents in two kinds of Daqu samples
2.1.2 挥发性风味成分主成分分析
利用SIMCA 14.0统计学软件对两种大曲检测出的125种挥发性风味化合物进行PCA,模型的特征值和方差贡献率见表2。特征值为相应的主成分系数,数值大小代表主成分影响力的高低,一般选择主成分特征值>1且累计方差贡献率在80%以上的主成分进行分析[13],故提取前两个主成分作为可视化分析。

表2 主成分的特征值及方差贡献率Table 2 Eigenvalues and variance contribution rates of principal components
由表2可知,第1主成分方差贡献率为76.32%,第2主成分方差贡献率为12.54%,累计方差贡献率为88.86%,说明前两个主成分可以解释样本挥发性成分的绝大部分信息。
两种大曲PCA得分图见图2。由图2可知,两组样品分别处于椭圆区域的两侧,各组的平行样品较为邻近,代表平行样品间含量相差较小。横坐标间的距离反应两个样品间的差异大小,可以看出SY组和CK组在挥发性成分种类或含量上有显著差异。因此,通过主成分分析,能够有效区分酿酒专用小麦和普通小麦所制大曲的样品。
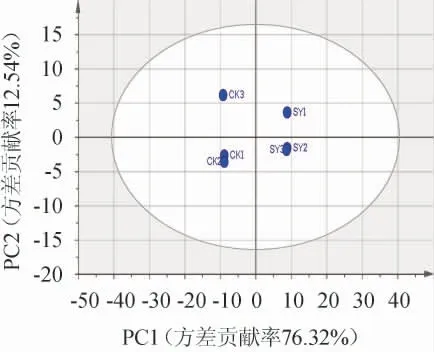
图2 两种大曲样品中的挥发性风味成分主成分分析得分图Fig.2 Score plot of principal component analysis of volatile flavor components in two kinds of Daqu samples
2.1.3 挥发性风味成分偏最小二乘法-判别分析
为了深入挖掘两种大曲之间挥发性风味成分的差异,在PCA模型基础上,采用偏最小二乘法-判别分析(PLS-DA)对两种大曲挥发性风味成分进行分析,结果见图3。由图3可知,两组大曲所采集数据呈现良好的区分效果(X轴方向上对变量的解释能力(R2X)=0.881>0.5,Y轴方向上对变量的解释能力(R2Y)=1.000和模型的预测能力(Q2)=0.998>0.5),所建模型提取的两个主成分累计方差贡献率为88.1%,可以有效解释样本整体信息,其结果与PCA结果相近,都对两种大曲样品进行有效的鉴别和区分。此外,为了更大程度区分两种大曲之间的差异,PLS-DA在模型拟合过程中指定了样本的分组,往往会出现过拟合的情况。为检验模型可靠性,利用200次的置换检验,以评估所建模型是否存在过度拟合,结果见图4。

图3 两种大曲样品中挥发性风味成分偏最小二乘法-判别分析Fig.3 Partial least squares-discriminant analysis of volatile flavor components in two kinds of Daqu samples

图4 偏最小二乘法-判别分析模型200次交叉检验验证结果Fig.4 Cross-validation results of partial least squares-discriminant analysis with 200 permutation tests
由图4可知,所有左边的Q2和R2模拟值均比对应最右边的原始值低,且Q2回归线截距为-0.027 1<0,说明该模型未有过拟合现象,模型稳定可靠,具有统计学意义。
VIP值是PLS-DA模型变量的权重值,用以衡量各组分积累差异对各组样本分类判别的影响强度和解释能力,其值越大,贡献率越大,一般以VIP值>1作为差异性成分筛选界限。两种大曲挥发性风味成分韦恩图见图5。由图5可知,总共选出86种差异风味成分(VIP值>1),其中49种为共有差异性风味成分,37种为两种大曲各自的特有差异性风味成分。为了更直观展示两种大曲挥发性成分含量差异,对上述49种差异性风味成分进行聚类分析,结果见图6。由图6可知,图A区域是CK组中相对于SY组含量较突出的挥发性成分,共计20种。B区域则是SY组大曲中相对含量较高的差异性风味成分,包含29种。结果表明,CK组差异性风味成分主要是吡嗪类,而SY组差异性风味成分主要为醇醛类。总体上讲,SY组的挥发性风味成分较CK组丰富。冯雨[14]研究表明,硬质小麦中的晶状淀粉不易被微生物所利用,且原料携带的微生物数量远不及软质小麦,最终导致成品大曲中的微生物代谢产物存在显著差异。由此可见,制曲原料的品种对大曲质量有着重要影响。

图5 两种大曲样品挥发性风味成分韦恩图Fig.5 Venn diagram of volatile flavor components of two kinds of Daqu samples
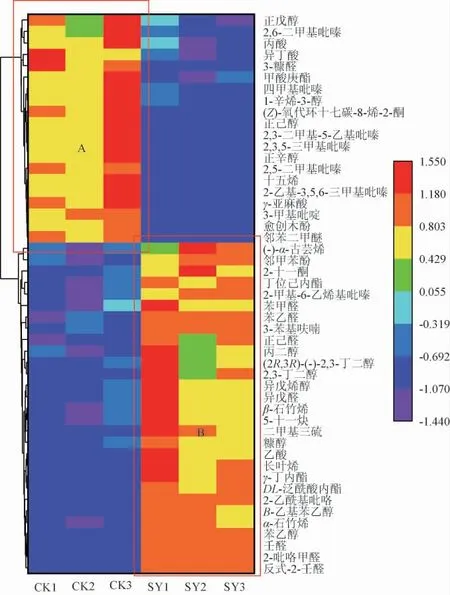
图6 两种大曲差异风味成分聚类分析热图Fig.6 Heat map of clustering analysis of difference flavor components of two kinds of Daqu samples
2.2 大曲微生物群落多样性分析
2.2.1 测序有效性分析
稀释性曲线能够直观反映操作分类单元(operational taxonomic unit,OTU)数随测序深度变化情况[15],OTU是在系统发生学或群体遗传学研究中,为便于分析,通过归类操作,将序列相似性在97%以上的水平归为同一OTU[16]。由图7可知,两种大曲的细菌和真菌菌群稀释性曲线变化趋势相近。随着测序深度的增加,所得到的OTU数先急剧上升而后趋于平缓,往后随着测序深度增加,新发现OTU数波动范围小,对各自微生物群落多样性分析影响不大,因此本实验所测深度足以满足后续分析。从图7亦可知,细菌文库内SY组OTU数目要高于CK组,而真菌文库结果与之相反。
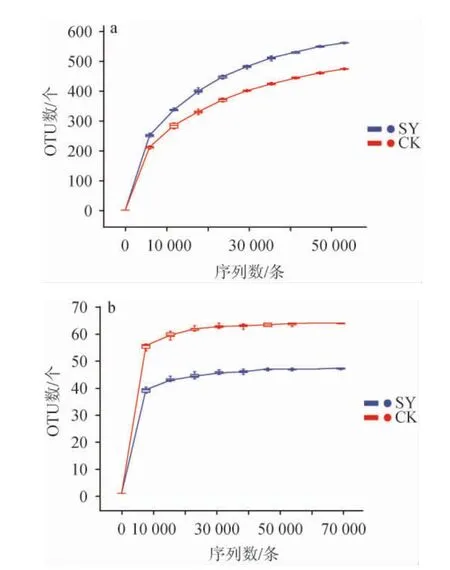
图7 两种大曲样品细菌(a)和真菌(b)群落稀释性曲线Fig.7 Rarefaction curves of bacterial (a) and fungal (b) communities of two kinds of Daqu samples
2.2.2 Alpha多样性分析
多样性指数可反映样品中微生物群落的丰富度和多样性。其中Chao1指数常用以估计物种总数,Chao1指数越大,表明微生物群落的丰富度越高,Shannon指数、Simpson指数用以反映样品微生物群落多样性[17],微生物群落多样性越高,物种分布越均匀,Shannon指数和Simpson指数越大[18]。两种大曲的细菌和真菌多样性指数结果见表3。由表3可知,SY组真菌的丰富度不及CK组,但其细菌群落多样性显著高于CK组。所测样品覆盖率指数均>0.99,表明测序结果可信度高,能有效反映样品中的微生物情况。

表3 两种大曲样品微生物Alpha多样性指数Table 3 Alpha diversity indexes of microorganis in two kinds of Daqu samples
2.2.3 Beta多样性分析
主坐标分析(principal coordinate analysis,PCoA)是一种非约束排序方法,可用以衡量样本之间的相似性和差异性[15]。基于OTU水平Bray Curtis距离的主坐标对各样品微生物群落结构相似度进行了评价,结果见图8。由图8可知,细菌和真菌群落结构两主坐标差异解释度累计方差贡献率分别为78.5%和84.9%(>50%),能可靠反映样品中绝大部分信息。两组大曲在PCoA1轴上相隔距离较远,说明微生物群落结构主要受主坐标PCoA1影响,SY组和CK组菌群组成具有显著差异。
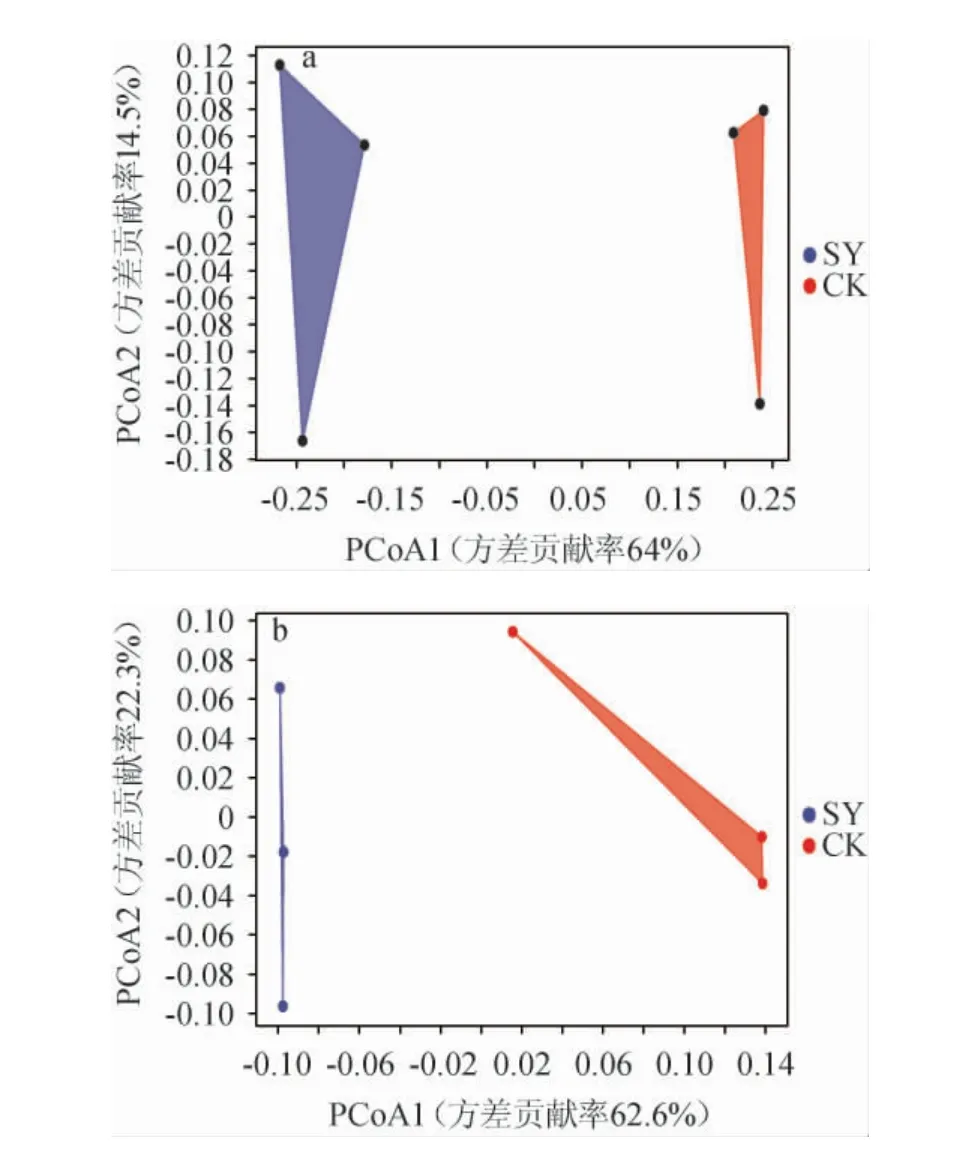
图8 两种大曲样品细菌(a)和真菌(b)群落基于Bray Curtis距离的主坐标分析Fig.8 Principal coordinate analysis (PCoA) of bacterial (a) and fungal (b) communities of two kinds of Daqu samples based on Bray Curtis distance
2.3 基于属水平微生物菌群组成分析
取相对丰度较高的前20个种属进行分析,其余种属相对丰度合并归为Others。两种大曲细菌群落构成见图9。
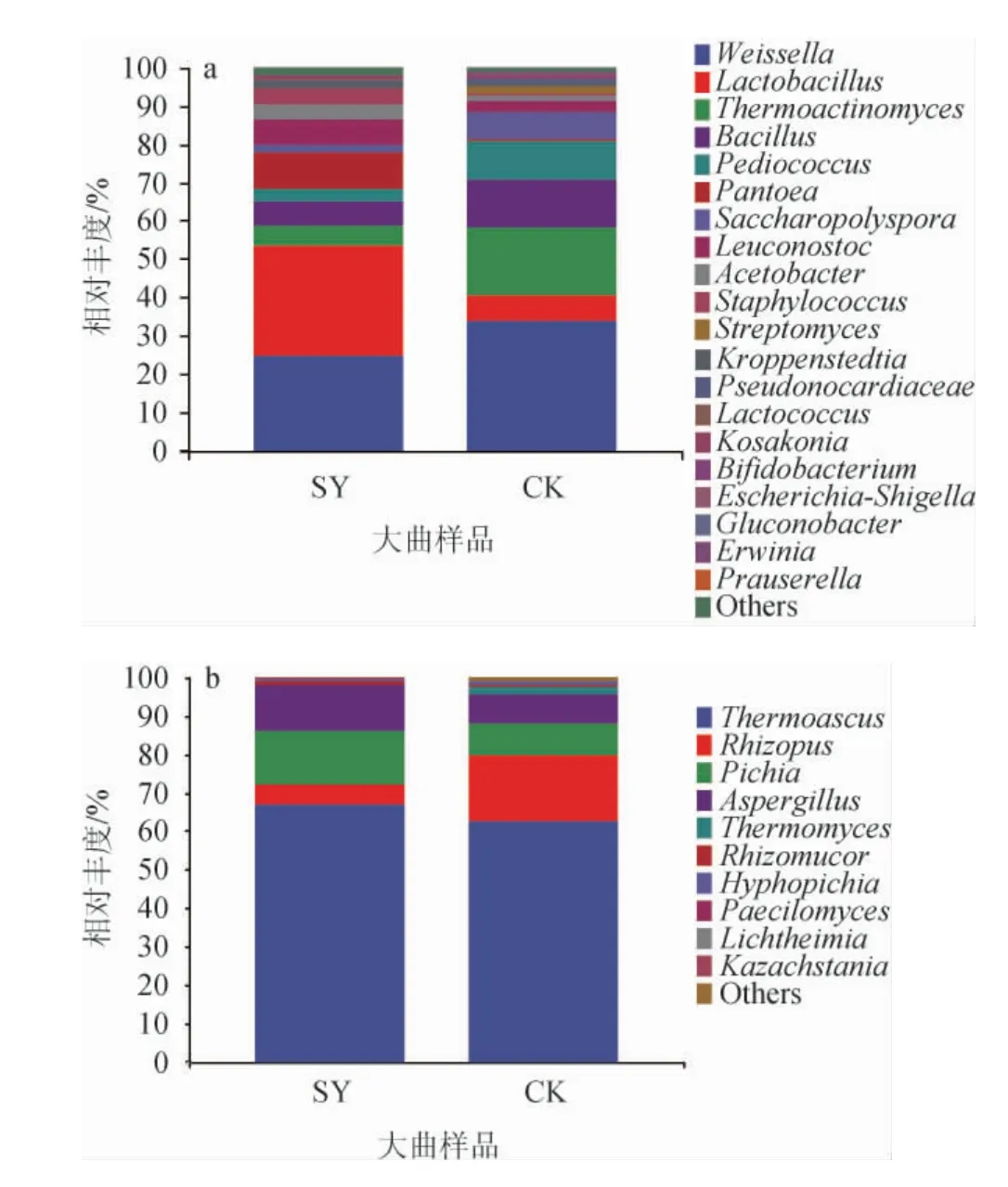
图9 基于属水平两种大曲样品细菌(a)和真菌(b)群落结构Fig.9 Community structure of bacteria (a) and fungi (b) of two kinds of Daqu samples based on genus level
由图9a可知,两种大曲中的优势菌属(平均相对丰度>1%)有魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)、高温放线菌属(Thermoactinomyces)、芽孢杆菌属(Bacillus)、片球菌属(Pediococcus)、泛菌属(Pantoea)、糖多孢菌属(Saccharopolyspora)、明串珠菌属(Leuconostoc)、醋杆菌属(Acetobacter)、葡萄球菌属(Staphylococcus)、链霉菌属(Streptomyces)、克罗彭斯特菌属(Kroppenstedtia)等。这与研究报道的川派浓香型大曲主要菌属结果相一致[19]。两种大曲细菌群落比较来看,其各自种属组成存在明显差异(P<0.05)。SY组的绝对优势菌属(占比10%以上)包含乳杆菌属和魏斯氏菌属,相对丰度分别为28.46%、24.83%;CK组的绝对优势菌属有魏斯氏菌属、高温放线菌属、芽孢杆菌属和片球菌属,相对丰度分别为33.87%、17.62%、12.23%和10.06%。乳杆菌属在两组大曲中占比差异最为显著(P<0.05),乳杆菌属在SY组样品中为第一优势菌属,而CK组中的乳杆菌属仅有6.88%。乳杆菌属存在于制曲生产的各个环节中[20],其差异来源可能是由于原料产地气候不同使得所携带的微生物种类数量不同,亦或是开放式的生产环境导致所网罗的微生物不同。高温放线菌属在CK组中占比较高,比SY组高出12.08%,为CK组的第二优势菌属,是一类能在恶劣环境下生长代谢的微生物,该菌属具有耐高温的特点,可在50 ℃以上环境生长繁殖[21],其常见于高温大曲中,近年来研究发现其在中高温大曲也占据不低的比例[22]。高温放线菌在CK组中有较高的丰度,可能是由于CK组制曲原料硬度高,脆性大,粉碎后的颗粒过多,使得压制的曲块较紧实[14],透气性较差,导致大曲升温发酵后期的曲心温度较高,因此CK组中的耐热菌分布高于SY组。芽孢杆菌属能够在极端环境下生长代谢,当制曲温度>55 ℃时,曲中细菌会以芽孢杆菌属和高温放线菌属为主要的微生物群[17]。该菌属能分泌多种水解酶,有助于提升大曲原料的利用率,同时还是大曲中吡嗪类化合物产生的主要菌属[23]。SY组中的芽孢杆菌属组成丰度较CK组低,因此两种大曲中吡嗪类化合物的含量有着显著差异(P<0.05),其与挥发性成分检测结果相符。泛菌属在SY组相对丰度较高,达9.27%,但在CK组中相对丰度仅为0.45%。研究发现,该菌属是制曲小麦内生菌中的主要种群[24],是一类重要的环境微生物,因此小麦原料生长环境的不同直接导致在成品曲中组成差异显著(P<0.05)。总体上来看,SY组的优势菌属与CK组比较,其菌群结构更丰富,组成更均衡。
由图9b可知,真菌群落的物种丰富度远不及细菌群落,这是因为大部分真菌的适宜生存温度在20~30 ℃,而培曲顶温高达50 ℃以上,因此在成品曲中真菌主要以耐热或嗜热真菌属为主。两种大曲中的优势菌属(平均相对丰度>1%)主要包括嗜热子囊菌属(Thermoascus)、根霉菌属(Rhizopus)、毕赤酵母属(Pichia)、曲霉菌属(Aspergillus)、嗜热真菌属(Thermomyces)、生丝毕赤酵母属(Hyphopichia)。这与杨阳等[25]研究产自河南的软质小麦制成的中温大曲中真菌优势菌群组成有一定相似。嗜热子囊菌属是两种大曲的第一优势真菌属,其在SY组和CK组中相对丰度分别为66.73%和62.51%(P>0.05)。嗜热子囊菌属是大曲中常见的耐热真菌,主要集中在具有较高温度的曲心中。值得注意的是,嗜热真菌属与嗜热子囊菌属同为嗜热真菌类,具有相似的生物特性,但嗜热真菌属在SY组和CK组中所占比例较低,相对丰度分别为0.06%和1.68%,具体原因有待进一步探究。两种大曲检测出的优势霉菌类主要为根霉菌属和曲霉菌属,根霉菌属和曲霉菌属在SY组(5.36%、12.11%)和CK组(17.36%、7.68%)相对丰度较高,有助于增加大曲原料的利用率,提高生产效益。本研究检测出的优势酵母属包括毕赤酵母属和生丝毕赤酵母属,其中以毕赤酵母属为主,在SY组和CK组相对丰度分别为13.93%和8.22%(P<0.05),其在SY组中为第二优势菌属。据了解,毕赤酵母属是众多香型曲药中的优势菌群之一,与大曲中的一些酯类和苯乙醇的产生有着直接关系[26-27]。生丝毕赤酵母属在CK组(相对丰度1.01%)为优势菌属,在SY组中相对丰度为0.33%(P<0.05),据唐慧芳等[28]研究发现,其与老场地大曲淀粉水解能力呈正相关,与新场地大曲呈弱负相关。其余菌属占比较少,有根毛霉属(Rhizomucor)(SY:0.87%,CK:0.56%)、拟青霉属(Paecilomyces)(SY:0.23%,CK:0.06%)、横梗霉属(Lichtheimia)(SY:0.13%,CK:0.03%)、卡扎斯坦酵母属(Kazachstania)(SY:0.01%,CK:0.05%)、其他菌属(Others)(SY:0.24%,CK:0.83%)。尽管这些菌属在大曲中分布较少,但对白酒品质有着潜在的风味贡献作用。
2.4 挥发性风味成分与微生物之间的相关性分析
为研究微生物与挥发性风味成分之间潜在的相关作用,将两种大曲筛选出的差异性成分合并归属至各类挥发性风味化合物,研究各种类挥发性风味化合物和大曲中优势微生物菌属之间的相关关系,结果见图10。

图10 两种大曲样品优势微生物菌群与挥发性风味成分相关性分析Fig.10 Correlation analysis between dominant microbial flora and volatile flavor substances of two kinds of Daqu samples
由图10可知,芽孢杆菌属与吡嗪类呈高度显著正相关(P<0.001),与酚类、酮类和醚类呈极显著正相关(P<0.01),与酯类呈显著正相关(P<0.05),这与众多学者研究报道结果相符合[29-30]。乳杆菌属和曲霉菌属与酸类和醇类物质呈显著正相关(P<0.05)。魏斯氏菌属和链霉菌属均对酯类和醚类物质的积累有着积极的影响,特别是对酯类的影响极为显著(P<0.01)。此外,糖多孢菌属与酯类物质也呈显著正相关(P<0.05)。高温放线菌属和片球菌属与挥发性风味成分相关性一致,均与醇类、内酯类、酸类和脂肪烃类呈明显负相关,特别是对脂肪烃的影响是高度显著的(P<0.001)。泛菌属、明串珠菌属和葡萄球菌属和醛类物质呈显著正相关(P<0.05),而根霉菌属与醛类物质呈极显著负相关(P<0.01)。根霉菌属和嗜热真菌属与酮类、酚类物质有着较强的正相关性(P<0.05),有助于提高大曲的香气成分含量。本研究中的萜烯类、呋喃类以及含硫类等化合物代谢均与曲霉菌属、泛菌属分别呈极显著(P<0.01)和显著正相关(P<0.05),而醋杆菌属仅与其他含氮类呈显著负相关(P<0.05),生丝毕赤酵母属仅与脂肪烃类呈显著负相关(P<0.05)。
3 结论
以酿酒专用小麦和普通小麦为原料制成中温大曲,两种大曲共检测出125种挥发性成分,其中酿酒专用小麦中的独有成分占20种,普通小麦大曲中独有成分占17种,并从88种共有成分中筛选出49种差异性风味成分,且有29种差异性风味成分含量在酿酒专用小麦大曲中明显高于普通小麦大曲。因此,相比于普通小麦,酿酒专用小麦所制大曲在挥发性风味成分上有着更加突出的表现,可一定程度上增强白酒生产中的大曲生香作用。在微生物方面,酿酒专用小麦大曲在细菌群落测序过程中,发现物种数始终高于普通小麦大曲。两种大曲在微生物物种组成上相似,主要差异为各自物种丰度占比,其中酿酒专用小麦大曲中优势细菌属、真菌属分别占11种和4种,普通小麦大曲优势细菌属、真菌属分别占9种和6种。为探究微生物对差异性挥发性成分的影响,将两种大曲差异性挥发性成分聚类后和微生物优势菌属作相关性分析。结果表明,芽孢杆菌属(Bacillus)是造成两种大曲吡嗪类物质含量差异的主要来源,同时与魏斯氏菌属(Weissella)、链霉菌属(Streptomyces)以及糖多孢菌属(Saccharopolyspora)在酯类物质的代谢上有着促进作用。乳杆菌属(Lactobacillus)和曲霉菌属(Aspergillus)则与醇类、酸类物质呈显著正相关。泛菌属(Pantoea)、明串珠菌属(Leuconostoc)和葡萄球菌属(Staphylococcus)为两种大曲的醛类物质的主要贡献微生物。酮酚类等香气成分的积累则主要与芽孢杆菌属(Bacillus)、根霉菌属(Rhizopus)和嗜热真菌属(Thermomyces)有关。

