深度学习重建在低剂量颅脑CT 灌注的研究
刘昊喆 陈钰 苏童 王彦玲 徐敏 王剑 金征宇
颅脑CT 灌注(computed tomography perfusion,CTP)是一种快速、无创、定量的评估脑缺血状态的技术,可以获得脑血流量(cerebral blood flow,CBF)、脑血容量(cerebral blood volume,CBV)及平均通过时间(mean transit time,MTT)等参数。CTP 已经在临床中得到了广泛的应用,但是由于需要重复多期扫描,CTP 的累积辐射剂量较高,根据美国最近的研究,大约1.5 %~2.0 %的可疑肿瘤可能归因于CT 检查的辐射[1]。因此,应在尽量减少CT 检查方案的辐射剂量的同时保证足够的诊断图像质量[2]。降低球管电压及减少管电流可以减少CT辐射剂量,但是随着辐射剂量的降低,通常会使图像噪声增加[3]。通过改变CT 重建算法可降低图像噪声,提升图像的质量[4]。与最常用的CT 重建算法滤波反投影(filtered back projection,FBP)相比[5],迭代重建(iterative reconstruction,IR)可减低图像的噪声,但是,迭代重建为了使重建图像更接近初原始图像,迭代次数必须接近无穷,这就导致重建的时间明显增加[6]。而且因建模过程复杂,迭代重建的噪声纹理看起来有“蜡像感”和“不自然感”,使图像失真[7]。三维自适应迭代剂量降低重建(adaptive iterative dose reduction three-dimensional,AIDR 3D)是对原始图像进行迭代重建,使图像噪声减低至合理水平[8],目前在头颈部血管、心脏血管、胸部相关的重建均有应用[9]。近年来深度学习重建(deep learning reconstruction,DLR)算法也逐步应用于临床。既往研究表明,基于深度学习算法可在降低CT 辐射剂量的同时提高图像质量,降低图像噪声,满足诊断要求[10-14]。有研究表明,在对门静脉的研究中,低辐射剂量组的AiCE(advanced intelligent clear-IQ engine)重建与标准剂量AIDR相比,CNR 值提高近1 倍,明显优于标准剂量的AIDR[15]。深度学习重建算法在颅脑CT 灌注方面也得到了初步临床应用,研究结果表明深度学习的图像质量显著优于AIDR 3D[16]。
本研究的目的在于评价基于低辐射剂量的DLR 算法颅脑CTP 灌注参数及动脉峰值期图像质量,与常规辐射剂量的混合迭代重建(hybrid iterative reconstruction,HIR)进行比较。
1 资料与方法
1.1 研究对象
本研究经伦理委员会(伦理审查批件编号:HS-2427)批准。回顾性分析2020 年7 月—2022年11 月在北京协和医院接受头部CT 灌注的60 例成人患者。纳入标准:1)年龄在18 岁以上;2)既往有脑血管病发作史或CTA/MRA 检查发现颅内动脉狭窄;3)生命体征稳定;4)有完整的临床资料。排除标准:1)患者图像运动伪影明显,灌注参数处理失败;2)严重失代偿性心脏功能不全,动脉峰值期延迟明显;3)患者既往头颅手术史或颅内有金属植入物,脑组织形态异常或伪影较重。
1.2 扫描设备及重建
检查时嘱患者仰卧位,双臂放松并置于身体两侧,同时嘱患者在检查期间头部制动。头部CT灌注采用两种扫描方案:A 组常规剂量,B 组低剂量。管电压及管电流的参数详见表1。头部CT 灌注进行多期容积扫描,扫描范围从第1 颈椎到颅顶骨,扫描管电压为80 kV,固定毫安秒,速度为0.5 s/r,准直器为320×0.5 mm。使用双管高压注射器以5.0 mL/s 的流率将40 mL 碘帕醇(370 mg I/mL)和30 mL 生理盐水注入正中肘静脉。

表1 两组不同剂量的颅脑灌注扫描参数
图像重组矩阵为512×512,重组层厚和重组层间距均为0.5 mm。扫描完成后,A 组扫描采用常规剂量并将其重建为AIDR 3D(Kernel 值为FC 41)序列(AIDR-R),B 组扫描采用低剂量并将其分别重建为AIDR 3D(Kernel 值为FC 41)序列(AIDR-L)和AiCE BRAIN LCD(Standard 档位)序列(AiCE-L),共获得3 组灌注序列的图像。
将AIDR-R、AIDR-L 和AiCE-L 的多期灌注图像进行重组。以大脑中动脉(middle cerebral artery,MCA)起始段为流入动脉,以上矢状窦为流出静脉。使用后处理软件的兴趣区(region of interest,ROI)模板,按照脑的解剖区域,绘制额叶、颞叶和枕叶的ROI,并将基底节的ROI 手动对称地绘制到对侧。手动选取大脑中动脉CT 值最大的增强时间点,并提取单期增强图像作为动脉期峰值图像。
1.3 辐射剂量
记录设备自动为患者生成的的头CT 灌注辐射剂量,其中包括图像的容积CT 剂量指数(CT dose index volume,CTDIvol)和剂量长度乘积(dose length product,DLP)。同时手动计算该患者的有效剂量(effective dose,ED):ED=DLP×k,k 为权重因子0.0023(mSv/mGy·cm)。
1.4 图像质量评价
由两名分别具有5 年及10 年头颈部血管诊断经验的医师共同进行测量,取一致性结果作为最终结果。
1.4.1 灌注参数测量
在两组数据中,选取并保存患者重建的CBF、CBV 及MTT 图,测量并记录该患者在基底节区、颞叶、额叶、及顶叶各ROI的CBF、CBV 及MTT 均值及标准差(图1)。

图1 男,53 岁,灌注参数测量方法举例。a)根据AiCE-L 灌注序列重组CBF 图,使用后处理软件的ROI 模版自动制作额叶、枕叶及颞叶区的ROI,在基底节层面手动制作单侧基底节区ROI 并通过对称线对称复制到对侧;b)根据AiCE-L 灌注序列重组CBV 图,绘制ROI 方法同前;c)根据AiCE-L 灌注序列重组MTT 图,绘制ROI 方法同前。
1.4.2 动脉峰值期图像质量分析
在动脉期峰值图像上将ROI 放置在双侧半卵圆中心、双侧颈内动脉虹吸段、基底动脉及脑干处,颈内动脉和基底动脉ROI 均为圆形,直径约1.5 mm,半卵圆中心及脑干ROI 均为圆形,直径约10 mm。记录各个序列的平均CT 值及标准差(standard deviation,SD)。计算半卵圆中心、颈内动脉虹吸段、基底动脉及脑干的信噪比(signal-to-noise ratio,SNR),计算颈内动脉虹吸段及基底动脉的对比剂噪声比(contrast-to-noise ratio,CNR)。
1.5 统计学分析
采用R Software(Version 3.6.1)进行统计学分析。数据采用中位数±四分位间距的形式表达,比较AIDR-R、AIDR-L 和AiCE-L 序列的额叶、颞叶、枕叶和基底节血供区的CBF 值、CBV 值和MTT 值的中位数差异。比较动脉峰值期图像中半卵圆中心、脑干、双侧颈内动脉虹吸段、基底动脉的CT 值、SD 值、SNR 值以及CNR 的中位数值。采用Shapiro-Wilk 检验数据是否满足正态分布。采用Friedman Test 来分析组间的差异,如果组间存在统计学差异,则采用带Bonferroni 校正的Wilcoxon符号秩检验进行组间两两比较,P<0.05 表示有统计学差异。
2 结果
2.1 患者一般情况
60 例患者,A 组一共30 例,男16 例,女14例,年龄(58.76±13.60)岁,CTDIvol 为97.3 mGy,DLP为1572.6 mGy·cm,有效剂量ED 为3.30 mSv。动脉峰值期CTDIvol 为5.3 mGy,DLP 为85.3 mGy·cm,ED 为0.18 mSv。B 组一共30 例,男13 例,女17例,年龄(60.84±13.03)岁。CTDIvol 为69.8 mGy,DLP 为1131.8 mGy·cm,ED 为2.38 mSv。动脉峰值期CTDIvol 为4.4 mGy,DLP 为71.0 mGy·cm,ED为0.15 mSv。
2.2 图像质量比较
2.2.1 灌注参数比较
与AIDR-R 灌注序列相比,AIDR-L、AiCE-L灌注序列在额叶、颞叶、枕叶及基底节区的CBF及CBV 中位数比较均无统计学差异(P>0.05)。与AIDR-L、AiCE-L 灌注序列在额叶、颞叶、枕叶区、基底节区的MTT 值均高于AIDR-R 序列,存在统计学差异(P<0.001)(表2)。
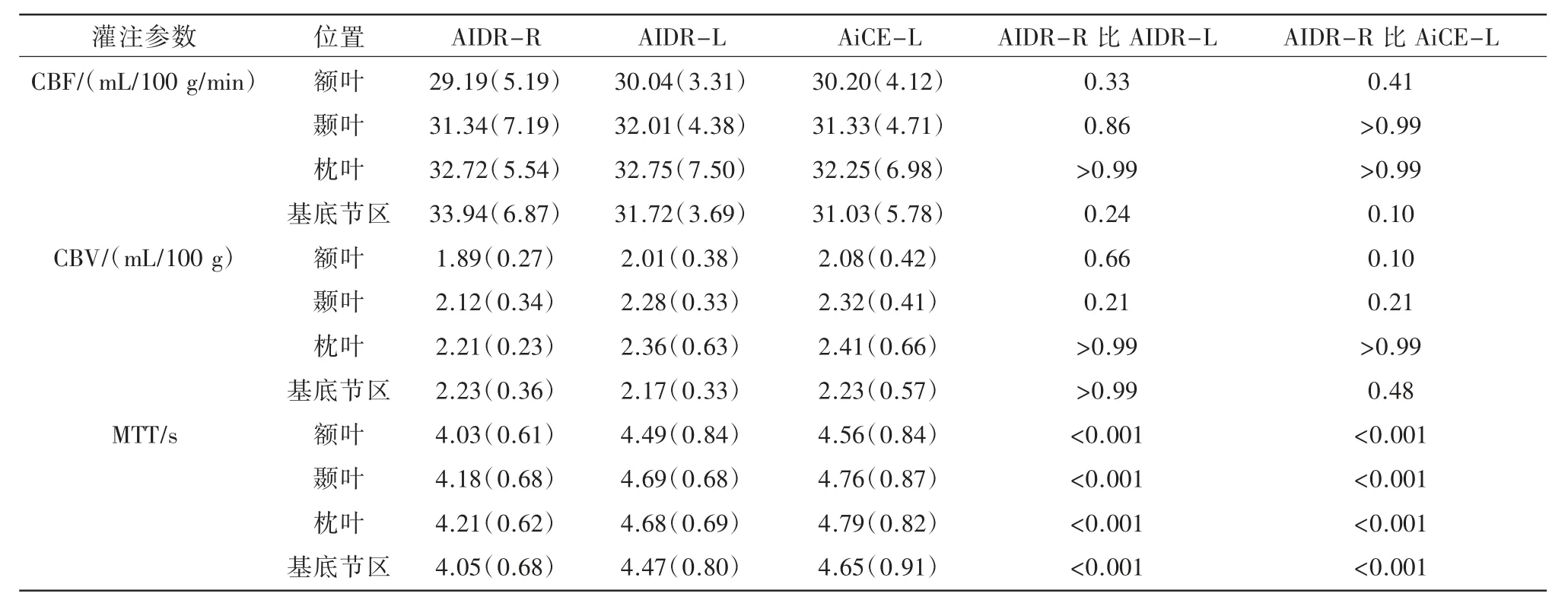
表2 AIDR-R、AIDR-L、AiCE-L 三期扫描数据的测量值对比列表
2.2.2 动脉峰值期的图像质量比较
与AIDR-R 动脉峰值期图像比较,AiCE-L 序列在颈内动脉虹吸段及基底动脉CT 值低于AIDR-R(P<0.05),SD 值、SNR 及CNR 无统计学差异(P>0.05)。AiCE-L 序列在半卵圆中心及脑干的CT 值及SD 值低于AIDR-R(P<0.05),半卵圆中心的SNR 高于AIDR-R,脑干的SNR 无统计学差异(P>0.05)(表3,图2~7)。
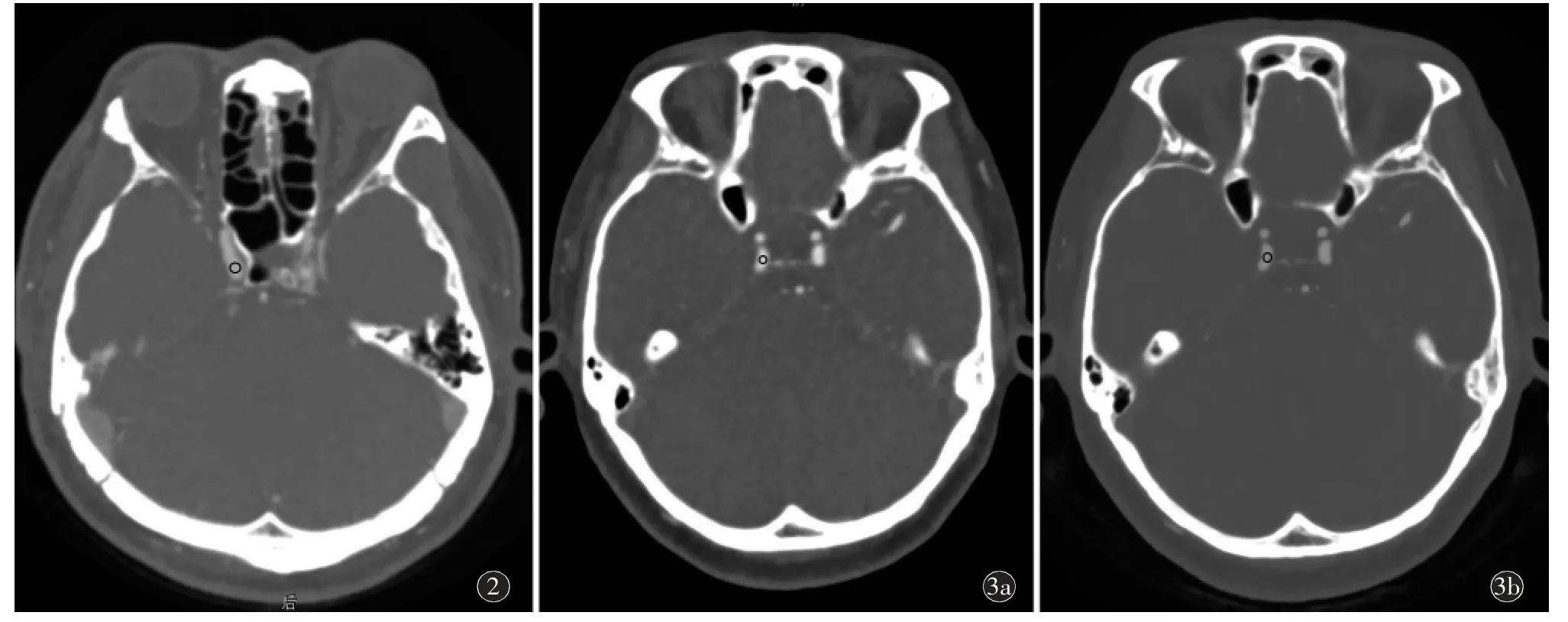
图2~3 AIDR-R、AIDR-L 及AiCE-L 重建序列的动脉期最大峰值期的图像测量举例。图2 女,53 岁。根据AIDR-R 序列时间密度曲线,选取动脉峰值期图像,在颈内动脉虹吸段放ROI,ROI 的平均CT 值为669.0 HU,SD 值为4.56 HU,计算SNR 值为146.71。图3 a)女,46 岁。根据AIDR-L 序列时间密度曲线,选取动脉峰值期图像,在颈内动脉虹吸段放ROI,ROI 的平均CT 值为566.5 HU,SD 值为7.04 HU,计算SNR 值为80.46;b)根据AiCE-L 序列时间密度曲线,选取动脉峰值点单期图像,将a)中内动脉虹吸段层面ROI 复制到b),ROI 的平均CT 值为640.0 HU,SD 值为3.35 HU,SNR 值为191.04。
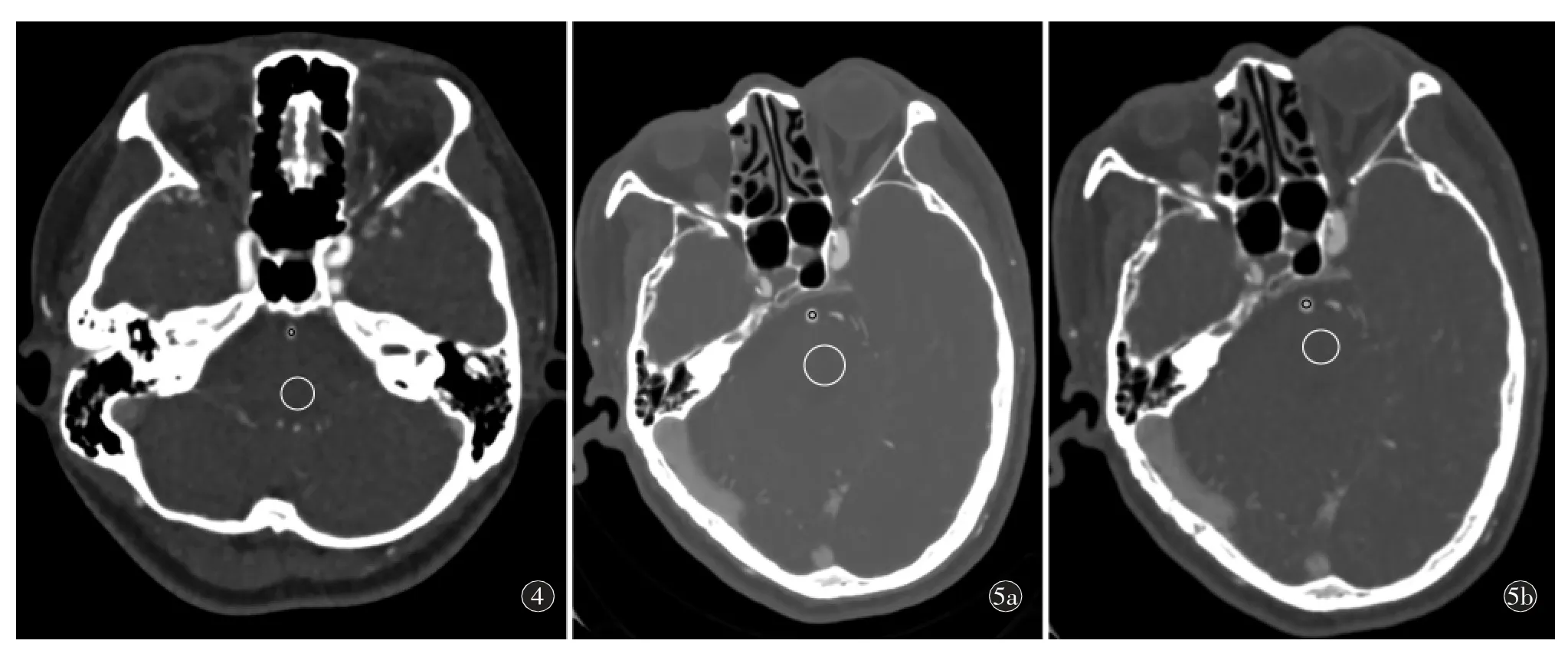
图4~5 AIDR-R、AIDR-L 及AiCE-L 重建序列的脑干及基底动脉最大峰值期的图像测量举例。图4 女,61 岁。根据AIDR-R 序列的各期动脉期血管CT 值测量,选取动脉峰值期图像,在脑干放ROI,ROI 的平均CT 值为43.31 HU,SD 值为14.2 HU,计算SNR 值为3.05,在基底动脉放置ROI,ROI 的平均CT 值为481.77 HU,SD 值为17.75 HU,计算SNR 值为33.92。图5 男,68 岁。a)根据AIDR-L 序列的各期动脉期血管CT 值测量,选取动脉峰值期图像,脑干放ROI,ROI 的平均CT 值为51.89 HU,SD 值为15.17 HU,计算SNR 值为3.42。在基底动脉放置ROI,ROI 的平均CT 值为633.00 HU,SD 值为25.28 HU 计算SNR 值为25.03;b)根据AiCE-L 序列的各期动脉期血管CT 值测量,选取动脉峰值期图像,将a)中内脑干层面ROI 复制到b),ROI 的平均CT 值为46.77 HU,SD 值为11.56 HU,计算SNR 值为4.04。根据AiCE-L 序列的各期动脉期血管CT 值测量,选取动脉峰值期图像,将a)中内基底动脉层面ROI 复制到b),ROI 的平均CT 值为731.94 HU,SD 值为24.07 HU,计算SNR 值为30.40。
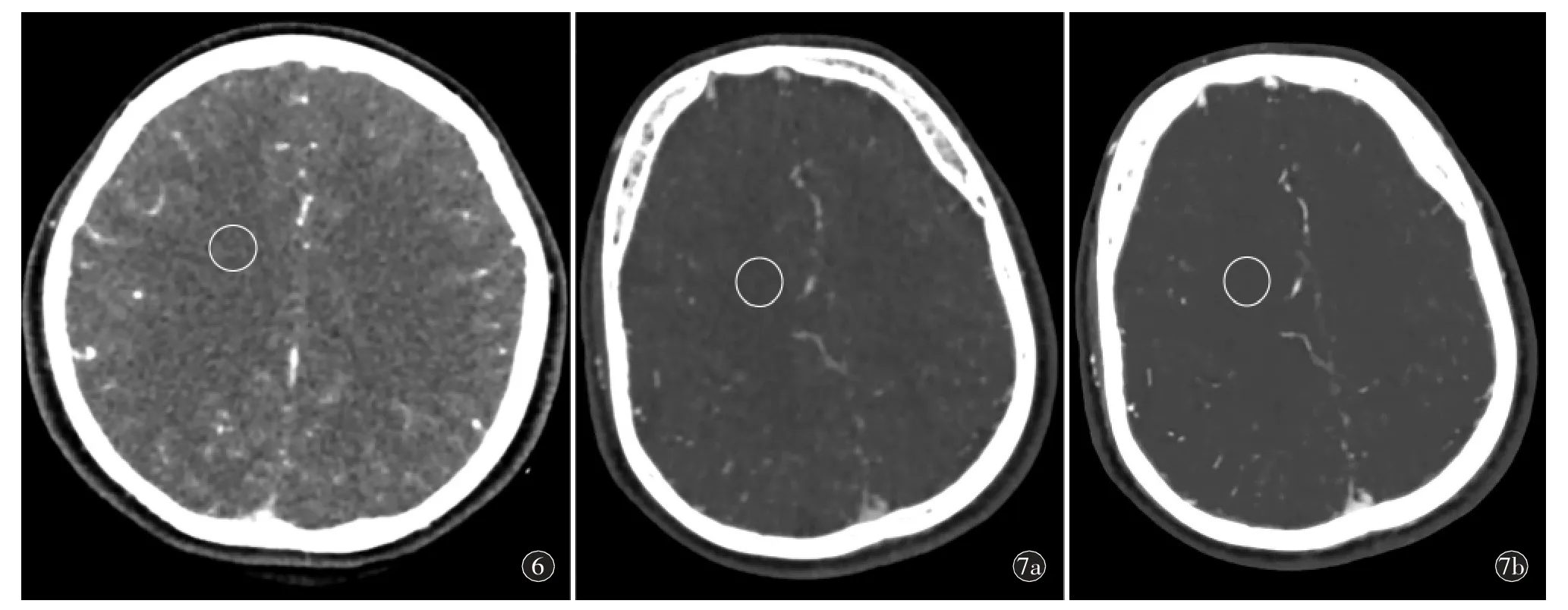
图6~7 AIDR-R、AIDR-L 及AiCE-L 重建序列的半卵圆中心最大峰值期的图像测量举例。图6 女,53 岁。根据AIDR-R 序列的各期动脉期血管CT 值测量,选取动脉峰值点单期图像,在脑干放ROI,ROI 的平均CT 值为39.75 HU,SD 值为11.95 HU,计算SNR 值为3.32。图7 女,46 岁。a)根据AIDR-L 序列的各期动脉期血管CT 值测量,选取动脉峰值点单期图像,半卵圆中心层面放ROI,显示ROI的平均CT 值为37.94 HU,SD 值为10.87 HU,计算SNR 值为3.49;b)根据AiCE-L 序列的各期动脉期血管CT 值测量,选取动脉峰值点单期图像,将a)中半卵圆中心层面ROI 复制到b),ROI 的平均CT 值为37.9 HU,SD 值为5.82 HU,计算SNR 值为6.51。

表3 不同剂量颅脑CT 灌注重建序列动脉峰值期的图像质量比较
3 讨论
本研究为采用深度学习CT 重建进行头颅CTP 检查,并且比较了低辐射剂量AiCE 重建与常规辐射剂量AIDR 对图像质量以及灌注参数的影响。结果表明,与常规剂量AIDR-R 相比,低剂量AiCE-L 的灌注序列CBF 及CBV 无统计学差异,动脉峰值期颈内动脉虹吸段及基底动脉的SNR及CNR 无统计学差异。
在CT 检查中,图像噪声、SNR 以及CNR 是评价客观图像质量常用的方法。降低噪声的同时增加SNR 以及CNR 值不仅可提高图像质量,还有助于提高对病灶的显示。本研究表明AiCE-L 序列的SD 值明显低于AIDR-L 及AIDR-R,但是AiCE-L 序列的SNR 值与AIDR-R 序列相比无显著差异,说明AiCE-L 序列虽然减低了图像的噪声及CT 值,但仍保持了同正常辐射剂量类似的SNR 及CNR。因此可以说明,本研究中的方法证实了通过深度学习重建算法进行颅脑灌注扫描的重建,通过减低辐射剂量但不减低图像质量的CTP扫描来达到同常规剂量扫描类似的效果。另外,国内外有研究者报道了关于使用深度学习算法在腹主动脉CTA 方面的研究,结果表明与适应性统计迭代重建(adaptive statistical iterative reconstruction-Veo,ASIR-V)相比,深度学习重建算法将胸主动脉的图像噪声中值降低了51%~54%。相应地,胸主动脉的CNR 中位数大约翻了一倍。腹主动脉和髂动脉的图像噪声减少了38%,CNR 也相应改善[17]。深度学习重建算法在腹部软组织的效果更为突出,有研究表明,相对于FBP 重建算法,深度学习重建在减小腹部65%辐射剂量的同时还提高了图像质量,并对肝脏内大于0.5 cm 的病变显示良好[18]。在心脏领域,对冠状动脉的研究表明,使用低剂量AiCE 重组的图像,与使用常规剂量AIDR的图像相比,辐射剂量降低40%,图像质量提高约50%[19]。
在既往对胰腺的研究表明,和迭代算法相比,DLR 算法通过保持图像纹理的前提下,降低图像噪声,提高低对比空间分辨率,从而提高图像质量,且DLR 图像质量最佳[20]。本研究表明,DLR 可以在减少颅脑CTP 辐射剂量28%的同时,减低15%SD 值,从而提升图像的SNR 值,达到和正常辐射剂量迭代重建相似的SNR 值,并且在脑干的显示中,DLR 的SNR 值高于正常辐射剂量的脑干SNR 值约10%左右。
本研究表明与正常辐射剂量的HIR 相比,低辐射剂量组DLR 的CBF 和CBV 参数无统计学差异。DLR 可提高低辐射剂量的颅脑CTP 图像动脉峰值期的图像质量,达到与常规剂量HIR 相似的结果。同时本研究发现使用深度学习重建灌注序列的MTT 时间延长,但以往没有类似报道。同时本研究的患者中,大部分临床症状不重,颅脑灌注参数没有明显异常改变。还需要进一步研究延长MTT 是否对颅脑灌注评估存在影响。
此外,本研究也存在一些局限性:1)纳入样本量相对较小;2)纳入的病例以慢性脑血管病的表现为主,且缺少可评估的脑缺血灶,并且本研究缺少急性缺血性卒中的病例。
综上所述,与常规辐射剂量的HIR 相比,低辐射剂量组DLR 的CBF 和CBV 参数无统计学差异。此外,DLR 可提高低辐射剂量的颅脑CTP 图像动脉峰值期的图像质量,与常规剂量HIR 的图像质量相似。