普罗布考联合阿托伐他汀治疗多发脑血管狭窄合并主动脉弓溃疡斑块病例报道
王艳玲,王雪梅
1 病例介绍
现病史:患者男性,57岁,因“头晕伴右侧肢体无力、反应迟钝22小时”于2021年9月11日至首都医科大学附属北京潞河医院急诊就诊,收入神经内科住院治疗。患者于入院前22 h活动中突感头晕,伴右侧上下肢轻度无力,尚可持物及行走。家人发现其反应迟钝,发音欠清晰。发病以来症状持续无好转,无视物旋转及复视,无耳聋、耳鸣及听力下降,无口周及舌尖麻木,无肢体抽搐,无意识不清及尿便失禁。
既往史:高血压4~5 年,收缩压最高160 mmHg(1 mmHg=0.133 kPa),未规律服药及监测血压。浅表性胃炎4~5年,偶尔服药。吸烟30年,10支/日,偶尔饮酒。
入院查体:左上肢血压130/70 mmHg,右上肢血压135/73 mmHg,双肺呼吸音清,未闻及干湿 音,心律齐,65次/分,腹软,无压痛,肝脾未及,双下肢无水肿。神经系统查体:神志清楚,言语欠流利。双侧瞳孔等大正圆,直径3.0 mm,直接及间接对光反射灵敏,双侧眼动充分,无眼震,面纹对称,伸舌居中。四肢肌张力正常,肌力5级,痛觉对称,双手指鼻稳准,双侧Babinski征阴性,颈部无抵抗感。NIHSS评分1分(言语1分)。
辅助检查:头颅MRI(2021-09-11)示左侧大脑半球多发亚急性梗死灶,脑内多发缺血灶(图1)。头颈部CTA(2021-09-16)示主动脉弓溃疡斑块;颈部动脉多发粥样硬化性改变,多发动脉管腔轻中度狭窄;右侧椎动脉V4段局部管腔重度狭窄,大脑后动脉P2段局部管腔中度狭窄,大脑前动脉A1段先天发育不良;左侧颈内动脉C6段溃疡斑块。

图1 患者头颅MRI检查结果Figure 1 MRI results of the patient’s head
实验室检查指标:血糖、TC、TG、HDL-C、LDL-C,肝肾功能、血常规等均在正常范围内。住院期间心电图正常,心脏超声示心脏结构和功能未见明显异常。
入院诊断:
脑梗死
大动脉粥样硬化性
动脉源性栓塞
多发脑动脉中重度狭窄
主动脉弓溃疡斑块
高血压2级(很高危)
诊疗经过:入院后予氯吡格雷75 mg,每日1次,阿司匹林100 mg,每日1次,双联抗血小板聚集治疗;阿托伐他汀20 mg,每日1次,普罗布考250 mg,每日2次口服,降脂、抗氧化治疗。住院期间监测血压,血压波动在(120~130)/(60~90)mmHg,未予降压药口服。患者头晕、肢体无力及反应迟缓等症状逐渐消失,2021年9月20日出院。
出院后定期门诊随访。发病后3 个月(2021年12月),根据血小板聚集率检查结果(血小板最大聚集率:ADP途径71.6%,花生四烯酸途径11.1%),选停氯吡格雷,继续阿司匹林口服抗血小板聚集治疗。2022年2月,分析发病后1个月、3个月和5个月的颈部血管超声随访结果,发现患者右侧颈总动脉、左侧颈总动脉和右侧锁骨下动脉的斑块厚度缓慢增长。遂调整治疗方案,加强降脂、抗氧化力度,将普罗布考的用量由250 mg,每日2次,增加至500 mg,每日2次。调整治疗方案3个月后(2022年5月)复查,上述动脉斑块增厚速度减慢,高峰时斑块厚度vs. 最后一次随访斑块厚度分别为右侧颈总动脉:3.7 mmvs. 2.4 mm;左侧颈总动脉:3.8 mmvs. 3.5 mm;右侧锁骨下动脉:4.5 mmvs. 4.0 mm。TCD随访颅内血管20个月,发现右侧大脑中动脉流速由510 cm/s(判断为重度狭窄)逐渐下降至193 cm/s(判断为中度狭窄)(图2)。颅内其他前循环(左侧大脑中动脉、双侧大脑前动脉)(图3)和后循环(双侧大脑后动脉和基底动脉)(图4)血管持续保持在中度以下高流速或流速维持在接近正常水平。实验室检查指标随访25个月,发现患者发病后显著升高的hs-CRP(10.91 mg/L,正常参考值:0~6 mg/L)逐渐恢复至正常水平并持续稳定。脂蛋白a水平稳定在900~1158 mg/L,并显示出稳中有降的趋势。TG、TC、HDL-C、LDL-C均平稳维持在治疗目标水平(表1)。截至2023年10月,患者无任何新发中枢神经系统急性或进行性缺损的症状和体征。

表1 患者随访期间实验室检查结果Table 1 Laboratory results of the patient during follow-up

图2 颈动脉血管超声斑块厚度随访结果Figure 2 Follow-up results of carotid artery ultrasound plaque thickness
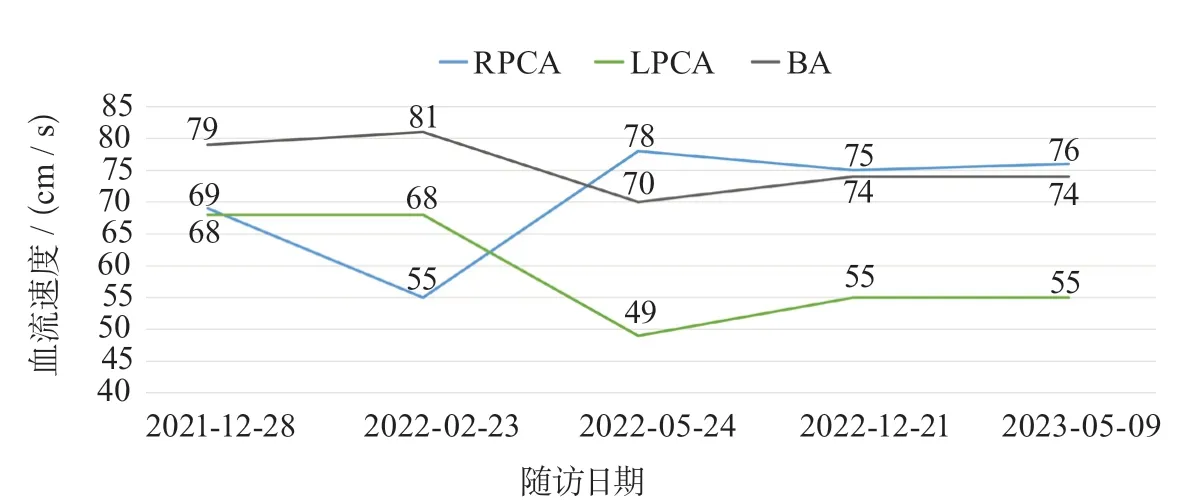
图4 TCD后循环血流速度随访结果Figure 4 Follow-up results of posterior circulation blood flow velocity by TCD
2 讨论
缺血性卒中以其高发病率、高复发率、高致残率等特点给患者及其家庭和社会带来沉重负担[1]。缺血性卒中的治疗是从预防发生到发病后治疗,从神经保护到康复减残和预防复发的全周期干预。其中预防卒中的发生和复发是降低卒中发病率和复发率,从而减轻疾病相关家庭和社会负担的有效措施。
本例患者是一位新发的卒中患者,根据此次发病表现的症状,属于轻型卒中,经过急性期治疗后好转出院。预防患者卒中复发是出院后随访治疗的重点。住院期间,患者完善辅助检查,发现颅内段颈动脉、椎动脉(左侧颈内动脉C6段及右侧椎动脉V4段)重度狭窄,脑内大血管(右侧大脑后动脉P2段)中度狭窄以及主动脉弓存在溃疡斑块和基底动脉迂曲延长。结合头颅MRI表现,考虑患者此次卒中的病因是大动脉粥样硬化,发病机制为动脉源性栓塞。颅内大动脉粥样硬化性缺血性卒中可以选择的治疗包括介入治疗和规范的内科治疗。目前,上述问题血管多数缺乏安全可靠的介入治疗措施,即便是在少数有经验的卒中中心,如果拟对C6段和(或)V4段行介入治疗,也会由于介入后再狭窄风险高等问题而做更加谨慎的术前评判和是否进行手术的抉择[2]。经充分沟通,本例患者拒绝立即进行下一步的脑血管介入检查和治疗,选择接受规范的内科治疗和持续的随访与健康管理。因此,在对本例患者进行充分评估后,制定了个体化抗血小板聚集和强化降脂、抗氧化治疗,以及长期随访的方案。
目前相关指南多推荐对合并主动脉弓溃疡斑块的缺血性卒中(包括TIA)患者,进行90 d的双联抗血小板聚集治疗,其后可以依据血小板聚集率试验决定停止其中一种抗血小板聚集药物,采用单药抗血小板治疗长期维持[3-5]。该例患者进行了3个月的阿司匹林加氯吡格雷双联抗血小板聚集治疗,之后给予持续阿司匹林单抗,并持续给予阿托伐他汀加普罗布考降脂、抗氧化治疗。定期随访发现此患者取得了预防卒中复发的长期稳定疗效。
LDL-C被认为是动脉粥样硬化斑块形成和向易损斑块转化的关键因素之一。他汀类药物可以通过抑制胆固醇合成和增加肝脏表面的低密度脂蛋白受体数量等机制降低胆固醇尤其是LDL-C水平。普罗布考则可以作用于低密度脂蛋白颗粒的核心,使低密度脂蛋白通过非受体途径被清除,加速胆固醇的逆转运。本例患者住院期间和随访期间TC、TG、LDL-C的检测值均处于正常范围。所以,此例患者动脉粥样硬化斑块的稳定和逆转治疗可能还需要依赖额外的途径或方法。而普罗布考在低密度脂蛋白的清除和逆转外,还可以通过改善高密度脂蛋白的功能和清道夫受体的表达而加速胆固醇的代谢清除。同时,普罗布考的抗氧化作用可以减少氧化型低密度脂蛋白的生成,阻断巨噬细胞吞噬,抑制泡沫细胞形成,从而稳定和逆转斑块。他汀类药物与普罗布考联合,从理论上可使强化降脂、抗氧化治疗的作用得到更加充分的发挥[6]。
在随访期间,患者的颈动脉斑块稳定,脑动脉流速稳定,脂蛋白a和各项血脂指标保持稳定,hs-CRP水平降低。本例患者的整个治疗和随访中,包括TC、TG、LDL-C、HDL-C在内的血脂指标始终没有超过正常上限,而初期随访过程中出现了斑块增厚的趋势,但这个趋势在增加普罗布考的用量后,得到了抑制和逆转。本例报道提示临床医师,在特定人群中采用阿托伐他汀和普罗布考联合降脂、抗氧化治疗策略在抗动脉粥样硬化,以及预防卒中发生和复发方面可能具有优效性,在血脂正常或降脂达标的基础上加用普罗布考,可能会进一步降低卒中复发的残余风险。
利益冲突所有作者均声明不存在利益冲突。

