基于PERK/eIF2α/ATF4/CHOP 通路探讨健骨颗粒对UMR-106细胞内质网应激凋亡的影响
陈赛楠,周 芬,黄云梅,林燕萍*
1 福建中医药大学中西医结合研究院,福建 福州 350122;
2 福建省中西医结合老年性疾病重点实验室,福建 福州 350122;
3 福建省中医药科学院骨质疏松证候基因组学重点研究室,福建 福州 350003;
4 福建中医药大学杂志社,福建 福州 350122
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是雌激素水平急剧降低引发骨量下降和骨微结构破坏,致使骨强度减弱和脆性骨折发病率增加的全身性代谢性疾病,属于高转换型原发性骨质疏松症[1]。破骨细胞介导骨吸收和成骨细胞介导骨形成是维持骨稳态的重要因素,雌激素在其中发挥至关重要的作用,PMOP 发生时骨吸收量和骨形成量均增强,但是骨吸收量大于骨形成量。雌激素还是一种抗氧化剂[2],雌激素水平降低和衰老等因素会导致机体活性氧(reactive oxygen species,ROS)过度堆积[3],氧化还原平衡被打破,进一步诱发内质网应激(endoplasmic reticulum stress,ERS),近十年来许多研究显示ERS 与PMOP 的发生和发展关系密切[4-5]。
内质网的蛋白质合成、折叠和修饰等功能的正常发挥是细胞存活的必要条件,氧化还原状态的改变和钙离子流动异常等引起内质网中未折叠蛋白或错误折叠蛋白堆积,从而触发未折叠蛋白反应(unfolded protein response,UPR),轻度的UPR 可维持细胞稳态,然而持续、过强的UPR 引起细胞凋亡;因成骨细胞分泌大量的细胞外基质蛋白,特别容易受到ERS 引起的功能障碍影响,阻碍其增殖分化甚至凋亡,从而导致PMOP 的发生和发展。PERK/eIF2α/ATF4/CHOP 通路是ERS 的最主要的信号通路之一,同样在骨代谢调控中起关键作用[6],为调控ERS相关疾病如PMOP提供新思路。
健骨颗粒是治疗PMOP 的经验方,临床效果显著,课题组前期研究显示健骨颗粒可有效清除机体内多余ROS,并且对肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导的成骨细胞凋亡具有保护作用[7],然而是否通过PERK/eIF2α/ATF4/CHOP 通路减轻ROS/ERS 引起的成骨细胞凋亡尚未涉及。本研究采用过氧化氢(hydrogen peroxide,H2O2)诱导UMR-106细胞形成ROS/ERS模型,观察健骨颗粒含药血清对ROS、细胞凋亡率和PERK/eIF2α/ATF4/CHOP 通路的影响,探讨健骨颗粒保护ROS/ERS 的UMR-106 细胞模型的潜在机制,为PMOP 的临床治疗提供实验支持。
1 材料与方法
1.1 实验动物
SPF 级6 周龄雄性SD 大鼠40 只,购自浙江省医学科学院[生产许可证号:SCXK(闽)1908140006]。实验动物饲养于福建中医药大学实验动物中心SPF级实验室[使用许可证:SYXK(闽)2019-0007],实验前适应性喂养1 周,本研究已通过福建中医药大学动物伦理委员审核会批准通过[批准号:福中医伦理审字[2018]第(038)号]。
1.2 实验细胞
UMR-106 成骨样细胞株购自中国科学院典型培养物保藏委员会细胞库(目录号:TCR11)。
1.3 主要试剂与仪器
1.3.1实验药物 健骨颗粒由淫羊藿、山茱萸、党参、淮山药、煅狗骨等组成,购自福建省同春药业股份有限公司(每克颗粒剂含原生药2.9 g),由福建省中医药科学院内试车间依照课题组制剂工艺标准煎煮浓缩,制备成健骨颗粒浸膏,-20 ℃冰箱保存。
1.3.2主要实验试剂 DMEM 培养基、PBS、0.25%胰蛋白酶均购自于美国Sigma公司;FBS购自于美国Gibco 公司;GSK2606414 购自于美国APExBIO 公司;活性氧分析试剂盒、Annexin V-FITC/PI 凋亡检测试剂盒均购自于江苏凯基生物技术股份有限公司;HiScript Q RT SuperMix for qPCR、AceQ qPCR SYBR Green Master Mix 均购自于南京诺唯赞生物科技股份有限公司;PERK 一抗购自于美国Cst 公司;eIF2α、ATF4、CHOP、β-actin 一抗均购自于Pronteintech公司;Capase-12一抗购自于北京博奥森生物技术有限公司;Fluo-3 AM 购自于株式会社日本同仁化学研究所。
1.3.3主要实验仪器 CO2恒温培养箱购自于香港力康公司;低速离心机购自于德国Eppendorf 公司;ELx800全自动酶标仪购自于美国Thermo Fisher Scientific 公司;倒置相差显微镜购自于日本TKO 光学仪器株式会社;激光共聚焦扫描显微镜购自于卡尔蔡司光学有限公司;流式细胞仪购自于美国BD 公司;7500 Fast 实时荧光定量PCR 仪购自于美国Life technologies 公司;化学发光成像系统购自于美国Bio-Rad公司。
1.4 实验方法
1.4.1生理盐水血清和健骨颗粒含药血清制备 将40 只SD 大鼠采用随机数字表法分为生理盐水血清组和健骨颗粒含药血清组,每组20只。生理盐水组采用生理盐水灌胃,健骨颗粒灌胃剂量根据人和大鼠的体表面积进行换算,按照7.8 g/(kg·d)生药量连续灌胃7 d,最后一次灌胃后2 h后腹主动脉取血,静置4 h 后3 000 r/min 离心15 min 取血清,56 ℃水浴30 min 灭活补体,0.22 μmol/L 过滤器过滤后分装,存储于-80 ℃超低温冰箱。
1.4.2细胞培养和分组干预 选用UMR-106细胞,采用10% FBS、100 μg/mL 青霉素和100 μg/mL 链霉素的DMEM 培养基,培养于5% CO2、37 ℃恒温的细胞培养箱中。将细胞随机分为阴性对照组(NC组)、模型组(H2O2组)、健骨颗粒组(H2O2+JG组)和阳性对照组(H2O2+GSK2606414组)。NC组和H2O2组采用10%生理盐水血清干预12 h,H2O2+JG 组采用10%健骨颗粒含药血清干预12 h,H2O2+GSK2606414组采用0.03 μmol/L 的GSK2606414 和10%生理盐水血清干预12 h,除NC 组外,其余各组在不更换新培养基的情况下,再分别加入10 μmol/L H2O2干预12 h制备ERS模型。
1.4.3CCK8法筛选GSK2606414最佳干预浓度 将UMR-106 细胞按1×104个/孔接种在96 孔板中并培养24 h,采用不同浓度(0、0.01、0.02、0.03、0.04、0.05 μmol/L)的GSK2606414 处理细胞,每个浓度重复6 次,孵育12 h,每孔加入CCK8 10 μL,37 ℃孵育1 h,酶标仪检测450 nm 处吸光度,选取对UMR-106细胞活力没有影响的最大浓度作为GSK2606414 的最佳干预浓度进行后续实验。
1.4.4激光共聚焦显微镜观察细胞内GRP78 和Caspase-12 荧光表达情况 将UMR-106 细胞按8×104个/mL 接种至共聚焦皿,分别培养24 h,弃液,PBS 洗涤3 min×3 次,4%多聚甲醛固定30 min,PBS洗涤;3% H2O2室温孵育10 min,PBS洗涤3 min×3 次;SABC 室温孵育10 min,PBS 洗涤;封闭液孵育1 h,弃液,分别加入GRP78(1∶1 000)和Caspase-12(1∶1 000)一抗4 ℃孵育过夜;弃液,PBS 洗涤,避光加入1∶1 000 荧光二抗室温孵育1 h;PBS 洗净,加入500 μL DAPI 孵育10 min,PBS 洗净后激光共聚焦显微镜观察并拍摄。
1.4.5DCFH-DA 法测定细胞内ROS 含量 将UMR-106 细胞按8×104个/mL 接种至共聚焦皿,分别培养24 h,弃液,用DMEM 洗涤3 次;按照1∶1 000加入DCFH-DA 荧光探针,37 ℃避光孵育20 min;激光共聚焦显微镜拍摄,ImageJ分析实验结果。
1.4.6激光共聚焦显微镜观察细胞内钙离子实时动态变化 将UMR-106 细胞按8×104个/mL 接种至共聚焦皿,培养24 h,弃液,Hank's 平衡盐溶液(HBSS溶液)洗涤5 min×3次,加入30 μmol/L Fluo-3 AM 工作液1.25 μL,再加入0.05% Pluronic F-127 工作液1.25 μL,轻晃混匀,避光37 ℃孵育30 min;弃液,HBSS 溶液洗涤3 min,加入500 μL HBSS,再加入5 μL Hoechst33342 孵育10 min;弃液,HBSS 溶液洗涤5 min×3 次。根据组别分别滴加10%生理盐水血清及10 μmol/L H2O2,激光共聚焦显微镜拍摄,设置拍摄视频时长约40 min,ZEN软件分析。
1.4.7Annexin V-FITC/PI检测细胞凋亡率 UMR-106细胞按2×105个/孔接种于6孔板,分组干预,弃液,PBS洗涤,每孔加入200 μL 不含EDTA 胰酶消化2 min,加入完全培养基终止消化,收集细胞悬液至15 mL 离心管,2 000 r/min 离心3 min;弃液,PBS 洗涤,2 000 r/min 离心3 min;每管加入500 μL Binding Buffer,轻柔吹打混匀移入流式管,每管加入5 μL Annexin V-FITC 和5 μL PrPidium Lodide 充分混匀,避光孵育15 min,流式细胞仪上机检测,FLOWJO 软件分析数据,实验重复3次以上进行统计。
1.4.8qPCR检测细胞ERS标志基因GRP78及PERK通路关键指标mRNA 转录水平 分别收集4 组细胞,加入TriZol 1 mL 充分混匀,静置10 min;加入氯仿200 μL,震荡30 s 混匀,4 ℃ 12 000 r/min 离心20 min;取400 μL上清至新EP管中,再加入400 μL异丙醇,充分混匀后冰上静置15 min,放入离心机中4 ℃ 12 000 r/min 离心20 min;弃液,加入75%乙醇1 mL,4 ℃ 7 500 r/min 离心5 min,弃液,加入20 μL DEPC 溶解总RNA;nanodrop 2000 分光光度计检测OD260/OD280值。HiScript QRT SuperMix 将RNA 逆转录成cDNA,AceQ-qPCR SYBR Green Master Mix 配置qPCR反应体系,条件如下:95 ℃ 10 s和60 ℃ 30 s共40 个循环,95 ℃ 15 s、60 ℃ 60 s、95 ℃ 15 s 共1 个循环得到溶解曲线,GAPDH 作为内参,2-ΔΔct计算目的基因相对表达量。引物序列见表1。

表1 引物序列Table 1 Primer sequence
1.4.9Western blot 检测细胞ERS 标志蛋白GRP78及PERK 通路关键指标蛋白含量 分别收集4 组细胞,弃液,PBS 洗涤,加入100 μL RIPA 裂解液、1 μL PMSF 和1 μL 磷酸酶抑制剂,冰上裂解30 min,4 ℃12 000 r/min 离心18 min,取蛋白上清,按照1∶4 比例加入25 μL 5×Loading Buffer,充分混匀,95 ℃变性5 min,-80 ℃保存。采用6~10% SDS-PAGE 电泳,湿转至0.22 μm PVDF 膜上,QuickBlock™快速封闭液室温孵育5 min,分别采用GRP78(1∶1 000)、PERK(1∶1 000)、eIf2α(1∶1 000)、ATF4(1∶1 000)、CHOP(1∶1 000)和β-actin(1∶5 000),一抗4 ℃孵育过夜,TBST 洗涤,1∶10 000 二抗室温孵育1 h,TBST 洗涤,滴加显影液曝光成像,以β-actin 作为内参,计算目标蛋白相对表达量。
1.5 统计学方法
实验数据采用SPSS 25.0 软件统计分析。数据符合正态分布以(±s)表示,组间比较采用单因素方差分析,方差齐时用LSD-t法,方差不齐时用Games-Howell 法。数据不符合正态分布时采用非参数检验法。以P<0.05表示差异有统计学意义。
2 结 果
2.1 GSK2606414抑制剂的最佳干预浓度
与0 μmol/L 的空白对照组相比,0.01、0.02 和0.03 μmol/L GSK2606414处理后细胞活力没有显著变化,0.04、0.05 μmol/L GSK2606414 可观察到细胞活力显著降低(P<0.01)。见图1。结果表明GSK2606414干预UMR-106细胞12 h后对细胞活力没有影响的最大浓度为0.03 μmol/L,故使用该浓度作为后续H2O2+GSK2606414组的实验干预条件。
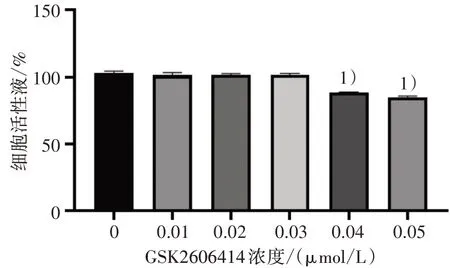
图1 不同浓度GSK2606414对UMR-106细胞活力的比较Figure 1 Comparison different concentrations of GSK260 6414 on the viability of UMR-106 cells
2.2 NC 组和H2O2组GRP78 和Caspase-12 蛋白荧光表达比较
本实验沿用课题组前期成熟的体外细胞氧化应激造模条件,采用10 μmol/L H2O2干预UMR-106细胞12 h 诱导氧化应激[8]。免疫荧光染色观察ERS标志物蛋白GRP78 和ERS 细胞凋亡指标Caspase-12 的表达水平。结果显示:与NC 组相比,H2O2处理后GRP78 和Caspase-12 的荧光强度显著增加,表明H2O2诱导UMR-106 细胞ROS/ERS 模型的成功建立。见图2。
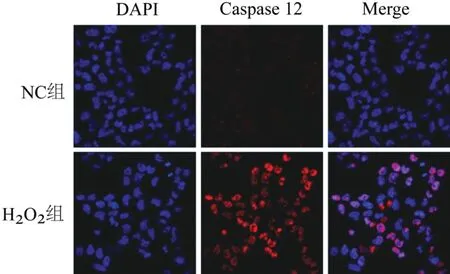
图2 UMR-106细胞GRP78和Caspase-12蛋白荧光强度比较(×400)Figure 2 Comparison of fluore scence intensity of GRP78 and Caspase-12 of UMR-106 cells (×400)
2.3 NC组和H2O2组钙离子实时动态变化比较
Fluo 3-AM 检测细胞内钙离子实时动态变化,结果显示:NC组细胞内钙离子流随时间推移无明显变化,处于相对稳定状态;H2O2处理后H2O2组荧光强度和钙离子流速随时间推移而增加,进一步表明H2O2诱导UMR-106 细胞ROS/ERS 模型的成功建立。见图3。
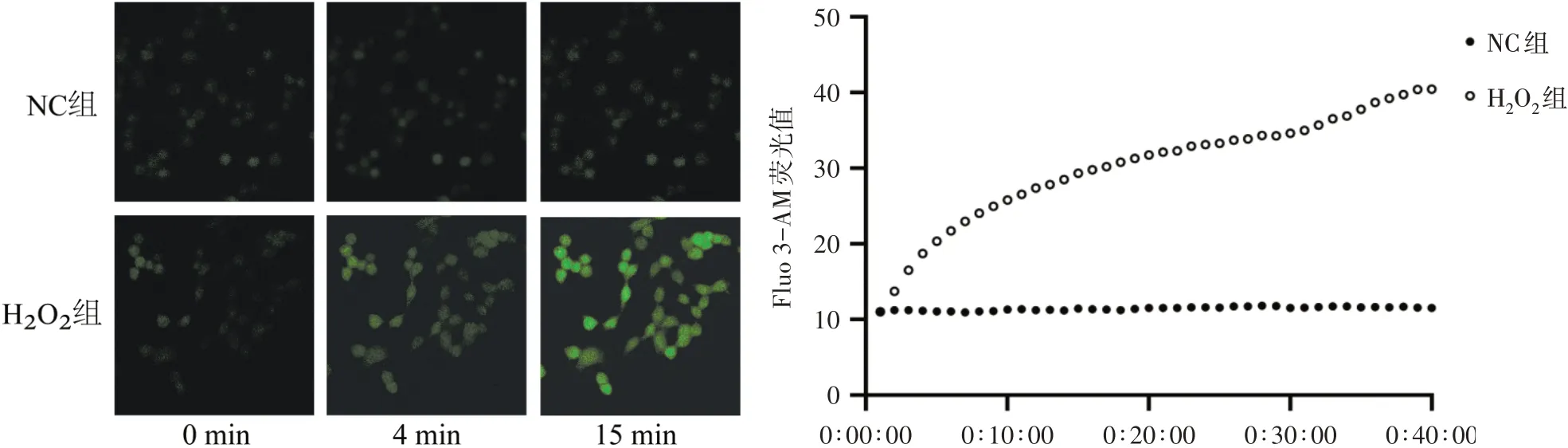
图3 细胞钙离子实时动态变化比较(×400)Figure 3 Comparison of real-time dynamic changes in cellular calcium ions (×400)
2.4 NC组和H2O2组ROS含量比较
线粒体是细胞内ROS 的主要来源,DCFH-DA探针证实H2O2处理后UMR-106 细胞内ROS 含量显著升高(P<0.01);健骨颗粒和GSK2606414 干预后细胞内ROS 含量显著降低(P<0.01)。见图4。结果表明健骨颗粒可抑制ROS/ERS 模型细胞中ROS的生成。
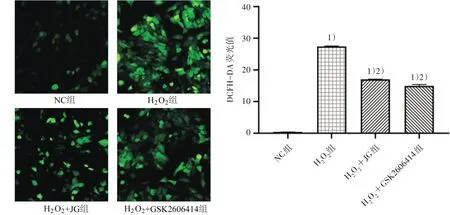
图4 ROS含量比较(×400)Figure 4 Comparison of ROS content (×400)
2.5 4组细胞晚期凋亡率比较
与NC 组比较,H2O2组细胞晚期凋亡率升高(P<0.01),健骨颗粒和GSK2606414 干预后细胞晚期凋亡率均有所下降(P<0.05)。见图5。
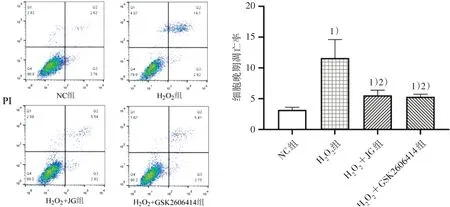
图5 4组细胞晚期凋亡率比较Figure 5 Comparison of advanced cell apoptosis rates in four groups
2.6 4 组PERK/eIF2α/ATF4/CHOP 通路关键基因mRNA转录水平比较
与NC 组相比,H2O2组GRP78、PERK、eIf2α、ATF4和CHOP mRNA转录水平显著增高(P<0.01);与H2O2相比,健骨颗粒和GSK2606414干预后GRP78、PERK、eIf2α、ATF4和CHOP mRNA 转录水平均降低(P<0.01)。见图6。
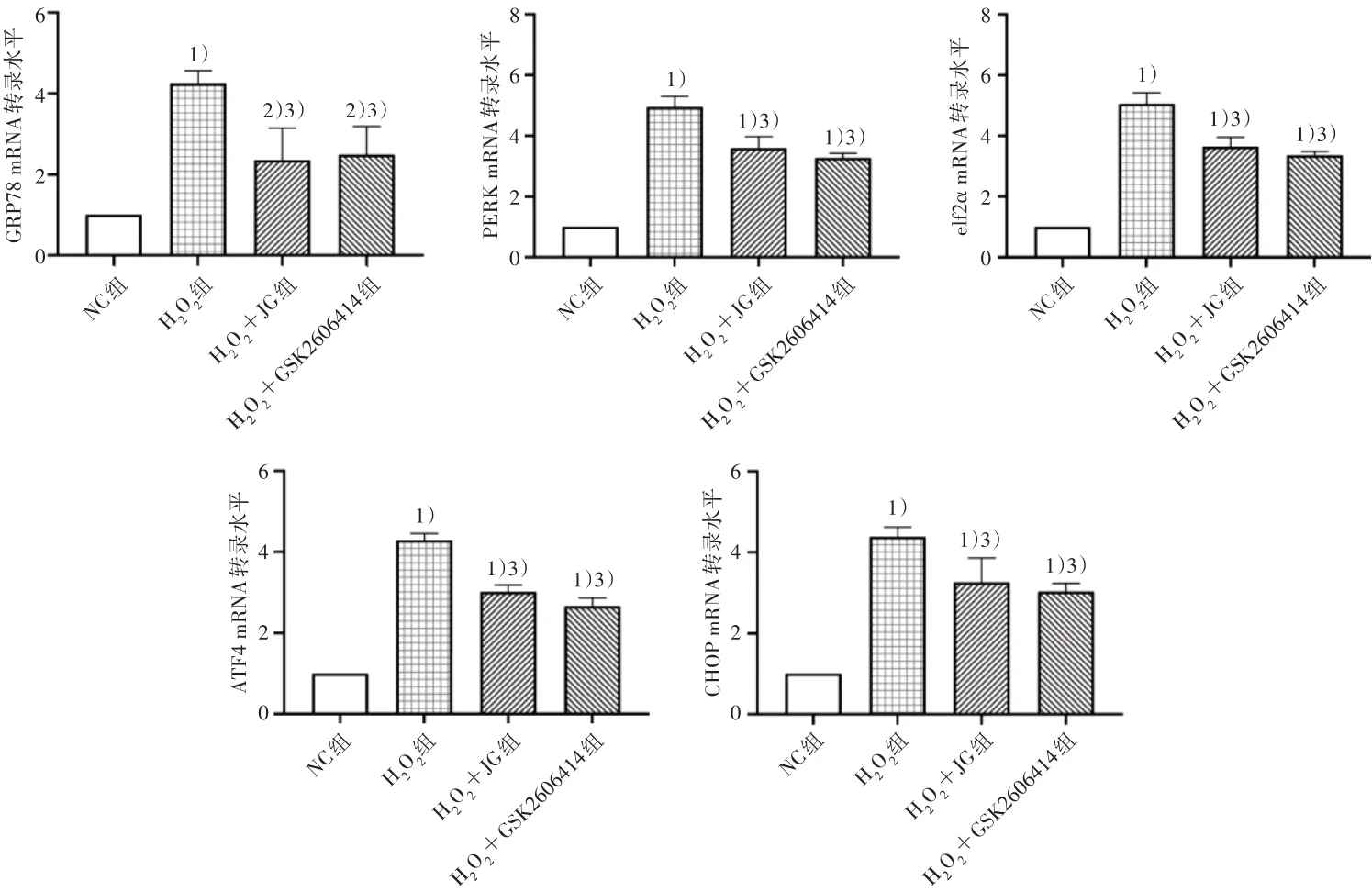
图6 4组PERK/eIF2α/ATF4/CHOP通路关键基因mRNA转录水平比较Figure 6 Comparison of mRNA expression level of key genes in the PERK/eIF2α/ATF4/CHOP pathway
2.7 4 组PERK/eIF2α/ATF4/CHOP 通路关键蛋白相对表达量比较
与NC 组相比,H2O2组GRP78、PERK、eIf2α、ATF4和CHOP蛋白相对表达量显著增高(P<0.01);与H2O2组相比,健骨颗粒和GSK2606414 干预后GRP78、PERK、eIf2α、ATF4 和CHOP 蛋白相对表达量均降低(P<0.05)。见图7。
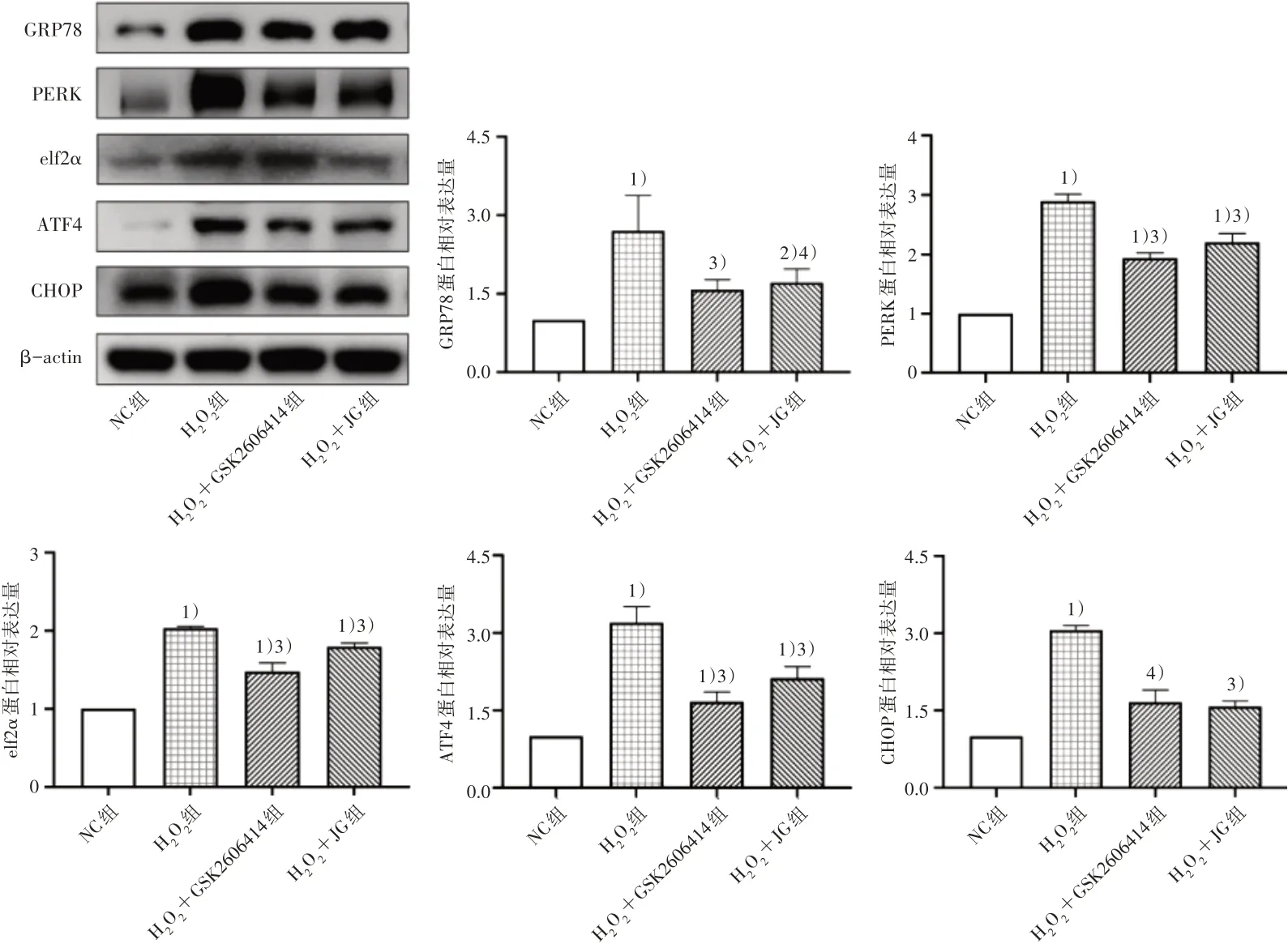
图7 4组PERK/eIF2α/ATF4/CHOP通路关键蛋白相对表达量比较Figure 7 Comparison of expression level of key proteins in the PERK/eIF2α/ATF4/CHOP pathway in four groups
3 讨 论
PMOP 发病率显著高于老年性骨质疏松症,严重影响中老年女性的生活质量。现阶段治疗药物分为四大类:抑制骨吸收药物(雌激素类、选择性雌激素受体调节剂、双膦酸盐类和降钙素),促进骨形成药物(甲状旁腺激素等),双重作用药物(雷尼酸锶等)和骨矿化促进剂(钙剂、维生素D)。虽然雌激素水平急剧降低是PMOP 的主要病因,然而雌激素替代治疗可引起子宫癌和乳腺癌的风险性增加[9]。双膦酸盐类抑制骨吸收量的同时新生骨量和质量相应减少,可能引起颌骨坏死等严重不良反应[10]。甲状旁腺激素(特立帕肽)的最长持续使用时间是2 年。中医药因其独特优势受到医患的广泛关注[11-13],进一步明确其作用机制势在必行。
ROS 包括氧和含氧的高反应活性分子,例如H2O2、超氧阴离子(O2-)和羟基自由基(·OH)等,氧化应激可损伤成骨细胞的细胞成分,是骨质流失的致病因素之一[14]。本实验采用H2O2制备细胞模型,其直接攻击维持蛋白折叠酶活性所必需的游离巯基,内质网腔内蛋白质被氧化修饰,触发ERS,ERS是重要的细胞自我防御机制,适当的ERS 有助于成骨分化,然而持续、过度的ERS 抑制成骨分化并诱导其凋亡,ERS 在PMOP 的发生和发展中起重要作用[15-16]。实验结果显示:10 μmol/L H2O2干预UMR-106 细胞12 h,在ROS 水平达到峰值的同时GRP78和Caspase-12 表达水平显著增强,细胞内钙离子内流速度随时间推移显著加快,并且细胞凋亡率显著增加,以上结果均提示H2O2引起ERS 细胞凋亡的发生,即ROS/ERS模型构建成功。
内质网是细胞的钙库,Ca2+是重要的第二信使,参与细胞增殖、分化和凋亡等生物学过程[17]。同时内质网的蛋白质合成、折叠、组装和钙离子贮存等功能是细胞命运决定的关键因素。GRP78 是伴侣蛋白,在蛋白质的折叠和组装中发挥关键作用,负责UPR 迅速启动,并作为内质网稳态的主要调节因子。PERK/eIF2α/ATF4/CHOP信号通路是调控ERS的3 个主要通路之一[18],同时也是调控成骨细胞分化和骨形成的主要信号通路之一[19]。
PERK 是内质网膜上的跨膜蛋白,PERK 基因敲除小鼠出现骨骼缺陷包括成骨细胞数量不足、成骨细胞分化矿化受损、Ⅰ型胶原分泌减少、骨质疏松和异常致密骨发育等[20-21];在生理条件下PERK 处于无活性状态,与内质网中含量最丰富的分子伴侣GRP78 结合形成稳定的复合物,UPR 时PERK 与GRP78 解离,游离GRP78 与内质网中蛋白结合,增强内质网的蛋白质折叠能力,缓解ERS;然而反应是有限的,当未折叠或错误折叠蛋白质过度堆积,机体为保护其他细胞的正常功能启动凋亡路径[4,22]。游离PERK 引起下游eIF2α 磷酸化导致蛋白翻译水平整体下降或者停止,但诱导ATF4 的优先翻译和合成,ATF4 也是成骨细胞的关键调控因子[23-25],进而激活其下游转录因子C/EBP 同源蛋白CHOP 的转录,CHOP 是启动应激凋亡通路的关键蛋白,最终导致细胞凋亡。本实验中H2O2处理后PERK、eIf2α、ATF4 和CHOP mRNA 转录水平和蛋白相对表达量均显著增加,表明该信号通路在UMR-106 细胞的ERS凋亡中起重要作用。
SU 等[26]发现叶酸可能通过抑制ERS 减少成骨细胞凋亡,MENG 等[27]发现褪黑素通过eIF2α/ATF4通路的激活诱导hFOB 1.19 细胞凋亡,而POSTN 可能通过抑制eIF2α/ATF4通路保护成骨细胞;LI等[28]发现OVX小鼠中增强eIF2α磷酸化可引起骨密度和骨体积分数的增加。GSK2606414 是PERK 的选择性抑制剂,可通过抑制PERK 磷酸化和降低PERK含量,阻碍下游ATF4 和CHOP 的激活,广泛用于验证PERK 信号通路在各种疾病模型中的作用[29]。本实验中GSK2606414 干预后ROS 含量和细胞凋亡率均显著降低,PERK、eIf2α、ATF4 和CHOP mRNA 转录水平和蛋白相对表达量出现不同程度的下降;上述结果表明减轻ERS 可能在保护成骨细胞对抗PMOP中发挥关键作用。
健骨颗粒是治疗PMOP 的验方,主要由淫羊藿、山茱萸、党参、淮山药和煅狗骨等组成,具有补肾健脾、强筋健骨之功效,临床效果显著。课题组前期系列研究发现:健骨颗粒可能通过调节与成骨细胞分化相关的6 个靶蛋白相对表达量,增强去卵巢大鼠成骨细胞分化能力以发挥治疗作用[30];通过p38MAPK 信号通路调控成骨细胞增殖[31];健骨颗粒氯仿萃取部位调控BMP2/Smad1/Runx2/Osterix 通路促进成骨细胞分化[32-33]。本实验结果显示:健骨颗粒干预可显著降低ROS 含量和细胞凋亡率,PERK、eIf2α、ATF4和CHOP mRNA 转录水平和蛋白相对表达量不同程度降低;提示健骨颗粒可通过调控PERK/eIf2α/ATF4/CHOP 信号通路减轻过度的ERS,从而降低UMR-106 细胞凋亡率,发挥成骨细胞保护作用。
综上所述,调控PERK/eIf2α/ATF4/CHOP 信号通路可能是健骨颗粒治疗PMOP的潜在作用机制之一;但本实验仅限于体外细胞实验,存在一定的局限性,后续还需要进一步的动物实验来验证该作用机制。

