基于SDF-1/CXCR4轴探讨补肾壮筋汤促进小鼠BMSCs归巢和保护关节软骨的机制研究
黄艳峰,马德尊,付长龙,叶锦霞,黄云梅,李西海
1 福建中医药大学中西医结合研究院,福建 福州 350122;
2 福建省中西医结合老年性疾病重点实验室,福建 福州 350122;
3 福建中医药大学中西医结合学院,福建 福州 350122
膝骨关节炎(knee osteoarthritis,KOA)是一种以软骨退变为主要病理特征,影响整个关节结构,导致关节畸形及功能丧失的疾病[1]。由于软骨组织缺乏神经、血管等营养供应,一旦发生退变,便很难实现再生修复,致使KOA的有效治疗严重受到阻碍[2]。
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)因其具备成软骨、成骨等多向分化的特点,被认为是一种适用于骨组织工程学研究的种子细胞[3-4]。当组织损伤后,BMSCs可通过归巢的方式募集到损伤处参与修复[5-6]。其中,趋化因子在BMSCs 归巢中起关键作用,尤其是基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1)可通过与CXC 趋化因子受体4(cxc chemokine receptor type 4,CXCR4)结合形成SDF-1/CXCR4 趋化轴,被认为是迄今为止动员BMSCs归巢最有效的趋化轴之一[7-8]。
当组织受到损伤后,损伤部位上调的SDF-1 结合CXCR4 可有效动员、趋化、引导BMSCs 募集至损伤处进行再生修复[9-10],其机制主要与动员调控生长因子、黏附分子、集落刺激因子、金属蛋白酶(matrix metalloproteinase,MMPs)等有关[11-12]。但在损伤晚期,体内持续趋化能力会降低,难以引导足够数量的BMSCs到达受损区域[13],然而,相关研究发现,中医药治疗可以激活SDF-1/CXCR4 趋化轴促进BMSCs归巢修复软骨损伤[14]。
KOA 属于中医学“痹证”范畴,肝肾亏虚,则筋骨失荣,治宜补益肝肾、强筋壮骨[15]。补肾壮筋汤最早出自清代《伤科补要》,具有补益肝肾、强壮筋骨的功效[16]。BMSCs 是骨髓中主要细胞,属于中医“髓”范畴,肾精充足,则骨髓生化有源,骨坚筋强;肾精匮乏,则骨髓化生无源,骨痿筋弱[17]。课题组前期研究发现,补肾壮筋汤对软骨细胞具有保护作用,可促进软骨细胞增殖,抑制软骨基质稳态失衡,有效缓解肝肾亏虚型KOA 症状,改善关节功能[18]。但目前补肾壮筋汤在促进BMSCs 归巢和保护关节软骨方面尚未报道。因此,本课题拟采用软骨损伤模型模拟软骨退变,通过体内、体外实验证明补肾壮筋汤调控归巢相关因子,促进退变软骨修复,为KOA的康复治疗提供实验依据。
1 实验材料
1.1 实验动物
8 周龄SPF 级C57BL/6 雄性小鼠30 只,体质量(25±5)g,用于动物实验;4周龄SPF级GFP C57BL/6雄性转基因小鼠10 只,体质量(20±5)g,用于提取原代BMSCs。所有动物均购自上海斯莱克实验动物有限公司[生产许可证:SCXK(沪)2022-0004],饲养于福建中医药大学实验动物中心[使用许可证:SYXK(闽)2019-0007],每笼5只饲养,12 h/12 h的光照/黑暗周期交替,21~22 ℃室温饲养,本研究已通过福建中医药大学动物伦理委员会审核通过(审批号:FJTCM IACUC 2021046)。
1.2 实验药物
补肾壮筋汤中药饮片购自福建中医药大学附属第三人民医院中药房,药物组成:熟地黄12 g,当归12 g,山茱萸12 g,茯苓12 g,续断12 g,杜仲10 g,白芍10 g,牛膝10 g,五加皮10 g,青皮5 g。药物经冷凝回流法提取制备成浓缩液。
1.3 主要实验试剂
异氟烷购自深圳瑞沃德公司;4%多聚甲醛购自北京赛国生物科技公司;HE 染色试剂盒购自北京索莱宝公司;RNA 提取试剂盒购自北京天根生化科技有限公司;逆转录试剂盒购自南京诺唯赞生物科技有限公司;蛋白提取试剂盒购自上海碧云天有限公司;SDF-1、G-CSF、VEGF、GAPDH 抗体均购自美国Abcam有限公司;CXCR4、NCAM-1抗体均购自武汉Proteintech 公司;IgG(H+L)HRP 购自上海玉博生物科技有限公司;小鼠BMSCs 培养基购自上海OriCell公司;胎牛血清购自美国Gibco公司;CD105、CD44、CD34均购自美国Biolegend公司;RNAi-Easy-慢病毒购自上海吉凯基因有限公司;MMP-2 抗体、荧光二抗均购自美国CST有限公司。
1.4 主要实验仪器
小动物micro-CT 购自美国PerkinElmer 公司;RNA 定量系统购自美国Thermo Scientifi 公司;实时荧光定量PCR 仪、电泳仪、全能型成像系统均购自美国Bio-Rad 公司;激光共聚焦显微镜购自于德国蔡司公司;流式细胞仪购自于美国BD 公司;酶标仪购自于美国Thermo Fisher公司。
2 实验方法
2.1 动物实验
2.1.1小鼠软骨损伤模型制备及分组与干预 取8 周龄C57BL/6 雄性SPF 级小鼠30 只,采用随机数字表法分成假手术组、模型组、补肾壮筋汤组,每组10 只,使用异氟烷麻醉后,除假手术组外,其余2 组采用环状打孔法构建软骨损伤模型[19-20]。假手术组和模型组给予0.9%生理盐水灌胃1 mL/(100 g·d),补肾壮筋汤组给予补肾壮筋汤灌胃1 mL/(100 g·d),3组均干预12周,1次/d。
2.1.2关节组织形态学观察 ① micro-CT 观察软骨损伤情况:动物麻醉后,仰卧膝关节伸直位固定,选择90 kV 电压,88 μA 电流,调整合适角度进行CT平扫,结束后选择Sub:4.788 mm 区间进行局部放大处理,并在局部病损部位进行矢状位切片观察。② HE 染色观软骨损伤情况:3 组膝关节用4%多聚甲醛固定24 h,经EDTA-2Na 脱钙4 周制备石蜡切片,按照HE 试剂盒步骤在苏木精染色液中浸泡1 min,分化液清洗10 s,在蒸馏水中返蓝10 min,伊红染色液浸泡30 s,蒸馏水快速冲洗,乙醇脱水后封片。在显微镜下观察各组软骨组织病理学变化。
2.1.3关节组织中SDF-1 荧光表达情况 将关节组织切片经脱蜡处理后,依次进行柠檬酸钠抗原高温修复,0.5%曲拉通透膜,5%BSA 封闭30 min,滴加SDF-1(1∶200)抗体过夜孵育,清洗后滴加荧光同源二抗IgG Fab2(555)(1∶1 000)孵育,激光共聚焦显微镜下观察3组细胞SDF-1荧光表达情况。
2.1.4补肾壮筋汤干预后归巢关键调控因子的变化 ① qPCR 检测SDF-1、CXCR4、MIP-1α、MCP-1、MIP-1β、RANTES、VEGF、G-CSF、NCAM-1、MMP-2的mRNA 转录水平:按RNA 提取试剂盒实验步骤,将提取的组织总RNA 上机检测RNA 纯度与浓度;按逆转录试剂盒实验步骤配制逆转录体系进行逆转录反应;按照Hiscript®Ⅱ试剂盒步骤,提前合成相关基因引物并按照说明书配成10 μmol/L,引物序列见表1,热循环条件按:94 ℃,5 min;94 ℃,10 s;55℃,15 s;72 ℃,10 s 循环32 次;72 ℃,5 min;以GAPDH 为内参,采用2-ΔΔct计算各目的基因mRNA转录水平。② Western blot 检测SDF-1、CXCR4、GCSF、VEGF、NCAM-1、MMP-2 蛋白相对表达量:提取3组软骨组织总蛋白后按BCA定量试剂盒测定蛋白浓度,配制10%分离胶进行电泳,400 mA恒流、4 ℃转膜,常温封闭2 h,一抗GAPDH(1∶5 000)、SDF-1(1∶1 000)、CXCR4(1∶1 000)、G-CSF(1∶1 000)、VEGF(1∶1 000)、NCAM-1(1∶5 000)、MMP-2(1∶1 000)4 ℃过夜敷育,次日二抗IgG(H+L)HRP 二抗(1∶5 000)常温孵育1 h,滴加ECL 化学发光液于凝胶成像系统拍照,Image Lab软件定量分析条带灰度值。
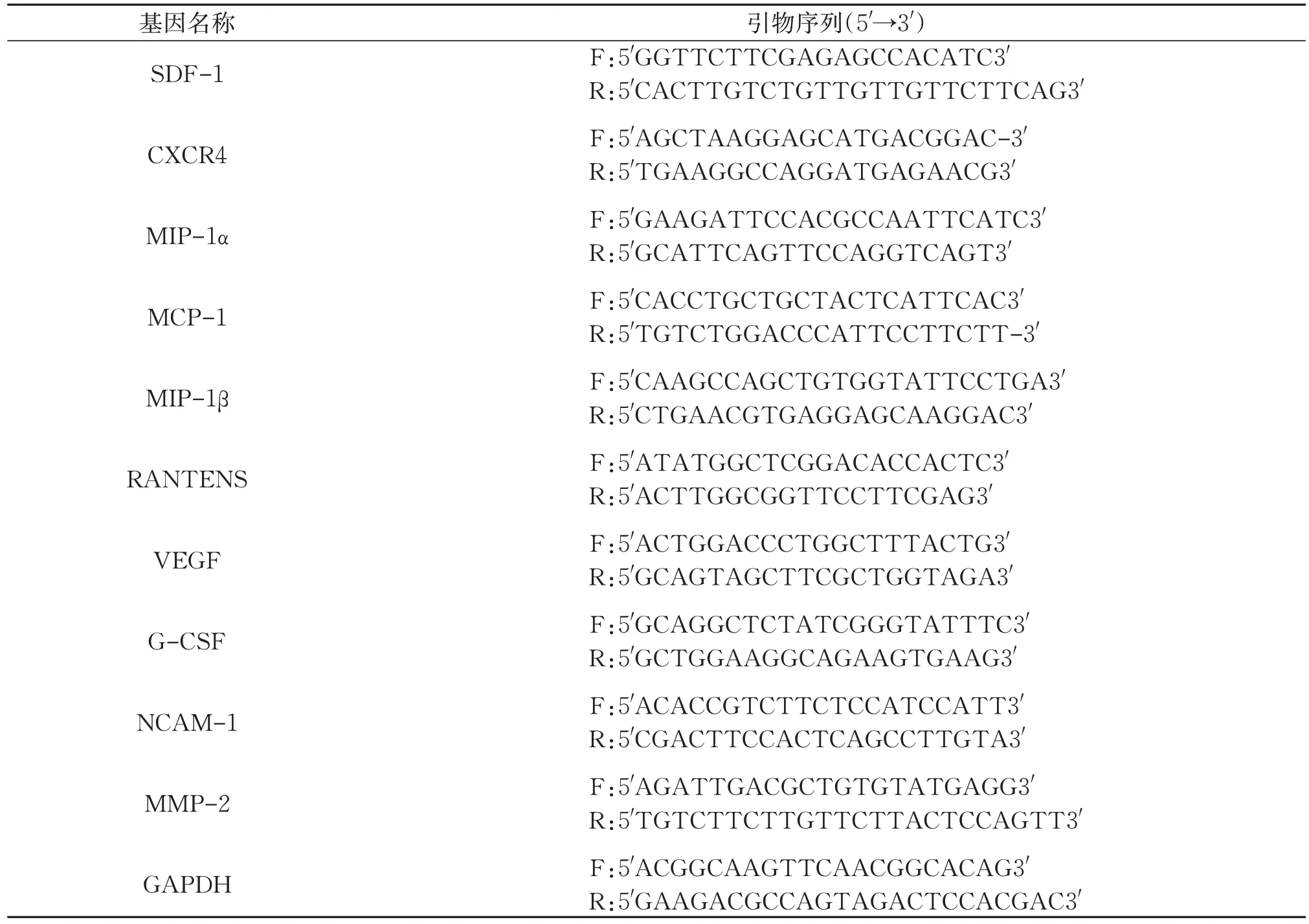
表1 相关基因引物序列Table 1 Related gene primer sequences
2.2 细胞实验
2.2.1BMSCs 的提取与鉴定 采用全骨髓贴壁法[21]提取BMSCs,取生长状态良好的第2 代BMSCs制成单细胞悬液;PBS 洗涤后,依次加入CD105、CD44、CD34 抗体,4 ℃孵育30 min;离心后PBS 再次洗涤后于流式细胞仪上机检测BMSCs阳性率。
2.2.2SDF-1慢病毒转染 第2代BMSCs 待细胞密度达到40%~60%时再加入慢病毒悬液,感染复数(MOI)设为10、50、100、150,低糖培养基培养16 h后更换为小鼠骨髓间充质BMSCs 培养基,72 h 后将6 孔板置于荧光显微镜下观察荧光表达情况,以荧光强度覆盖80%,且不影响细胞形态为佳,转染成功后的细胞在荧光显微镜下呈现绿色荧光。
2.2.3细胞分组与干预 取第2代BMSCs随机分为空白组、空载组、补肾壮筋汤组、sh-SDF-1 组、sh-SDF-1+补肾壮筋汤组5 组。空白组和空载组予以小鼠BMSCs 培养基培养,空载组同时加入空载病毒;补肾壮筋汤组予以BMSCs 完全培养基+补肾壮筋汤200 μg/mL;sh-SDF-1 组予以BMSCs 完全培养基+SDF-1 慢病毒;sh-SDF-1 组+补肾壮筋汤组予以BMSCs 完全培养基+SDF-1 慢病毒+补肾壮筋汤200 μg/mL;参照前期实验基础,每组均干预8 h后进行后续实验[22]。
2.2.4划痕实验观察5 组BMSCs 迁移能力 将第2 代细胞悬液按1×105/mL 浓度均匀铺到6 孔板中,在37 ℃含5%CO2培养箱中培养24 h,用100 μL枪头以6 孔板的板盖或者直尺为媒介每孔均匀划5 条直线,PBS清洗后按照“2.2.3”所述进行干预,光学显微镜下拍照并记录。
2.2.5阿利新蓝和免疫细胞化学染色检测5组成软骨分化能力 取对数生长期的细胞,按照1×105/mL的细胞密度接种至6 孔板中,按照“2.2.3”所述进行干预后,每2~3 d 更换成软骨诱导培养基,培养约3周。① 阿利新蓝染色:细胞经PBS 清洗后,滴加A 试剂室温反应30 min,流水洗涤5 min,滴加试剂B 室温反应10 min,流水洗涤1 min 后脱水封片,比较5 组阳性表达率。② Collagen Ⅱ免疫细胞化学染色:4%多聚甲醛室温固定、0.5% Triton 室温通透、3%H2O2室温孵育、5% BSA 室温封闭、Collagen Ⅱ抗体孵育(1∶200),4 °C过夜、二抗室温反应、DAB 室温浸润显色、苏木素复染30 s、PBS 返蓝处理、脱水封片后,比较5组Collagen Ⅱ蛋白相对表达量。
2.2.6检测补肾壮筋汤对归巢关键调控因子的影响 ① 激光共聚焦显微镜观察5 组SDF-1、CXCR4荧光表达情况:细胞干预结束后,加入4%多聚甲醛室温固定30 min,PBS 清洗,加入0.5%曲拉通透膜,5%BSA 血清封闭,加入SDF-1、CXCR4 荧光蛋白抗体过夜孵育(1∶200),荧光二抗IgG Fab2(555、488)(1∶1 000)结合反应,PBS清洗,共聚焦显微镜下观察各组细胞SDF-1、CXCR4 荧光表达情况。② qPCR检测5 组SDF-1、CXCR4、G-CSF、VEGF、NCAM-1、MMP-2 的mRNA 转录水平:提取的细胞总RNA 上机检测RNA 纯度与浓度;参照“2.1.5”实验步骤及引物序列,置于7500 Fast PCR仪上机检测。
2.3 统计学分析
使用SPSS 26.0 软件对实验数据进行统计学处理。计量资料数据服从正态分布的用(±s)表示,数据不服从正态分布的则采用中位数(四分位数间距)表示。采用单因素方差分析进行组间比较,若组间差异有统计学意义,则进一步采用LSD-t法或Games-Howell 法进行两两比较。P<0.05 为差异有统计学意义。
3 动物实验结果
3.1 3组关节软骨形态学比较
micro-CT 显示:假手术组股骨关节面光滑平整,骨皮质完整,弧度圆润,HE 染色见软骨细胞排列有序;与假手术组对比,模型组股骨髁间可见一圆形缺损,骨皮质缺损失连(红色箭头标记处),HE染色见软骨细胞缺失;与模型组对比,补肾壮筋汤组股骨髁间环形缺损较小,大部分骨皮质连接正常,但仍有部分失连,软骨细胞稍紊乱。见图1。
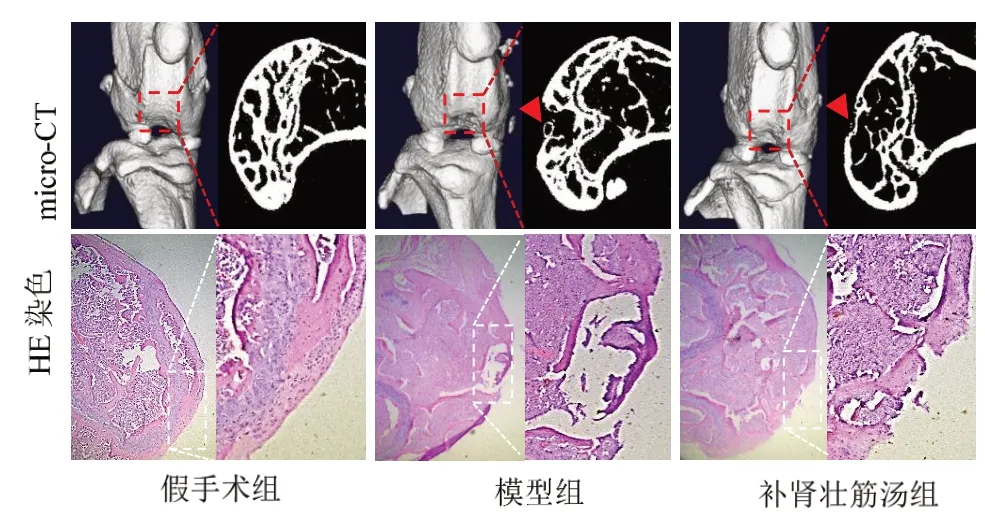
图1 3组软骨损伤修复情况比较(×200)Figure 1 Comparison of three groups of cartilage injury repair (×200)
3.2 3组关节软骨SDF-1荧光强度比较
与假手术组对比,模型组损伤处软骨细胞缺失严重,排列紊乱,SDF-1 的荧光蛋白表达升高(P<0.05);与模型组对比,补肾壮筋汤组软骨细胞增多,排列稍紊乱,SDF-1 的荧光蛋白表达显著升高(P<0.05)。见图2。
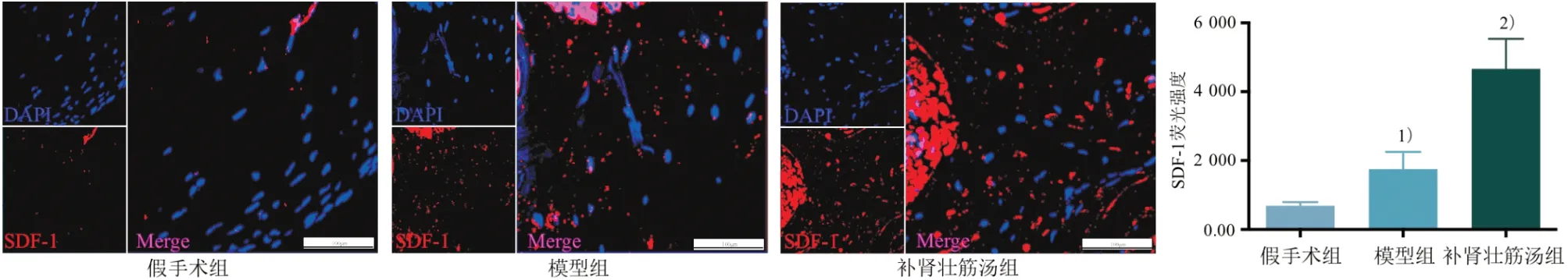
图2 3组关节软骨SDF-1荧光强度比较(×200)Figure 2 Comparison of fluorescence intensity of SDF-1 in three groups of articular cartilage (×200)
3.3 3 组关节软骨损伤中归巢相关调控因子的mRNA转录水平比较
与假手术组对比,模型组趋化因子SDF-1、CXCR4、MIP-1α、MCP-1、MIP-1β、RANTES、生长因子VEGF、集落刺激因子G-CSF、黏附分子NCAM-1、基质金属蛋白酶MMP-2 的mRNA 转录水平升高(P<0.05);与模型组对比,补肾壮筋汤组SDF-1、CXCR4、MIP-1α、MCP-1、MIP-1β、RANTES、VEGF、G-CSF、NCAM-1、MMP-2的mRNA转录水平升高(P<0.05)。见图3。
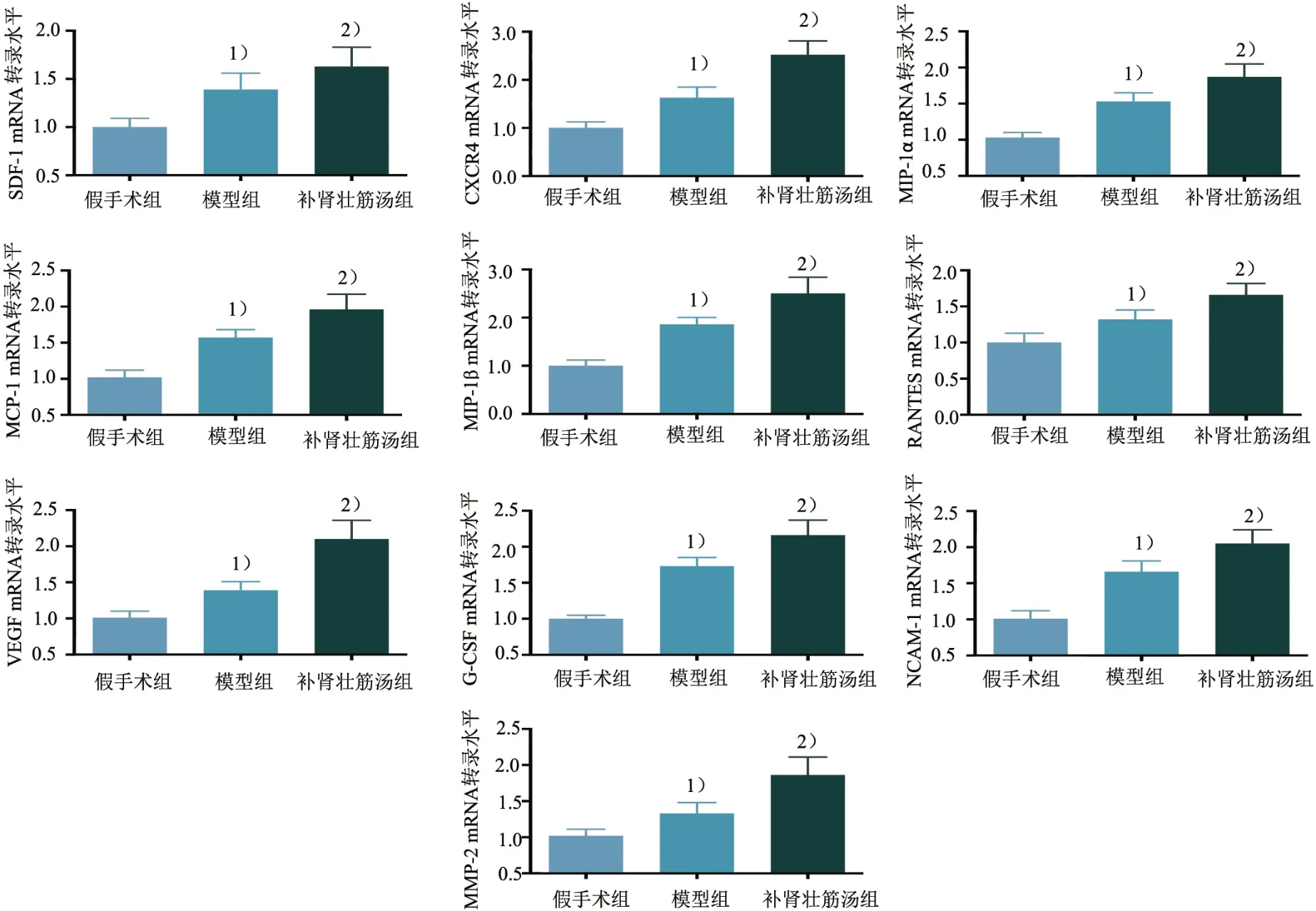
图3 3组归巢相关调控因子mRNA转录水平比较Figure 3 Comparison of mRNA transcription level of three homing related regulatory factors
3.4 3 组关节软骨归巢相关因子蛋白相对表达量比较
与假手术组比较,模型组趋化因子SDF-1、CXCR4、集落刺激因子G-CSF、生长因子VEGF、黏附分子NCAM-1、基质金属蛋白酶MMP-2的蛋白相对表达量升高(P<0.05);与模型组比较,补肾壮筋汤组SDF-1、CXCR4、G-CSF、VEGF、NCAM-1、MMP-2 的蛋白相对表达量升高(P<0.05)。见图4。
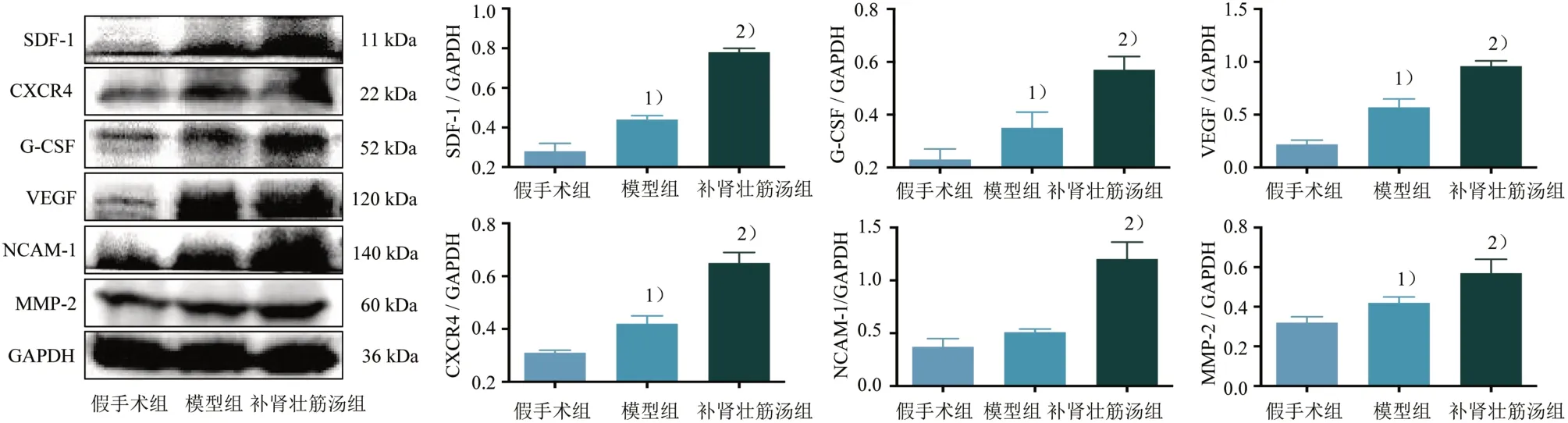
图4 3组归巢相关调控因子蛋白相对表达量比较Figure 4 Comparison of protein expression level of three homing related regulatory factors
4 细胞实验结果
4.1 BMSCs鉴定及慢病毒转染情况
第2代BMSCs经细胞流式术鉴定:CD105、CD44呈阳性表达,CD34 呈阴性表达。见图5A。慢病毒MOI 值为100 时,SDF-1 基因转导的第2 代BMSCs感染效率最高,且细胞状态未受到明显影响,在双转盘激光共聚焦显微镜下可观察到较强的绿色荧光。见图5B。
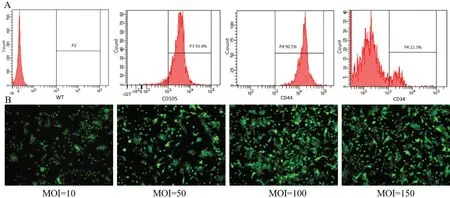
图5 BMSCs鉴定及慢病毒转染情况(×100)Figure 5 Identification of BMSCs and lentivirus transfection status (×100)
4.2 5组BMSCs迁移能力比较
与空白组比较,sh-SDF-1组细胞向划痕区域迁移的细胞数量显著减少,而补肾壮筋汤组细胞迁移数量显著增多;与sh-SDF-1 组比较,补肾壮筋汤组和sh-SDF-1+补肾壮筋汤组细胞迁移数量显著增多。见图6。

图6 5组BMSCs迁移能力比较(×100)Figure 6 Comparison of migration ability in five groups of BMSCs (×100)
4.3 5组BMSCs成软骨分化能力比较
与空白组比较,sh-SDF-1 组酸性黏多糖和CollagenⅡ蛋白表达显著减少,而补肾壮筋汤组酸性黏多糖和CollagenⅡ蛋白表达显著增强(P<0.05);与sh-SDF-1 组比较,补肾壮筋汤组和sh-SDF-1+补肾壮筋汤组酸性黏多糖和CollagenⅡ蛋白表达均显著增强(P<0.05)。见图7。
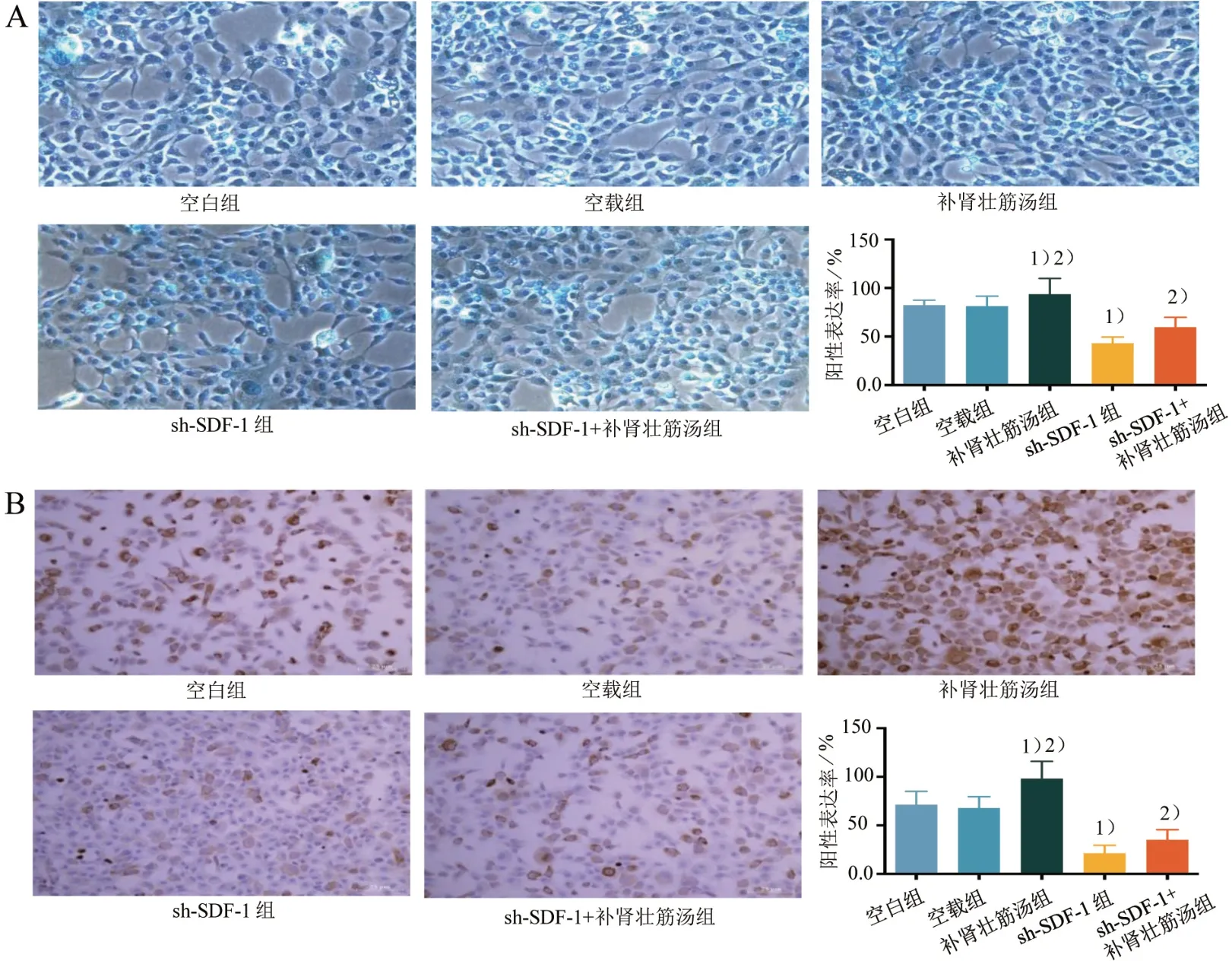
图7 5组BMSCs的成软骨分化能力比较(×100)Figure 7 Comparison of chondrogenic differentiation ability in five groups of BMSCs (×100)
4.4 5组BMSCs中SDF-1、CXCR4荧光强度比较
与空白组对比,sh-SDF-1 组SDF-1、CXCR4 蛋白表达显著降低(P<0.05),补肾壮筋汤组的SDF-1、CXCR4 蛋白表达显著增强(P<0.05);与sh-SDF-1组对比,补肾壮筋汤组和sh-SDF-1+补肾壮筋汤组的SDF-1、CXCR4 蛋白表达显著增强(P<0.05)。见图8。
4.5 5 组BMSCs 中归巢相关调控因子的mRNA 转录水平比较
与空白组对比,sh-SDF-1 组趋化因子SDF-1、CXCR4、集落因子G-CSF、生长因子VEGF、黏附分子NCAM-1、基质金属蛋白酶MMP-2 的mRNA 转录水平降低(P<0.05),而补肾壮筋汤组SDF-1、CXCR4、G-CSF、VEGF、NCAM-1、MMP-2 的mRNA 转录水平升高(P<0.05);与sh-SDF-1 组对比,补肾壮筋汤组和sh-SDF-1+补肾壮筋汤组的SDF-1、CXCR4、G-CSF、VEGF、NCAM-1、MMP-2 的mRNA转录水平升高(P<0.05)。见图9。
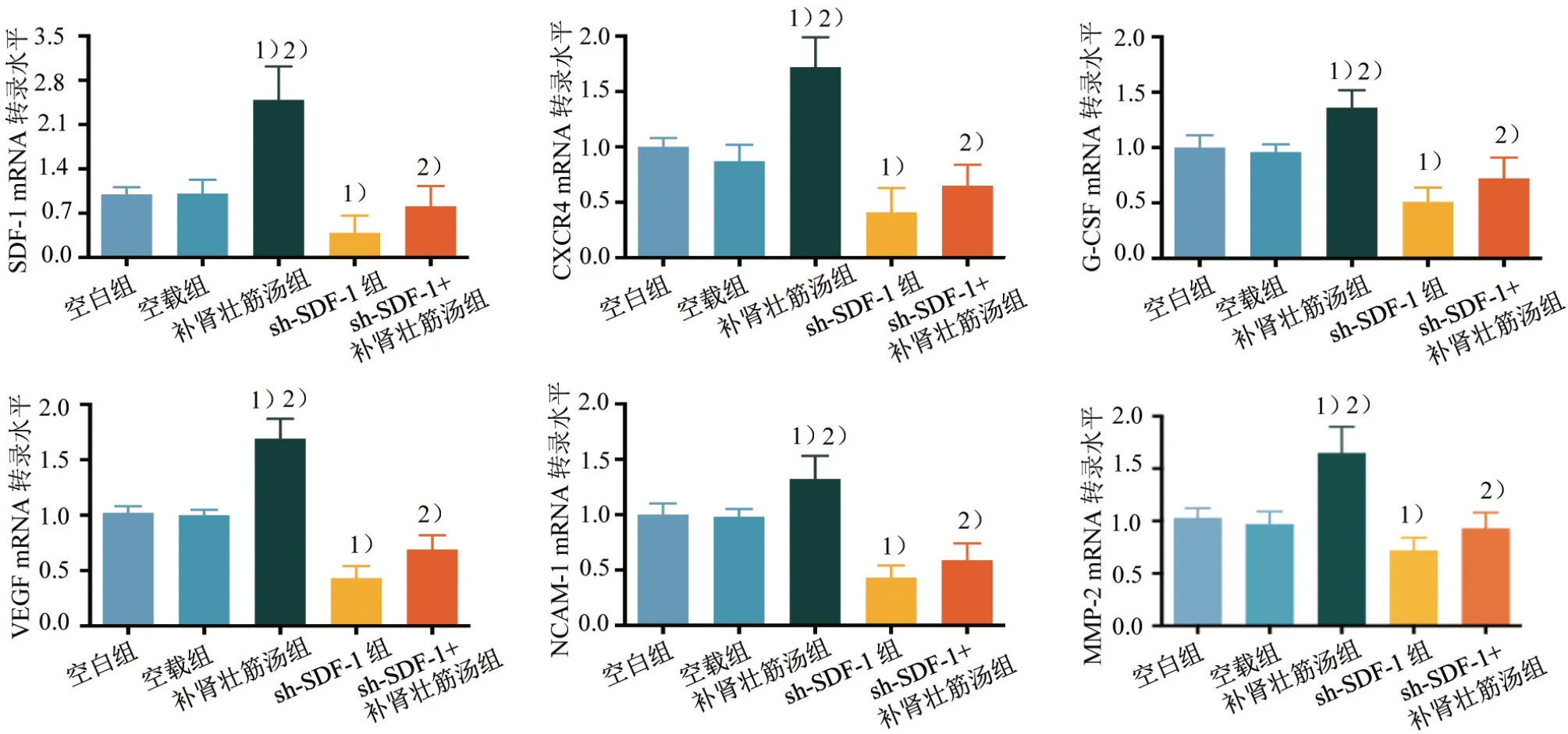
图9 5组BMSCs中归巢相关调控因子的mRNA转录水平比较Figure 9 Comparison of mRNA transcription level of homing related regulatory factors in five groups of BMSCs
5 讨 论
本研究从动物影像学和形态学层面证明了补肾壮筋汤可促进软骨缺损修复,并与趋化轴调控的归巢关键因子有关;继而对BMSCs 趋化轴关键基因——SDF-1 基因进行慢病毒敲减,结果显示,SDF-1基因敲减后BMSCs 迁移、成软骨分化及归巢能力一致降低,但通过补肾壮筋汤干预后可逆转这些现象。这些结果表明,补肾壮筋汤可通过调控趋化轴促进BMSCs归巢修复关节软骨损伤,可为KOA的康复治疗提供实验依据。
5.1 补肾壮筋汤促进BMSCs修复KOA软骨退变
KOA 属于中医学“痹证”范畴,与肝、肾关系密切,补肾壮筋汤出自清代《伤科补要》,具有补益肝肾、强壮筋骨功效[16],全方以山茱萸、熟地黄为君药,阴阳互补,补肾柔肝、强筋骨;佐以杜仲、续断、五加皮祛风湿、强筋骨;白芍敛阴和营、柔肝止痛,当归补血活血,青皮行气疏肝,茯苓健脾和胃、化痰除湿;牛膝补益肝肾、强筋壮骨、活血通经,引药下行,直达病所,诸药合用标本兼治,共奏补益肝肾、强壮筋骨的功效。而BMSCs 源于骨髓腔,与肝、肾关系密切,相关学者认为肝、肾精血是BMSCs 的物质基础,通过滋补肝肾的方式可促进BMSCs 的增殖分化[23]。本研究采用软骨缺损模型模拟KOA 软骨退变剥脱,通过micro-CT 及HE 验证了补肾壮筋汤可促进软骨退变的修复,同时通过划痕及成软骨分化实验证明了补肾壮筋汤可促进BMSCs 的迁移和成软骨分化能力。因此,软骨退变的修复主要与补肾壮筋汤促进了BMSCs功能有关。
5.2 补肾壮筋汤上调SDF-1/CXCR4 轴促进BMSCs归巢
在正常情况下,骨髓和BMSCs 维持着一种动态平衡,即少量BMSCs 不断离开骨髓,巡回在外周组织,大多数BMSCs 在体内骨髓腔微环境中保持相对静止,直到机体遭受损伤需要更多细胞来维持组织功能而被激活[24]。在损伤后,BMSCs 会主动退出生态位,在趋化因子等的驱动下,募集归巢到损伤处并广泛增殖、自我更新和分化,以再生丢失的组织,但面对修复时间较长的损伤,其归巢再生能力往往不足[25]。研究表明,有效动员SDF-1/CXCR4 趋化轴可有效引导BMSCs 募集至损伤处进行再生修复[9-10]。当BMSCs 被调动并迁移到损伤部位后,需要BMSCs 表达细胞黏附分子与细胞外基质表达的黏附分子配体相结合,通过在血管内皮细胞上附着迁移,加上MMPs协助分解基底膜进行跨膜转运,并利用集落因子、生长因子等协同作用,完成BMSCs在受损部位的定植[26]。
本研究通过动物实验发现补肾壮筋汤可促进损伤区域CXC 趋化因子SDF-1 蛋白表达,接着进一步检测了SDF-1 及受体CXCR4 和归巢密切相关的CXC 趋化因子家族中同类型配体MIP-1α、MCP-1、RANTES、CC 趋化因子家族中配体MIP-1β,生长因子VEGF、集落刺激因子G-CSF、黏附分子NCAM-1及金属蛋白酶MMP-2 的mRNA 转录水平,结果呈现一致性升高,并通过蛋白进一步验证得到了同样的结果。基于此,进而细胞实验对BMSCs 进行SDF-1 慢病毒敲减,结果表明:补肾壮筋汤可逆转SDF-1 基因敲减后的SDF-1、CXCR4、VEGF、G-CSF、NCAM-1、MMP-2 的mRNA 和蛋白表达。综上,本实验证明补肾壮筋汤可通过上调SDF-1/CXCR4 轴促进小鼠BMSCs 归巢来修复关节软骨退变。但本研究结果只停留在表观层面,仍具有许多局限,如机制层面深入不足,补肾壮筋汤具体是哪些成分起的修复作用,SDF-1/CXCR4 趋化轴促进BMSCs 归巢后通过什么渠道实现软骨退变修复,以及补肾壮筋汤药物浓度设计不足等方面还有待后续进一步研究。

