单绒毛膜双羊膜囊双胎妊娠减胎术后胎儿生长规律及围产结局分析
原鹏波 周文君 吴天晨 尹韶华 杨静 魏瑗 赵扬玉
单绒毛膜双羊膜囊(monochorionic diamniotic,MCDA)双胎是一种特殊类型的单卵双胎,其主要特征为两胎儿共用一个胎盘,绝大多数胎盘内存在广泛的血管吻合,由于两个胎儿的血流动力学不平衡及胎盘分占比例不均从而可能出现双胎输血综合征(twin to twin transfusion syndrome,TTTS)、选择性胎儿生长受限(selective intrauterine growth restriction, sIUGR)、动脉反向序列灌注(twin reversed arterial perfusion syndrome,TRAPs)、双胎贫血-多血质序列征(twin anemia-polycythemia sequence,TAPS)等并发症,导致胎儿宫内死亡、极早期早产或严重的新生儿并发症,围产儿死亡率是单胎妊娠的4倍[1]。多胎妊娠减胎术可改善上述并发症的胎儿预后。由于MCDA双胎存在胎盘之间血管吻合支,减胎手术不宜使用心脏内注射氯化钾,通常使用射频消融(radiofrequency ablation,RFA)、微波消融(microwave ablation,MWA)等热凝固方法或机械性的胎儿镜下脐带结扎术(umbilical cord ligation,UCL)进行减胎。无论何种减胎方式,总的胎儿存活率约为61%~79.1%[2-8]。理论上,在一胎死亡后,宫内拥挤环境得以改善,保留胎儿可能更有机会从母体胎盘吸收营养,但在临床实践中也观察到保留胎儿继发宫内生长受限甚至增加死亡风险[9]。目前,关于MCDA减胎术后保留胎儿在宫内生长发育情况的研究较少。本研究回顾性分析2016—2020年在北京大学第三医院行选择性减胎术的MCDA双胎孕妇资料,并匹配同期单胎妊娠及未干预的MCDA双胎孕妇资料,比较其在妊娠中晚期的胎儿生物学指标、围产期结局,以期明确保留胎儿在宫内的生长发育情况,为临床咨询提供依据。
对象与方法
一、研究对象
本研究以2016年1月至2020年12月在北京大学第三医院行选择性减胎术的MCDA双胎妊娠孕妇作为MCDA双胎减胎组,利用倾向性评分匹配方法,按照孕妇年龄、受孕方式、是否合并妊娠期高血压疾病、妊娠期高血糖等因素,匹配分娩日期相近(前后不超过30 d)的单胎以及未干预的MCDA双胎妊娠孕妇作为两个对照组。为获得足够数量的对照组,本研究设置匹配比例为1∶3,当符合要求的对照数量不足时,个别病例将匹配比例降低至1∶2或1∶1,倾向性评分匹配的卡钳值设置为0.02,使匹配后的三组孕妇年龄无统计学差异,受孕方式及母体合并症(是否合并妊娠期高血压疾病、妊娠期高血糖)均一致。
所有MCDA双胎均在早孕期超声诊断绒毛膜性,判断方法为:孕6~8周超声显示1个孕囊、2个胎芽,孕11~13周超声未见“双胎峰”。MCDA双胎减胎组为在本院通过MWA法或RFA法减灭一胎,减胎指征包括:TTTS、sIUGR、TRAPs、TAPS、双胎之一畸形等胎儿指征,以及因母体瘢痕子宫、高龄、经济困难等要求减胎的非胎儿指征。考虑到既往研究显示前述两种减胎方式在保留胎儿总体生存率及神经系统发育方面无明显差异[10],故本文不区分减胎方法,合并分析。
二、数据收集
1.一般资料:收集孕妇年龄、孕前体质指数(body mass index,BMI)、是否辅助生殖助孕(assisted reproductive technology,ART)、产次、妊娠期高血压疾病(hypertensive disorder in pregnancy,HPD)、妊娠期高血糖(hyperglycemia in pregnancy)及减胎孕妇的减胎孕周(gestational age at procedure,GA at procedure)。
2.孕期超声监测的胎儿生物指标:收集胎儿头围(head circumference,HC)、腹围(abdominal circumstance,AC)、双顶径(biparietal diameter,BPD)、股骨长(femur length,FL)及估测胎儿重量(estimated fetal weight,EFW)。所有孕妇均在12~13+6周进行首次生物学指标超声监测,单胎孕妇在22~23+6周、30~33+6周、36~38+6周分别复测,MCDA双胎自16~18周开始每2周复测,减胎术后每2~4周复测。
3.妊娠结局:收集新生儿是否活产、是否发生未足月胎膜早破(preterm premature rupture of membranes,PPROM)、分娩方式、产后出血、分娩孕周、新生儿出生体重、低出生体重(low birth weight,LBW)、极低出生体重(very low birth weight,VLBW)、超低出生体重(extremely low birth weight,ELBW)、小于胎龄儿(small for gestational age,SGA)、巨大儿、是否转入NICU。
4.产后出血的诊断标准:胎儿娩出后24 h内,阴道分娩者出血量≥500 mL,剖宫产者≥1 000 mL;小于胎龄儿的诊断标准为:同胎龄出生体重<第10百分位数的新生儿,参照值引自李辉等[11]2020年的研究。
三、统计学方法
使用随机效应模型联合立方样条建立胎儿生长曲线,单胎妊娠和减胎孕妇使用二水平模型(水平1是超声检查,水平2是每名孕妇),未干预孕妇使用三水平模型(水平1是超声检查,水平2是双胎中的每一个胎儿,水平3是每名孕妇)。在立方样条中设置3个节点,分别位于声检查孕周(12至40+6周)的第25、第50和第75百分位数处。拟合的三个生长曲线模式之间的比较,使用似然比检验(likelihood ratio test,LRT)进行统计学检验。
结 果
一、一般资料分析
2016年1月至2020年12月,共收集资料完整的单胎孕妇25 304例(胎儿存活25 296例),MCDA双胎孕妇810例,其中685例未进行减胎的MCDA双胎孕妇(至少一胎儿存活者631例),其余125例符合减胎术指征行减胎术,术后保留胎儿存活者85例,活产率68%,为MCDA双胎减胎组。通过1∶1~1∶3匹配,最终纳入单胎妊娠孕妇171例作为单胎对照组、未减胎的MCDA双胎孕妇 165例作为双胎对照组。各组的孕妇一般资料详见表1,各组无统计学差异(P均>0.05)。其中,MCDA双胎减胎组的减胎孕周为(20.5±3.7)周。

表1 三组孕妇一般资料分析[M(P25~P75)Table 1 General characteristics of pregnant women [M(P25-P75)]
二、孕期超声胎儿生物学指标结果比较
将三组孕妇的所有孕期超声胎儿生物学指标数据(监测频率如前所述)进行统计分析,并将这些数据通过对数转化,使用随机效应模型联合立方样条建立胎儿生长曲线(见图1)。似然比检验显示,单胎对照组的EFW、AC、FL、BPD及HC均大于MCDA双胎减胎组和双胎对照组,MCDA双胎减胎组的AC大于双胎对照组(P均<0.001),其余指标与双胎对照组无明显差异(P均>0.05),即减胎组除AC以外的各项胎儿生物学指标均与未干预的双胎对照组无明显差异。图1中所示的减胎组与双胎对照组的EFW、FL、BPD及HC差异非常小,曲线几乎重合。在所建立的胎儿生长曲线中,选择32周(极早产的临界孕周)和37周(早产临界孕周)两个节点的数据进行展示,详见表2。

图1 胎儿宫内发育的头围、腹围、双顶径、股骨长及估测胎儿体重趋势图Figure 1 Trends in fetal HC、AC、BPD、FL and EFW during intrauterine development

表2 三组孕妇不同孕周超声测量胎儿生物指标对比[M(P25~P75)]Table 2 Comparisons of fetal bio-indicators in different gestational age under ultrasound [M(P25-P75)]
三、围产期结局比较
MCDA双胎减胎组有10.6%发生PPROM,介于单胎对照组(3.5%)和双胎对照组(15.2%)之间,但与二者相比均无统计学差异(P′分别为0.023及0.319)。MCDA双胎减胎组的剖宫产比例(52.9%)显著低于双胎对照组(86.1%,P′<0.001),与单胎对照组(39.2%)相比无统计学差异(P′=0.037)。
MCDA双胎减胎组的分娩孕周为(37.1±2.7)周早于单胎对照组(38.8±2.2)周而晚于双胎对照组(34.0±2.8)周,且差异均具有统计学意义(P′均<0.001)。MCDA双胎减胎组在32周和34周之前的早产比例(5.9%和11.8%)低于双胎对照组(21.8%和46.7%),差异有统计学意义(P′=0.001和P′<0.001),但与单胎对照组相比无统计学差异(P′=0.378和P′=0.037)。MCDA双胎减胎组在37周前的早产比例(30.6%)低于双胎对照组(78.8%)而高于单胎对照组(7.6%),差异均具有统计学意义(P′均<0.001)。三组孕妇在产后出血比例的差异无统计学意义(P=0.085)。详见表3。
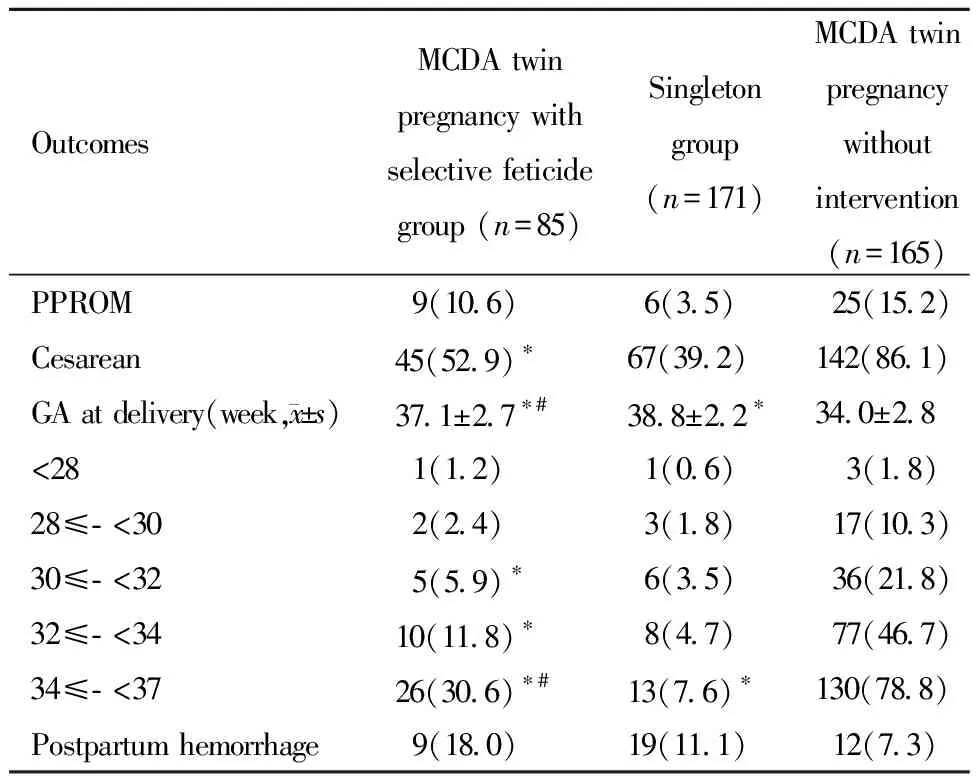
表3 三组孕妇围产期结局比较[例(%)]Table 3 Perinatal outcomes [n(%)]
MCDA双胎减胎组的新生儿出生体重(2 771.4±673.5)g大于双胎对照组(1 955.4±635.2)g,但小于单胎对照组(3 193.7±588.2)g,差异均具有统计学意义(P′ 均<0.001)。MCDA双胎减胎组新生儿为LBW比例(21.2%)介于单胎对照组(4.1%)和双胎对照组(52.5%)之间,均具有统计学意义(P′ 均<0.001),VLBW比例(5.9%)低于双胎对照组(18.4%,P′=0.005),而与单胎对照组(2.3%)无统计学差异(P′=0.147),ELBW比例与单胎对照组和双胎对照组均无统计学差异(P′=0.613和P′=0.034);MCDA双胎减胎组新生儿为SGA比例(16.5%)高于单胎对照组(4.7%,P′=0.002),但与双胎对照组(27.0%)差异无统计学意义(P′=0.045);MCDA双胎减胎组新生儿为巨大儿比例(1.2%)与单胎对照组(5.8%)及双胎对照组(0.3%)的差异均无统计学意义(P′=0.083和P′=0.305)。MCDA双胎减胎组新生儿转NICU比例(34.1%)高于单胎对照组(13.5%)而低于双胎对照组(65.9%),且差异均具有统计学意义(P′ 均<0.001)。详见表4。
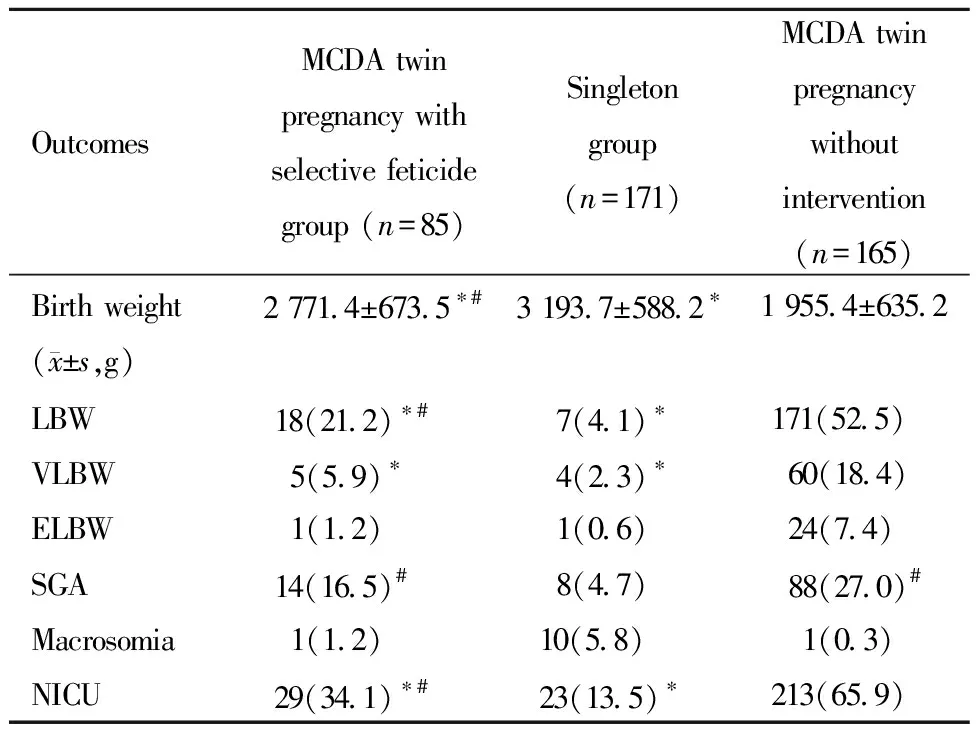
表4 三组新生儿结局比较[例(%)]Table 4 Neonatal outcomes [n(%)]
讨 论
本研究回顾性分析了MCDA双胎经射频消融或微波消融减胎术后的妊娠结局及新生儿结局。本研究中减胎组的活产率为68%,与国内外既往文献报道相接近(61%~79.1%)[2-8]。保留胎儿术后胎死宫内是最常见的手术并发症,绝大多数发生于术后1~2周,在本研究中97.5%(39/40)发生在术后24~48 h,与既往文献报道相符[6-8]。胎死宫内的确切机制尚不明确,猜测可能与消融手术中脐带血管阻断不完全导致保留胎儿血液经过压力差快速充盈至胎盘及减胎胎儿体内、造成保留胎儿循环血容量急速减少有关[12]。胎死宫内的发生率可能与减胎指征有一定关系,Wang等[5]研究认为,因TTTS-Ⅳ期进行减胎的胎儿总体存活率最低,而因胎儿腹壁缺损及Ⅲ型sIUGR进行减胎的术后24 h内胎儿死亡率可高达40%。
在临床实践中,减胎术后保留胎儿在安全度过术后48 h及术后2周之后,孕期的超声监测频率并没有统一结论,多数参考普通单胎的产检策略。减胎术后随着胎儿停止发育和逐渐吸收,宫内拥挤状态得到缓解,理论上另一胎儿可能更有机会从母体胎盘吸收营养,甚至出现生长追赶现象(该现象在出生之后更为明显)。但从本研究结果看来并非如此。通过对胎儿超声生物学指标的分析发现,本研究中保留胎儿在减胎之后的生长发育整体上与双胎对照组的生长曲线几乎一致,头围、双顶径、股骨长及估测胎儿体重的拟合曲线均与双胎对照组几乎完全贴合,仅在胎儿腹围这一指标与双胎对照组有显著差异,并向单胎对照组有一定趋近。这个结果表明,保留胎儿的整体生长趋势并未因减胎而发生变化,既没有逐渐接近于普通单胎的生长曲线,也没有表现出比双胎更明显的生长受限。因此,MCDA双胎的两个胎儿无论是否经历减胎,其在宫内获得的营养均较普通单胎低,不会因减胎这一因素改变其原有生长曲线。Rao等人报道MCDA双胎孕妇经RFA减胎后保留胎儿中小于胎龄儿的比例为33.3%(4/12)[13],显著高于本研究结果的16.5%,可能与其样本量较少(仅12例)相关。需要注意的是,不同研究可能对小于胎龄儿的诊断采用了不同的标准,可能会对结果有一定影响。
在获得活产新生儿的孕妇中,减胎组的分娩孕周均值为37.14周,显著早于单胎对照组的38.84周而晚于双胎对照组的33.99周,与既往文献报道的35~38周相符合[3, 7, 13-16];减胎组<34周早产的比例为11.8%,与单胎对照组的4.7%无明显差异,显著低于双胎对照组的46.7%,与Rao等研究中比例14.3%相近[13];<37周早产的比例为30.6%,显著高于单胎对照组的7.6%、低于双胎对照组的78.8%,与既往报道中发生率28.6%~34.8%相符合[5, 13]。双胎早产的原因可分为自发性早产(胎膜完整早产与胎膜早破)和医源性早产。本研究选择对照组时,已对妊娠期高血压疾病、妊娠期高血糖、辅助生殖助孕等因素进行了匹配,消除了这些背景因素可能引起医源性早产的干扰,但双胎妊娠本身可能导致的宫腔过度扩张、宫颈机能不全等自发性早产相关高危因素更可能是引起三组孕妇分娩孕周显著差异的独立危险因素,减胎手术在一定程度上改变了这个要素,延缓了子宫肌纤维的过度拉长和宫颈扩张,在一定程度上也降低了PPROM的发生率(15.2% 降低至10.6%),从而使得该组孕妇的分娩孕周介于另外两个对照组之间。另外,本研究中减胎组的PPROM比例低于既往文献报道(16.7%~25.7%)[14, 17-18],原因考虑可能为研究样本不同导致的选择偏倚(本研究选取的研究对象均为减胎后保留胎儿存活的病例,已排除了术后早期胎死宫内流产的病例)。
新生儿出生体重与分娩孕周及宫内营养状态相关。MCDA双胎减胎组的存活儿出生体重均值为2 771.4 g,与既往研究中MCDA双胎减胎后存活儿出生体重中位数2 662~3 075 g[5, 19]相近。在本研究中,MCDA双胎减胎组的新生儿出生体重显著低于单胎对照组的均值3 193.7 g而高于双胎对照组的1 955.4 g,这与前述三组的分娩孕周的差异是相符的。与之相对应,MCDA双胎减胎组的低出生体重儿、小于胎龄儿比例(分别为21.2%、16.5%)也明显高于单胎对照组(分别为4.1%、4.7%),低于双胎对照组(分别为52.5%和27.0%)。但如果分娩孕周更小、出生体重低于1 500 g,则三组之间的差异将变得越小,孕周对于出生体重的影响权重将更大。
在本研究中,减胎术后新生儿转入NICU比率为34.1%,显著高于单胎对照组的13.5%而低于双胎对照组的65.9%。Rao等人[13]报道MCDA孕妇经RFA减胎后保留胎儿转NICU比例为30%,与本研究基本相符。本研究中,减胎术后的早产发生率明显高于单胎对照组、低于双胎对照组,与转NICU的比例一致,转入NICU的新生儿可能合并其他原因,需进一步探讨,本研究中未涉及。Sandal等人报道其医院新生儿转NICU总体比例为 9.7%[20],Rozdarz等人研究结果示单胎妊娠转NICU总体比例为11.9%[21],均低于本研究结果。
本研究中使用一般资料(包括孕妇年龄、受孕方式、是否合并妊娠期高血压疾病、妊娠期高血糖等因素)对MCDA双胎减胎组和对照组进行了匹配,尽可能削弱了上述因素对胎儿宫内发育、孕妇围产期结局及新生儿结局的影响,但孕期其他因素(如合并自身免疫性疾病)也可能对这些结局产生影响,本研究并为对其进行分析,为本研究不足之处,需后续继续研究分析。
综上所述,本研究结果显示,MCDA双胎减胎后保留胎儿的活产率与近期的国内外研究结果相当。减胎术后保留胎儿的生长趋势同未减胎的MCDA双胎无明显差异,其围产结局主要与是否发生胎膜早破、早产有关。与未减胎的MCDA双胎孕妇相比,减胎术后存活新生儿的早产、低出生体重、小于胎龄儿和转NICU比例有一定程度降低,但与普通单胎相比仍较高,因此这一人群更应获得产科医师的关注,不应将其视为正常单胎妊娠进行处理,必要时增加产检、超声检查频率,更早进行胎心监护检查,加强孕期宣教,发现异常情况积极处理,尽可能改善新生儿结局。

