PGE2在环氧合酶-2抑制剂保护脓毒症肠屏障功能中的作用
刘志慧 张桂利△ 王燕燕 卢鼎 李淑凡 张存宇 王姣姣 张子怡
(1.包头市中心医院麻醉科,内蒙古 包头 014040;2.内蒙古科技大学包头医学院,内蒙古 包头 014040;3.内蒙古医科大学,内蒙古 呼和浩特 010100)
前列腺素E2(prostaglandin E2,PGE2)是花生四烯酸在磷脂酶A2、环氧酶(COX)和PGE2合酶(PGES)的顺序催化作用下产生的代谢产物,可由多种细胞合成。PGE2是重要的前列腺素类物质,是脓毒症诱导的免疫抑制的调节剂,是单核细胞促炎因子表达的抑制剂,是IL-10产生的诱导剂[1-2]。分布在小肠的主要是前列腺素E2,正常情况下,产生生理需要量的低水平前列腺素,可调节离子转运、肠分泌、细胞迁移和血管平滑肌的张力,抑制炎性细胞因子的表达,维持肠屏障功能和肠道内环境的稳定[3]。炎症时,COX-2转录诱导产生大量的前列腺素调节先天性免疫和适应性免疫[4]。COX-2的高表达是炎症性肠病[5-6]、坏死性小肠结肠炎[7]时导致肠屏障功能障碍的关键因素。有研究表明COX-2抑制剂对肠黏膜屏障具有保护作用[8-11]。精确地调控体内PGE2的合成和分解代谢,可明显改善脓毒症肠屏障功能,阻止PGE2介导的某些不利的细胞和生物学效应,可以明显提高生存率。因此,PGE2的调控可能是今后脓毒症治疗的一个重要手段。本实验拟利用CLP脓毒症大鼠模型探讨PGE2在环氧合酶-2抑制剂保护脓毒症肠屏障功能中的作用及机制。
1 材料与方法
1.1 实验动物与分组健康雄性Wistar大鼠(清洁级实验动物),18~20月龄,体重550~650 g,由中国军事医学科学院实验动物中心提供,动物合格证号:SCXK-(军)2012-0004。将大鼠按随机数字表法分为六组,假手术组、帕瑞昔布钠对照组、脓毒症组、帕瑞昔布钠治疗组、COX-2抑制剂组和帕瑞昔布钠-COX-2抑制剂组,每组8只。本实验经实验动物管理委员会批准,动物处置过程符合伦理学要求。
1.2 实验方法
1.2.1 脓毒症模型制备采用盲肠结扎穿孔法(cecal ligation and puncture,CLP)建立大鼠脓毒症模型[12,13]。假手术组和帕瑞昔布钠对照组进行相同的操作,不进行盲肠结扎和穿孔。各组大鼠术后经颈部皮下注射0.9%无菌生理盐水3 mL/100 g(37 ℃)进行液体复苏治疗,模型建立成功后20 min,经大鼠腹腔注射帕瑞昔布钠10 mg/kg,假手术组和脓毒症组均给等量的生理盐水,每隔12 h注射1次。COX-2抑制剂组和帕瑞昔布钠-COX-2抑制剂组于术前2 h腹腔注射NS-398 10 mg/kg。
1.2.2 检测指标及方法(1)ELISA检测细胞上清液中炎性因子水平:各组大鼠肠组织匀浆后,于4℃离心15 min取上清液,严格按照ELISA试剂盒说明书步骤检测肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukins,IL-6、IL-10)的水平。(2)蛋白质免疫印迹试验:(Western Blot)检测前列腺素E2(PGE2)、前列腺素合酶-1(mPGES-1)和前列腺素受体EP4的蛋白表达,取肠组织总蛋白和膜蛋白后进行定量,经凝胶电泳分离后电转移蛋白到聚偏二氟乙烯膜上,5%脱脂奶粉封闭2 h。磷酸盐缓冲液洗涤后分别加入抗NLRP3、SIRT 一抗,4 ℃摇床过夜;加入二抗室温避光孵育2 h,化学发光法显影,以β-肌动蛋白(β-actin)为内参。采用Image Lab软件分析各条带灰度值,以目的蛋白与内参蛋白的灰度值比值作为目的蛋白表达量。(3)实时定量PCR(RT-PCR):于假手术或CLP术后24 h取四组大鼠肠组织,采用RT-PCR法检测PGE2、mPGES-1、EP4的mRNA表达水平。在肠组织中放入1 mL Trizol 液,提取总RNA,反转录合成cDNA,并进行qPCR实验。所有反应严格按照反应的条件进行扩增,内参采用GAPDH。反应程序如下:预变性95 ℃、2 min,变95 ℃、10 s,退火 60 ℃、30 s,延伸72 ℃、45 s。共计40个循环。取循环阈值(Ct),并采用2-△△CT进行分析。见表1。
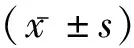
2 结 果
2.1 炎症细胞因子水平脓毒症大鼠血清和肠组织中促炎细胞因子TNF-α、IL-6水平和抗炎细胞因子IL-10水平明显增加(P<0.05),帕瑞昔布钠治疗后能够明显降低TNF-α、IL-6水平(P<0.05),而进一步增加IL-10水平(P<0.05)。见表2~4。
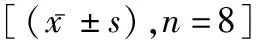
表2 各组大鼠血清和肠组织中TNF-α水平比较
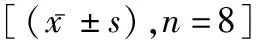
表3 各组大鼠血清和肠组织中IL-6水平比较
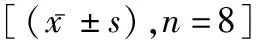
表4 各组大鼠血清和肠组织中IL-10水平比较
2.2 PGE2、mPGES-1、EP4和EP2的mRNA的表达术后24 h时,脓毒症组大鼠肠组织PGE2、mPGES-1、EP4和EP2 mRNA表达水平比假手术组明显升高(P<0.05);与CLP组相比,帕瑞昔布钠治疗脓毒症大鼠后,肠组织PGE2、mPGES-1、EP4的mRNA水平明显降低(P<0.05),而EP2 mRNA的表达水平无明显变化(P>0.05)。见表5。
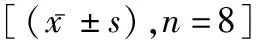
表5 PGE2 mRNA、mPGES-1 mRNA、EP4和EP2 mRNA 的表达
2.3 PGE2、mPGES-1和EP4的蛋白表达术后24 h时,脓毒症组大鼠肠组织PGE2、mPGES-1和EP4的蛋白表达水平比假手术组明显升高(P<0.05);帕瑞昔布钠治疗脓毒症大鼠后,PGE2、mPGES-1和EP4的蛋白表达水平明显降低(P<0.05)(见图1)。

注:PGE2为前列腺素E2,mPGES-1为前列腺素合酶-1,EP4为前列腺素受体,β-actin为β-肌动蛋白。
2.4 帕瑞昔布钠对脓毒症大鼠肠组织炎症水平的影响术后24 h时,与假手术组相比,脓毒症组、帕瑞昔布钠治疗组、COX-2抑制剂组及帕瑞昔布钠-COX-2抑制剂组肠组织TNF-α、IL-10和IL-6的水平均明显升高(P<0.05);与脓毒症组相比,帕瑞昔布钠治疗组、COX-2抑制剂组及帕瑞昔布钠-COX-2抑制剂组肠组织TNF-α、IL-6的水平明显降低,IL-10的水平均明显升高(P<0.05);与帕瑞昔布钠治疗组相比,COX-2抑制剂组及帕瑞昔布钠-COX-2抑制剂组肠组织TNF-α、IL-6的水平降低,IL-10的水平明显升高(P<0.05)。见表6。
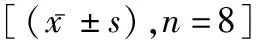
表6 各组大鼠肠组织中TNF-α、IL-6 and IL-10水平比较
3 讨 论
脓毒症早期,炎症反应即出现失控,机体产生大量的多种促炎因子如TNF-α、IL-6、IL-2等。炎症反应尽管有利于机体清除细菌和利于组织修复,但过度的炎症反应可加重组织的损伤,导致全身炎性反应综合征(SIRS)、甚至多器官功能不全(MODS)和多器官功能衰竭(MOF),甚至死亡[14]。同时,机体也产生多种抗炎介质如IL-10、TGF-β等,以维持机体免疫反应的平衡,诱发代偿性抗炎反应综合征(CARS)。本实验结果显示,帕瑞昔布钠可明显降低脓毒症大鼠肠组织促炎因子(TNF-α和IL-6)和提高抗炎因子(IL-10)的水平,给予COX-2抑制剂(NS-398)预处理后,帕瑞昔布钠的抗炎作用增强,表明帕瑞昔布钠通过抑制脓毒症的炎症反应减轻肠组织的损伤。
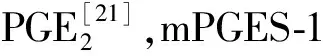
PGE2通过7次跨膜的G蛋白偶联前列腺素受体作用而参与多种病理生理过程,PGE2受体(E-prostanoid receptor,EPs)可分为四种亚型:EP1、EP2、EP3和EP4,Y.Sugimoto等[22]研究最早提出在体内分布最广的是EP3和EP4,且对PGE2的亲和力比EP1和EP2高。研究表明,NS-398抑制PGE2的合成,使EP4的表达下降,抑制巨噬细胞产生TNF-α,但同时也刺激IL-10的表达[23]。有研究表明PGE2可通过COX-2的表达活性的上调而增加自身的合成,表明机体在控制PGE2的合成方面存在正反馈的调节机制。本研究显示,在脓毒症大鼠的肠组织中EP4的表达明显上调,帕瑞昔布钠治疗后肠组织EP4的表达明显降低,可能帕瑞昔布钠抑制mPGES-1而降低PGE2的合成而使EP4的表达下降。
本研究发现帕瑞昔布钠可降低脓毒症大鼠TNF-α和IL-6的水平,同时刺激IL-10的水平升高,而且给予COX-2抑制剂后,帕瑞昔布钠的抗炎作用明显增强。帕瑞昔布钠治疗还可以明显下调脓毒症大鼠肠组织的PGE2、mPGES-1及EP4的表达,该结果表明帕瑞昔布钠可能通过COX-2-mPGES-1-PGE2-EP4通路发挥抗炎的作用,减轻由于炎症因子释放而引起的肠屏障功能的损伤。因此,精确地调控体内PGE2的合成和分解代谢,可明显改善脓毒症肠屏障功能,阻止PGE2介导的某些不利的细胞和生物学效应,可提高生存率。因此,PGE2的调控可能是今后脓毒症治疗的一个重要靶点,同时,帕瑞昔布钠可能是改善脓毒症肠屏障功能的一种可靠、有效的治疗措施。
本实验发现帕瑞昔布钠可通过抑制炎症反应来减轻脓毒症时肠屏障功能的损伤,明显提高脓毒症动物的存活率,其机制可能通过COX-2-mPGES-1-PGE2-EP4通路发挥抗炎的作用。
利益冲突说明/Conflict of Intetests
所有作者声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Patient Consent
本研究通过包头市中心医院医学伦理委员会批准。

