地中海贫血造血干细胞移植患儿霉酚酸药时曲线下面积及药物不良反应影响因素分析
牛露露,伍云,黄天敏,吴廷庆,肖洋,刘滔滔(广西医科大学第一附属医院药学部,南宁 530021)
地中海贫血是由于一个或多个珠蛋白基因发生缺失或突变使珠蛋白链合成不足,导致溶血性贫血的疾病;造血干细胞移植(hematopoietic stem cell transplantation,HSCT)是目前治疗地中海贫血的有效手段[1]。但其治疗效果受到移植物抗宿主病相关发病率和死亡率的限制[2]。吗替麦考酚酯(mycophenolate mofetil,MMF)是霉酚酸(mycophenolic acid,MPA)的酯前药,通过抑制鸟嘌呤的合成选择性阻断B淋巴细胞和T淋巴细胞的增殖来发挥免疫抑制作用,临床上广泛用于预防各种实体器官移植免疫排斥反应的发生[3],因其良好的口服吸收性,已广泛用于HSCT术后免疫排斥反应的发生[4]。药时曲线下面积(area under the concentration-time curve,AUC)是体现MPA体内暴露量的最佳药代动力学参数,且与临床治疗移植物抗宿主病效果有一定关系[5]。MPA治疗窗窄,据报道MMF的药品不良反应(adverse drug reaction,ADR)与药物体内暴露量密切相关[6],但目前有关地中海贫血HSCT儿童患者MPA-AUC影响因素的研究较少,无法为此类患者临床用药提供参考。
本研究选取我院38名地中海贫血HSCT术后使用MMF的儿童患者进行前瞻性研究,探索影响HSCT儿童患者MPA-AUC的因素,并分析MPA-AUC与ADR的相关性,为临床个体化安全用药提供参考。
1 资料与方法
1.1 研究对象
收集2022年10月至2023年7月于广西医科大学第一附属医院行造血干细胞移植的地中海贫血儿童患者。纳入标准:① 年龄<18岁;② 首次行造血干细胞移植术;③ 术后服用MMF≥4 d。排除标准:① 肝肾功能不全者;② 临床资料缺失者。本研究获得广西医科大学第一附属医院伦理委员会批准(批件号:2023-K130-01),所有患儿家属已签署知情同意书。
1.2 数据收集
收集患儿人口统计学资料:性别、年龄、身高、体重、体质量指数、体表面积。血样采集当日临床检验生化指标:白蛋白(ALB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、肌酐、血红蛋白、白细胞计数、中性粒细胞绝对值、血小板计数、红细胞压积、总胆红素(TB)、直接胆红素、尿素、肌酐清除率、总蛋白。MMF用药信息:给药剂量及合并用药。
1.3 用药方案
由于药品说明书并未推荐地中海贫血HSCT儿童患者给药剂量,参考肾移植儿童患者,所有患者均在HSCT术前4 d服用MMF胶囊(规格:0.25 g×40粒,上海罗氏制药有限公司)或MMF分散片(规格:0.25 g×40片,杭州中美华东制药有限公司),初始给药剂量600 mg·m-3,每日两次。
1.4 血样采集及测定
由于伦理学及实际操作的限制,无法对儿童患者进行密集采血,因此本研究中血样采集分为两部分:① 所有患儿在服用MMF 4 d达稳态后,在下一剂给药前30 min(C0)及给药后0.5、2、4 h(C0.5、C2、C4)采血用于MPA-AUC计算;② 按照患儿及家属意愿从38名患儿中选取一部分患者在用药前及用药后0.5、1、2、4、6、8、10、12 h采血用于探究肝肠循环。所有血样均采集静脉血样2 mL于EDTA抗凝管中,4000×g离心5 min,取上层血浆进行检测。使用高效液相色谱仪(苏州艾迪迈公司)测定MPA血药浓度,色谱柱包括在线分析柱C1:TDM core-C1(50 mm×4.6 mm)、在线分析柱C2:TDM core-C2(150 mm×4.6 mm)、在线萃取柱Z02:Pureflow-Z02(20 mm×4.6 mm)、在线萃取柱S01:Pureflow-S01(20 mm×4.6 mm);测定试剂所用流动相、质控样品均来自苏州艾迪迈医疗科技有限公司。
1.5 数据计算
根据患儿服药前0.5 h(C0)及服药后0.5、2、4 h(C0.5、C2、C4)血药浓度值计算MPA-AUC。
1.6 ADR评价标准
根据药品说明书,MMF用药后易出现的ADR包括胃肠道系统疾病(腹泻,恶心,呕吐)、血液和淋巴系统疾病(贫血,败血症)及各种原因导致的感染。ADR的具体评判标准参考《常见严重药品不良反应技术规范及评价标准》,其中:①单次检测ALT>2×ULN(正常值上限)或TB>ULN;② 连续2次ALT>40 U·L-1或/和TB>1×ULN;符合上述2项内容之一则定义为肝功能损害。准确记录患儿用药期间发生的ADR,并且分析其与MPA-AUC和患儿生理生化指标之间的相关性。
1.7 统计分析
采用SPSS软件进行数据分析,正态分布数据用均数±标准差表示,非正态分布数据用中位数(四分数)表示,分类变量用百分比表示。连续性变量与MPA-AUC间相关性采用Spearman或Pearson相关性分析,组间计量资料比较采用两独立样本t检验或Mann-Whitney U检验,将P<0.25[7]纳入回归分析,多元回归分析检验水准P<0.05认为差异具有统计学意义。
2 结果
2.1 患者一般情况
总共纳入38名符合条件的地中海贫血HSCT患者(男18例,女20例),平均年龄为(10.08±3.25)岁;38例次MPA初始用药剂量为(561.142±133.894)mg·m-3,患者人口学及临床资料见表1。
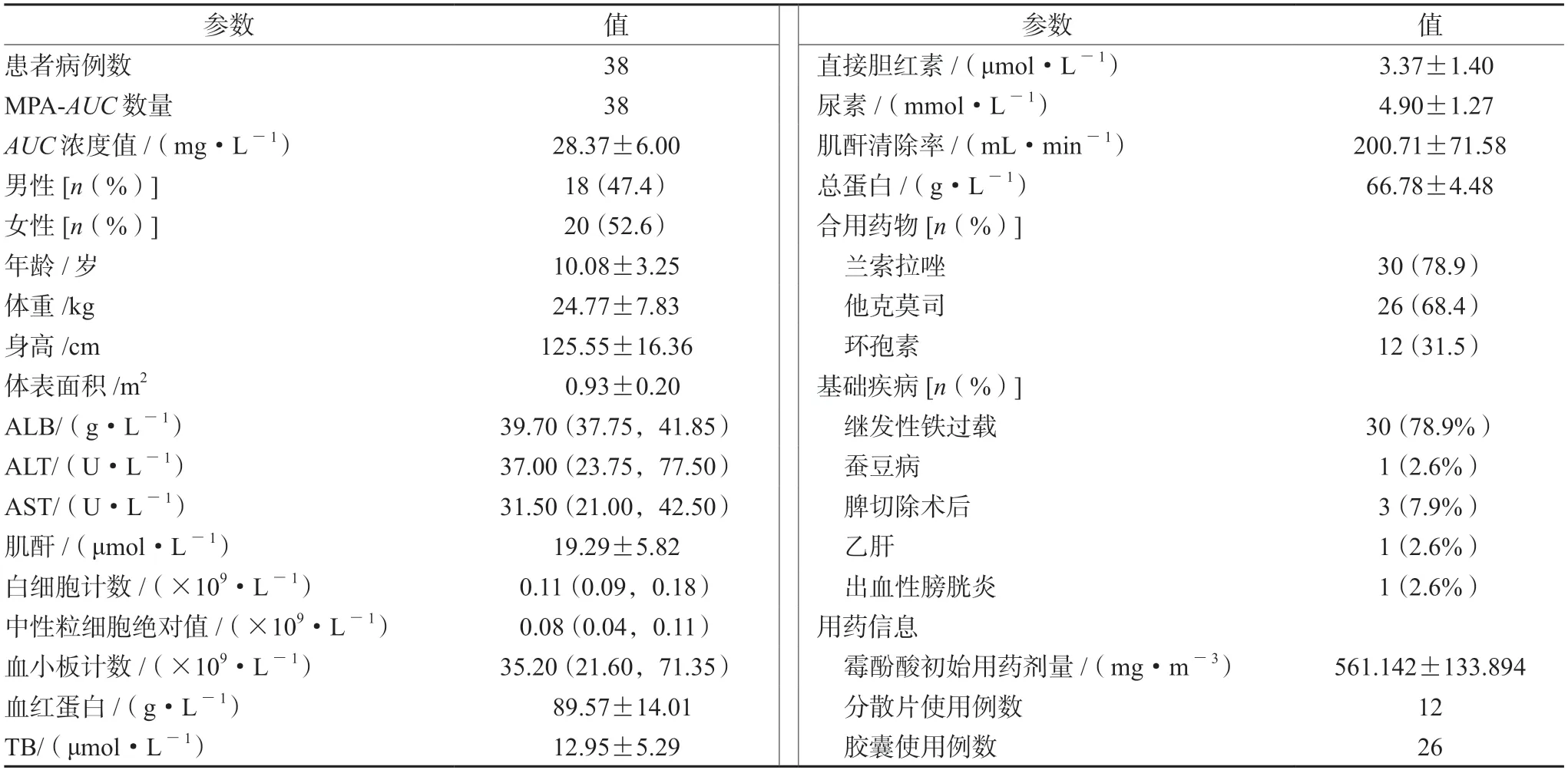
表1 人口学资料及生理病理学信息Tab 1 Demographic data and physiopathological information
2.2 MPA-AUC影响因素
患儿生理生化连续性变量单因素分析结果见表2,结果表明血红蛋白、AST、ALB、总蛋白和肌酐清除率与MPA-AUC具有相关性(P<0.25)。患儿性别、药物剂型、合并用药等变量组间MPAAUC比较结果见表3,结果显示:性别差异具有统计学意义(P<0.25)。最终多元回归分析结果表明:ALB是MPA-AUC的独立影响因素(P<0.05)(见表4)。
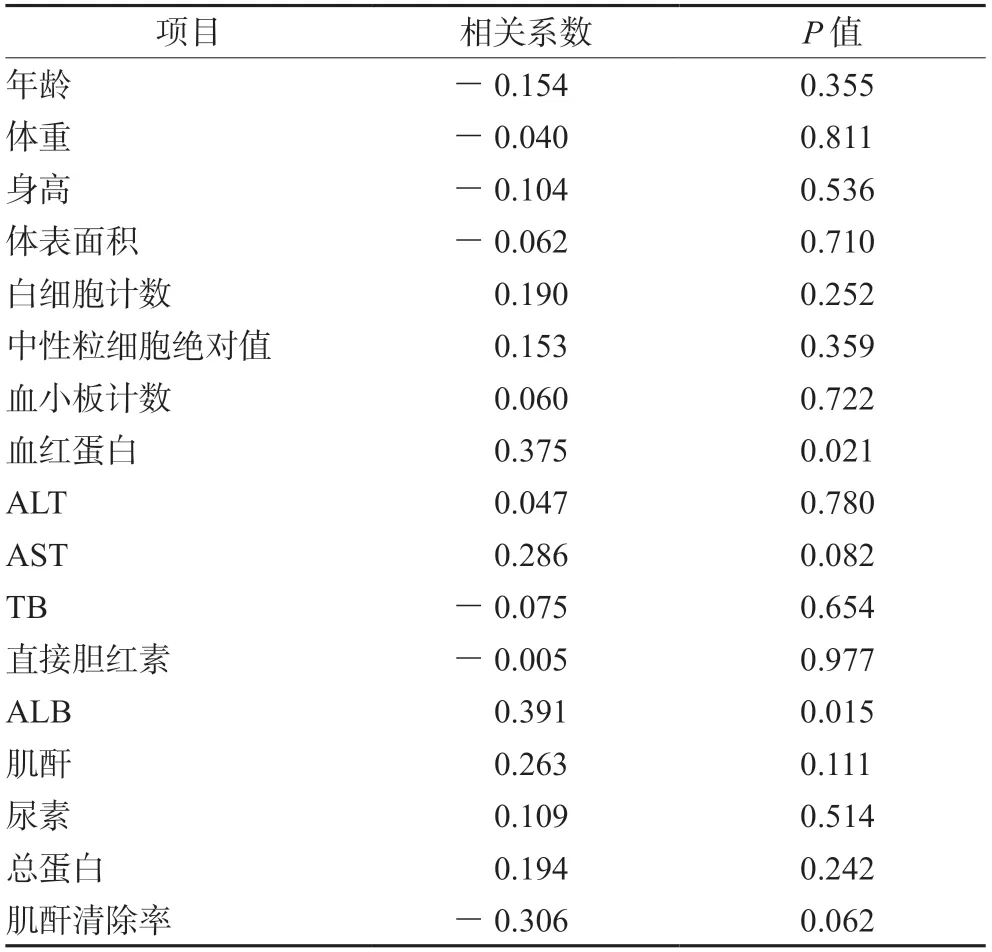
表2 患儿生理生化指标与MPA-AUC相关性分析Tab 2 Correlation analysis of physiological and biochemical indexes with MPA-AUC in children
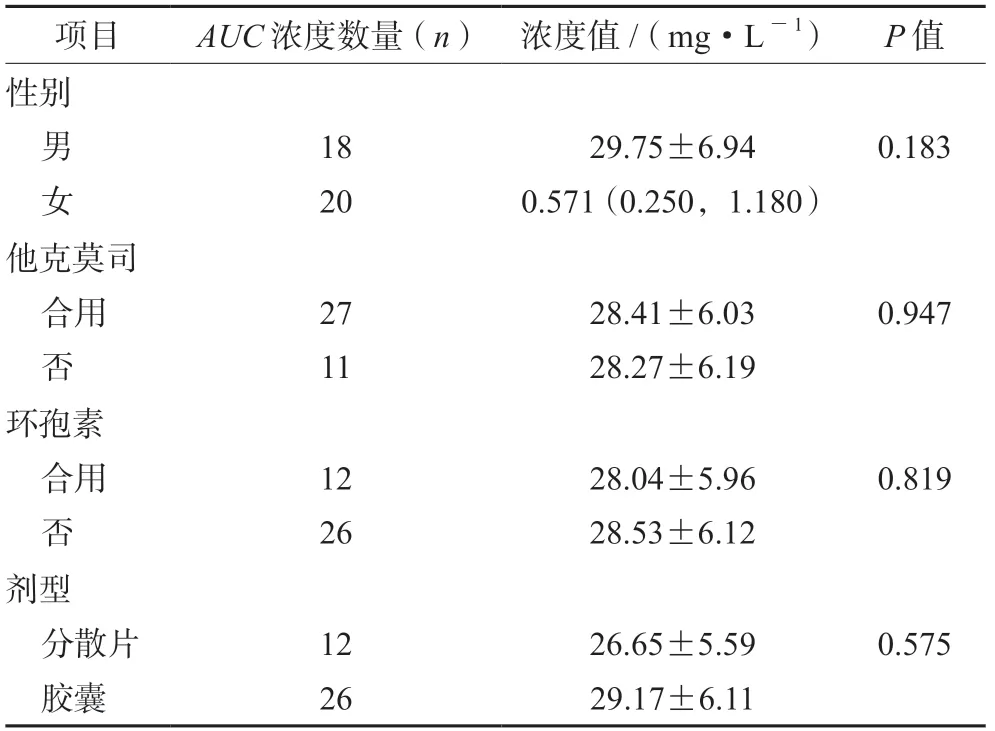
表3 组间MPA-AUC值比较Tab 3 MPA-AUC values between groups
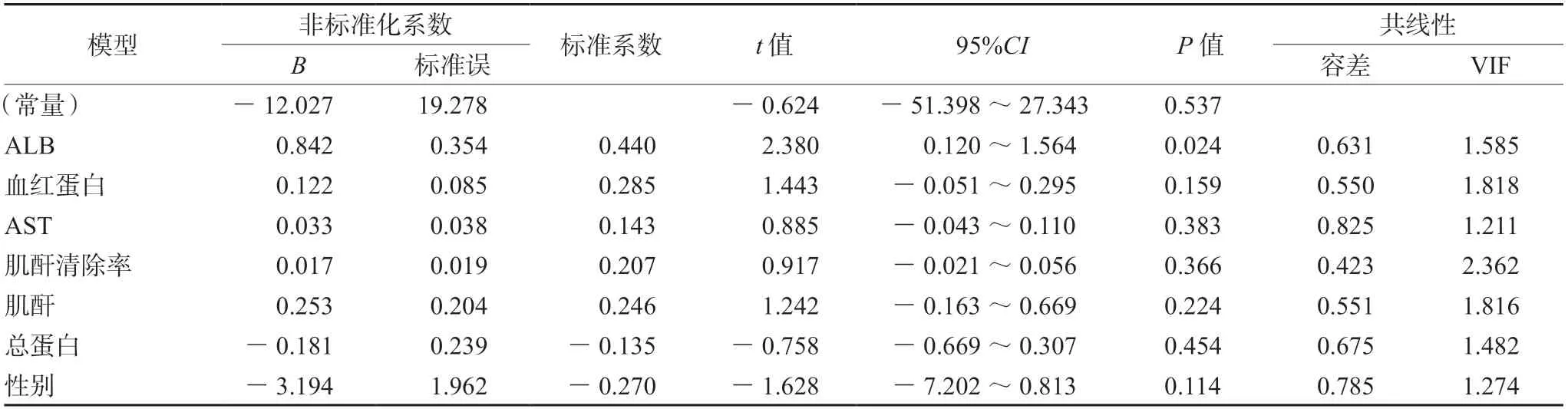
表4 线性回归方程中MPA-AUC影响因素Tab 4 MPA-AUC influencing factors in linear regression equations
2.3 血浆ALB水平对MPA-AUC的影响
根据患者ALB水平不同分为三组:A组(<35 g·L-1)、B组(35~41.8 g·L-1)、C组(>41.8 g·L-1)。单因素ANOVA分析显示,三组间AUC值存在显著差异(P<0.05),ALB水平各组间均值呈现出C组>B组>A组的趋势(见表5)。以MPA-AUC有效浓度范围(30~60 mg·L-1)为目标值[5],A组的MPA-AUC大多低于30 mg·L-1,未达到参考范围。A、B、C三组患儿达标率分别为11.1%、55.6%、66.7%;C组MPA-AUC均值可达(32.91±7.30)mg·L-1。

表5 不同ALB水平对MPA-AUC的影响Tab 5 Effect of different ALB levels on MPA-AUC
由图1可知,MPA-AUC随ALB增加而上升趋势明显;当ALB<35 g·L-1时,MPA-AUC最低(见图2),可定义为低蛋白血症[8-9],提示低蛋白血症对MPA-AUC有影响。

图1 MPA-AUC与ALB水平整体趋势Fig 1 Overall trend of MPA-AUC and ALB levels
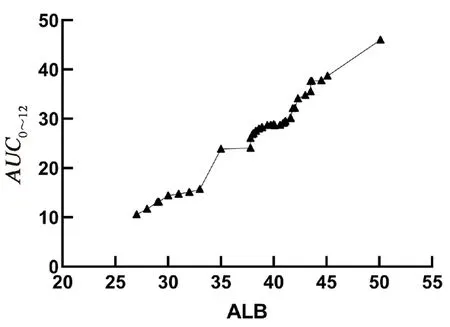
图2 ALB与MPA-AUC对应值Fig 2 Corresponding values of ALB and MPA-AUC
2.4 ADR发生情况
38名患儿发生ADR情况如下:共32名患儿出现ADR,发生率为84.2%,其中男性14名,女性18名。AUC监测期间共发生41例次ADR,主要涉及消化系统、呼吸系统、血管与淋巴系统以及感染。具体情况见表6。

表6 患儿ADR情况Tab 6 ADR status of the children
2.5 各类ADR与MPA-AUC及患者生理病理状况相关性分析
38名患儿用药期间共发生41例次ADR,对患儿各项生理因素、合并用药及MPA-AUC相关性进行探索,结果发现ADR的发生与年龄有统计学意义(P<0.05),见表7。

表7 患儿ADR与各项指标相关性Tab 7 Correlation between ADR of children and various indicators
2.6 患儿肝肠循环
为探究患儿体内MPA肝肠循环情况,对30名患儿用药后血浆药物浓度-时间曲线图进行拟合,结果如图3。所有患儿中仅3位(10%)在服药6 h后血药浓度增加,说明患儿缺乏肝肠循环故MPA体内暴露量低。

图3 患儿 MPA 时间浓度折线图Fig 3 Time concentration profile of MPA in children
3 讨论
HSCT是地中海贫血的常规治疗方法,术后免疫抑制剂的使用有助于预防移植物排斥反应的发生,提高患者生存率。MMF在实体器官移植中的成功推动了其在HSCT中的应用[10]。然而MPA治疗窗窄,血药浓度过高易出现白细胞减少、病毒感染及贫血等不良反应[11-13],而浓度过低则增加移植术后急性排斥反应风险[13-14],因此有必要进行治疗药物监测(therapeutic drug monitoring,TDM)以保障临床用药安全。AUC反映了药物在体内的暴露量,是目前MPA临床TDM的首选指标。然而影响MPA-AUC的因素较多,如肝肾功能、药物合用等,目前有关地中海贫血HSCT儿童患者MPA-AUC影响的研究较少。
本研究纳入我院38名HSCT地中海贫血患儿计算其MPA-AUC,对可能影响AUC的因素进行分析。结果发现:ALB是MPA-AUC的独立影响因素(P<0.05),两者成正相关性,AUC水平随ALB的增加而增加;并且患儿缺乏肝肠循环,所以MPA-AUC偏低。
MPA是一种与蛋白高度结合的药物,结合指数为97%,在体内可与血浆ALB可逆性结合,而其未结合游离部分是MPA发挥抗免疫排斥反应的主要因素[15-16]。MPA的代谢物7-O-葡萄糖苷酸霉酚酸(7-O-MPA-glucuronide,MPAG)与蛋白结合率高达82%[16]。研究发现,体内ALB水平降低与MPA-AUC降低有关系[17]。有研究发现,MPA清除率与ALB浓度有关:当ALB浓度增加时,MPA与蛋白结合水平增加,此时游离MPA水平下降可被清除的数量减少,清除率降低,故AUC值降低[18-19]。本研究多元回归分析发现:ALB是AUC的独立影响因素,两者成正相关,与文献报道一致[20-21]。本研究还发现AUC随ALB的增加而呈上升趋势,且低蛋白血症是影响AUC的主要原因。
MPA在体内经尿苷二磷酸葡萄糖基转移酶代谢为MPAG与少量酰基葡萄糖苷酸,后者参与了MPA肝肠循环过程:MMF口服给药4~6 h后,MPA时间浓度曲线上出现第二个血药浓度特征峰。据报道40%(10%~61%)的AUC来自肝肠循环[16]。本研究选取30名患儿探究肝肠循环过程,然而仅3位(10%)患儿在服药6 h后出现第二个特征峰,提示患儿缺乏肝肠循环。这可能是由于HSCT患者治疗过程中使用大量广谱抗菌药物,肠道菌群遭到破坏,导致肝肠循环受损的缘故[22]。
本文对可能影响ADR发生的各项因素进行分析,结果发现:年龄是ADR发生的独立影响因素。有研究报道称[23]:HSCT术后儿童患者ALB水平的增加呈现时间依赖性,随术后时间的增加而增加;ALB水平增加与MPA结合率增加,可被清除的游离MPA减少,故血药浓度增加。与文献[24]提及的MPA血药浓度增加时,ADR发生率增加相符。需指出的是,患儿ADR发生受治疗过程,药物合用等多种因素影响,且本文纳入患者数量较少,故ADR分析具有一定局限性。
综上所述,ALB是影响AUC的独立影响因素,低蛋白血症影响MPA-AUC;HSCT地中海贫血患儿缺乏肝肠循环;对于此类患者建议适当增加给药剂量以达到良好的治疗效果;对于肝肾功能不全患者应减少用药剂量。ADR的发生与患儿年龄存在密切相关性,临床使用MMF时可根据患者年龄制订不同给药方案,同时需密切监测MPA血药浓度以防ADR的发生。