微生物来源的α-L-阿拉伯呋喃糖苷酶的研究进展
陈金玲,杨 杰,魏 真,3,
(1.江苏海洋大学,江苏省海洋生物资源与环境重点实验室,江苏连云港 222005;2.江苏省海洋生物产业技术协同创新中心,江苏连云港 222005;3.江苏省海洋资源开发研究院(连云港),江苏连云港 222005)
α-L-阿拉伯呋喃糖苷酶(alpha-L-arabinofuranosidase,α-L-AFase)归属于糖苷水解酶(glycoside hydrolases,GH)家族,主要催化阿拉伯糖聚合物中以α-(1,2)、α-(1,3)或α-(1,5)连接的阿拉伯呋喃糖基的水解,在阿拉伯木聚糖的生物降解及开发应用中极具研究价值[1-2]。此外,α-L-AFase 在食品加工、饲料研制和医疗保健等领域发挥着重要作用,例如用于改善果汁澄清度和葡萄酒风味、制备动物饲料和生物活性物质等[3]。目前已报道多种微生物菌株能够产生α-L-AFase,且越来越多的α-L-AFase 的基因被挖掘和鉴定。不同α-L-AFase 分布于多个糖苷水解酶家族,不同的结构和催化机制致使该水解酶表现出不同的底物特异性[4]。至今为止研究者在α-L-AFase 的基因挖掘、表达纯化、酶学性质等方面已做了相关研究,并对其分子结构和催化机制等作出分析,但是阿拉伯木聚糖的复杂结构仍然限制了α-L-AFase 的应用范围,不同来源和不同作用模式的α-L-AFase 需要协同其他水解酶共同降解复杂的阿拉伯木聚糖。因此,充分认识不同类型的α-L-AFase 对于该酶后续的性质、分子改造及应用等研究具有重要意义。本文总结和分析了近年来α-L-AFase 的微生物来源、酶学特性与性质改良、分子结构与催化机制、与其他水解酶的协同作用以及该酶应用于食品、饲料、医疗保健等领域的研究进展,为推动后续α-LAFase 的基础研究及应用提供参考。
1 α-L-AFase 的微生物来源
α-L-AFase 广泛分布于细菌、真菌等微生物中,随着对α-L-AFase 及其水解产物的需求不断增大,对该酶的开发也随之增多。多种细菌已被报道能够产生α-L-AFase,例如Bacillus velezensis[5]、Anoxybacillus kestanbolensisAC26Sari[6]、Paenibacillussp.DG-22[7]、Streptomycessp.S9[8]、Clostridium thermocellum[9]、Pseudopedobacter saltans[10]、Geobacillus vulcaniGS90 等[11],这些α-L-AFase 普遍分布于GH43或GH51 等糖苷水解酶家族中。最近研究者在常温菌Bifidobacterium longum和嗜热菌Caldicellulosiruptorsp.两种细菌中鉴定到了α-L-AFase 的存在,同时这也是该酶分别在GH146 和GH159 家族中被发现[12-13]。这些新发现的α-L-AFase 不仅丰富了该酶的物种来源,而且扩展了糖苷水解酶家族的功能谱,对后续α-L-AFase 的研究提供了新的理论支持。与细菌来源的α-L-AFase 相比,多数真菌的α-L-AFase 产量较低,对真菌α-L-AFase 的研究也相对较少。目前发现的能够产α-L-AFase 的真菌涵盖子囊菌门和担子菌门,例如Meripilus giganteus[14]、Aspergillussp.[15]、Penicillium subrubescens[16]、Penicillium chrysogenum[17]、Saccharomycopsis fibuligeraKJJ81 等[18]。此外,研究者在一些耐热微生物中也发现了α-L-AFase 的存在,例如极端嗜热细菌Caldicellulosiruptor saccharolyticus、Thermotoga petrophila和中温真菌Eupenicillium parvum等[19-21],这些微生物来源的酶具有良好的耐热性质,有利于研究者筛选和开发热稳定的α-L-AFase。
2 α-L-AFase 的酶学特性及性质改良
2.1 α-L-AFase 的酶学特性
不同来源的α-L-AFase 的酶学性质在分子量、最适反应条件及稳定性等方面也表现出较大差异见表1。不同来源的α-L-AFase 的分子量差别较大,其最大差值达到约70 kDa。例如来自细菌Acremoniumsp.WCQ-6A 的α-L-AFase 分子量仅为42 kDa[22],而来自真菌Aspergillus japonicus的α-LAFase 呈现出较大的分子量,约为113 kDa[23];不同微生物来源的α-L-AFase 的最适pH 和温度不同,细菌来源的α-L-AFase 的最适pH 多集中在5.5~6.0之间,而真菌来源的α-L-AFase 最适pH 范围普遍较低,约为4.5~5.5;与真菌相比,来自细菌的α-LAFase 通常有着更高的最适作用温度,特别是少数来源于极端细菌的α-L-AFase 的最适温度可达到80~85 ℃;一些来源于极端微生物的α-L-AFase 表现出较高的稳定性,在理论研究和工业化生产中均有重要价值。例如,Carvalho 等[11]发现一种双功能β-木糖苷酶/α-L-阿拉伯呋喃糖苷酶具有盐稳定性,它能够在2.5 mol/L 氯化钠中保留高达63%的活性,具备在高盐或海水环境下降解木质纤维素底物的潜力。一些具有良好热稳定性的α-L-AFase 也逐渐被分离出来,例如Surmeli 等[24]在G.vulcaniGS90 中分离出的α-L-AFase 的最适温度达到70 ℃,且该酶在30~90 ℃温度范围内均具有活性,而Saleh 等[19]在C.saccharolyticus中分离的α-L-AFase(CAX43)在70 ℃时的半衰期高达120 h,这些耐热酶在需要高温条件下进行的反应过程中尤为重要。随着工业化生产对酶稳定性的要求不断提高,寻找具有生产潜力的优质α-L-AFase 逐渐成为研究的热点和难点,这些性质稳定的α-L-AFase 在工业化应用中将会有良好的发展前景。
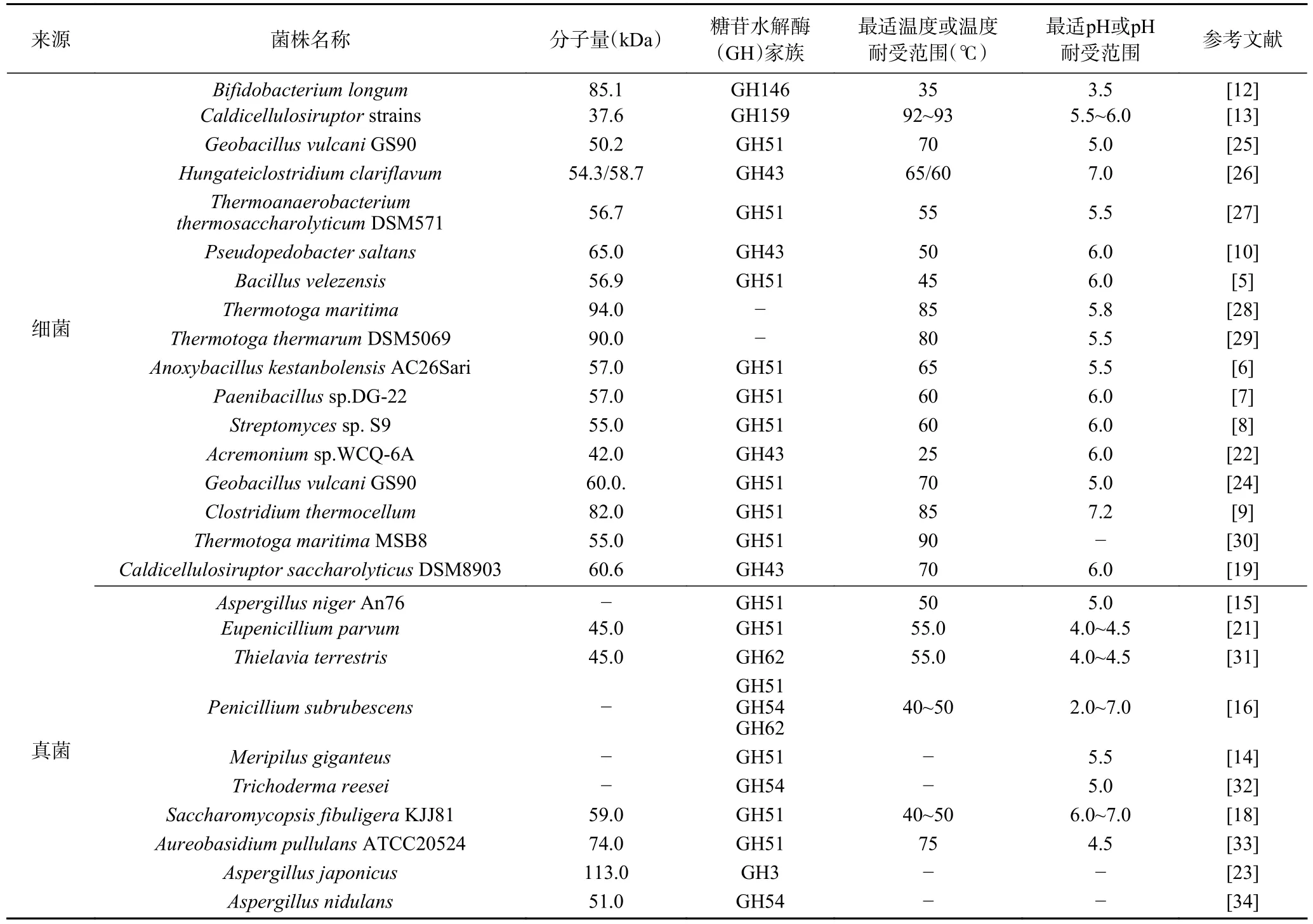
表1 不同微生物来源的α-L-AFase 的酶学性质Table 1 Properties of α-L-AFases from different microbial sources
2.2 α-L-AFase 的性质改良
α-L-AFase 在工业生产中的应用日趋广泛,但多数天然α-L-AFase 在酶活力和稳定性等方面还与实际需求存在着较大的差距。为了获得更多具有优良性质的α-L-AFase,通常使用异源表达方法对活性酶进行重组表达和制备,并结合分子生物学和生物信息学等技术手段对野生酶进行分子结构改造,以实现α-L-AFase 的性质优化。一般将编码α-L-AFase 的基因连接到具有强启动子的其他宿主的表达载体上进行异源表达,以获得高产的α-L-AFase。用于表达外来基因的宿主通常为大肠杆菌、芽孢杆菌或酿酒酵母等。酵母菌,特别是毕赤酵母,通常被选为真核阿拉伯呋喃糖苷酶基因的宿主生物,而大肠杆菌常被用作表达原核阿拉伯呋喃糖苷酶基因的宿主生物。与真菌相比,细菌具有更快的生长速度,因而它们更容易被进行基因操作以用于改造α-L-AFase。
表2 为目前已被构建的部分α-L-AFase 的基因工程菌特性。在酶活性优化方面,通过构建以大肠杆菌或毕赤酵母为宿主的基因工程菌成功提高了重组α-L-AFase 的酶活性:如Motta 等[35]将来自Trichoderma harzianum的具有Mg2+依赖性的α-L-AFase(ThABF)在大肠杆菌中表达,重组ThABF 的相对活性达到97%,且对对硝基苯-α-D-半乳糖苷(pNPG)的降解活性也有极大程度的提高。Huy 等[36]将源于Phanerochaete chrysosporium的具有木糖苷酶和α-L-AFase 活性的双功能酶PcXyl 在毕赤酵母中进行表达,该酶的比活性达到1797 U/mg。在酶稳定性提升方面,来自Pseudopedobactor saltans的α-LAFase(PsGH43_12)在大肠杆菌中表达后的性质更为稳定,重组的PsGH43_12 比野生酶在更为宽泛的pH 范围(5~9)和温度范围(35~55 ℃)中均表现出活性[37]。另外,表达质粒和宿主的选择、表达的环境条件等因素也会影响酶的表达效果,在α-L-AFase 的基因工程菌构建中可以进一步对以上因素进行优化,以更好地提高酶的表达水平,实现酶学性质的最佳改良效果。除了常规重组表达,近年来通过酶的定向进化也能够改善酶的性质,例如Surmeli 等[25]通过定向进化对源于G.vulcaniGS90 的α-L-AFase(GvAbf)进行分子改造,得到了活性高于野生酶的突变体GvAbf51和L307S,以及热稳定性高于野生酶的突变体GvAbf52,实现了α-L-AFase 的双重酶学性质改良。随着生物信息学和计算生物学技术的不断提高,利用定向突变和进化等辅助手段可以更高效的对天然α-L-AFase 作出设计和改造,实现α-LAFase 的性质优化也更加具有针对性。
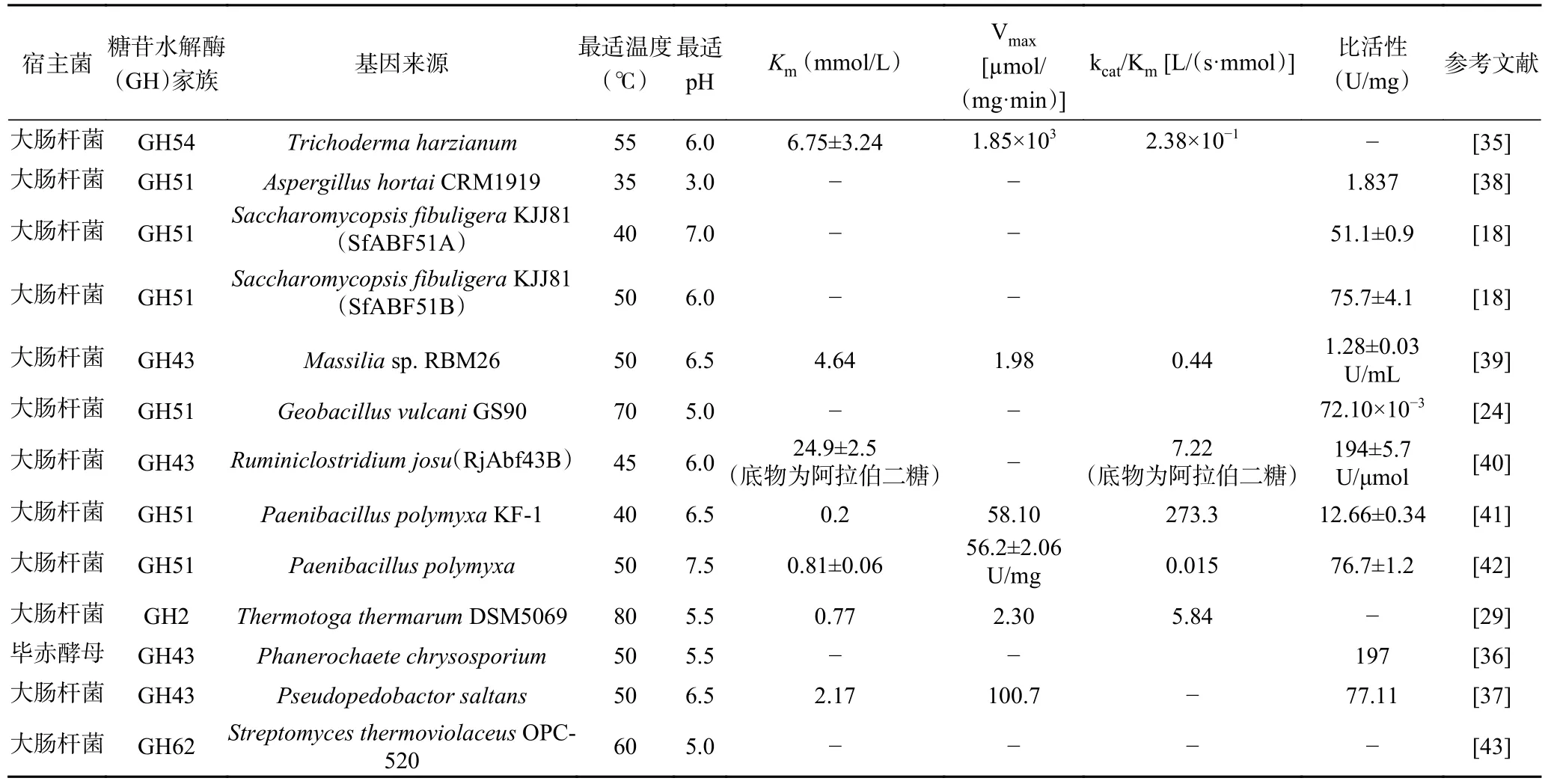
表2 不同来源的α-L-AFase 的基因工程菌特性Table 2 Characteristics of α-L-AFases from different sources of genetic engineering bacteria
以上多种实验表明,一些天然α-L-AFase 经异源重组表达后,其活性有了不同程度的提高,酶学性质也更加稳定,这为后续优质α-L-AFase 的大规模生产及应用奠定了坚实的研究基础。
3 α-L-AFase 的结构与催化机制
结构生物学的迅速发展使得越来越多α-LAFase 的空间结构得以解析。深入探究α-L-AFase的结构对理解该酶的反应机制具有重要意义,同时也便于后续提高对该酶功能预测的准确性,提高分子改造效率。
查阅碳水化合物活性酶数据库(Carbohydrate-Active Enzymes Database,CAZy;www.cazy.org)得知,α-L-AFase 被划分为GH2、GH3、GH43、GH51、GH54、GH62、GH146 和GH159 等多个糖苷水解酶家族,其中绝大多数家族酶的催化机制为保留型。此外,在GH5、GH10、GH93、GH127 等家族中也鉴定到了α-L-AFase 的存在,但它们的酶学性质和结构等信息还未被充分挖掘。GH2 家族的α-L-AFase 属于糖苷水解酶家族的GH-A 家族,该家族成员的催化结构域具有(β/α)8的三维结构,通过保留机制切割α-L-阿拉伯呋喃糖苷键,且将谷氨酸作为其亲核试剂和质子供体[29]。GH3 家族与GH2 家族具有类似的催化机制,但是GH3 家族中的天冬氨酸为催化的亲核试剂,谷氨酸为水解酶的催化质子供体,组氨酸为磷酸化酶的催化质子供体[4]。GH43 家族的α-L-AFase 主要催化阿拉伯木聚糖中阿拉伯糖侧链的水解,其催化结构域为五叶片的β-螺旋桨褶皱结构,且分别以天冬氨酸和谷氨酸作为催化亲核试剂和催化质子供体采用反转机制切割糖苷键[44]。此外,部分GH43 家族的α-L-AFase 还同时具有α-木糖苷酶和α-L-阿拉伯呋喃糖苷酶活性[45]。对来源于GH51家族α-L-AFase 的圆二色谱图分析显示它们的催化结构域具有(β/α)8桶状结构,其质子供体和亲核谷氨酸分别在β-4 和β-7 链上,通过双置换机制水解糖苷键,同时保留异位构型[25,46]。GH51 家族的极少数酶同时也具有内切木聚糖酶活性[47]。根据圆二色谱图,GH54 家族的α-L-AFase 与β-三明治折叠的B 族糖苷水解酶相似,其催化结构域分别以谷氨酸和天冬氨酸作为亲核残基和质子供体,采用保留机制进行催化作用[3]。首次被解析的GH62 家族的α-L-Afase 来源于真菌,也呈现出一个五叶片的β-螺旋桨褶皱的三维结构类型,对阿拉伯糖具有绝对特异性[48]。属于GH-F 家族的α-L-AFase 是GH62 家族的唯一一组酶,这些酶在释放阿拉伯糖的同时,水解阿拉伯木聚糖中存在的单取代木糖残基,作用于糖苷键的O-2 和O-3 位点[4,49]。近年来首次发现了来源于GH159家族的嗜热α-L-AFase,该酶展示了较小的五叶片β-螺旋桨式的三维结构,成为GH159 家族中首次被解析的具有阿拉伯呋喃糖苷水解酶活性的α-L-AFase[13]。
由此可以看出,α-L-AFase 的主要功能为切割α-L-阿拉伯呋喃糖苷键并去除α-L-阿拉伯糖取代基,但不同糖苷水解酶家族的α-L-AFase 的分子结构和催化机制差异较大,显示出不同α-L-AFase 在空间结构与催化机制中的多样性。随着越来越多微生物来源的α-L-AFase 基因被挖掘和鉴定,对该酶结构的认识也进入了飞速发展期。尽管到目前为止,众多α-L-AFase 的结构已被解析,但部分家族α-LAFase 的结构特征尚未明确,未来α-L-AFase 是否存在更加多样的催化机理仍有待探讨。
4 α-L-AFase 与其他半纤维素水解酶的协同作用
前述对α-L-AFase 的性质和催化机制的分析表明,α-L-AFase 的核心功能是去除阿拉伯木聚糖中的α-L-阿拉伯糖取代基,因而α-L-AFase 在半纤维素的生物降解及木质纤维素的生物转化中起到非常关键的作用。然而,阿拉伯木聚糖的结构极为复杂,其高效酶解是由α-L-AFase、β-木聚糖酶、β-木糖苷酶等多种木聚糖降解酶共同作用的结果[2]。研究发现,复杂底物的高效降解离不开多种水解酶的协同作用,α-L-AFase 也具有与其他半纤维素水解酶协同降解阿拉伯木聚糖的性质[26,50]。
α-L-AFase 这一独特性质使得研究者们越来越关注该酶与哪些水解酶类能够起到协同作用,以及如何提高该酶与其他水解酶类的协同催化效率。已有实验证实α-L-AFase 与阿拉伯糖苷酶、木聚糖酶、木糖苷酶等多种水解酶均能协同降解特定底物,并且使底物转化率明显提高:如Leschonski 等[51]对分别来源于Humicola insolens和Talaromyces pinophilus的阿拉伯呋喃糖苷酶HiABF43_36a 和TpABF43_36b 的协同作用进行研究,发现当以阿拉伯木聚糖为底物时,HiABF43_36a 与GH51 家族阿拉伯糖苷酶MgABF51 和GH62 家族阿拉伯糖苷酶PoABF62 共同作用产生了更多的单取代木糖基残基,并多释放了54%的阿拉伯糖,TpABF43_36b 与MgABF51、PoABF62 的协同作用导致底物多释放了56%的阿拉伯糖。Puangpen 等[45]将来源于Paenibacillus curdlanolyticusB-6 中具有α-L-AFase 功能的蛋白PcAxy43B、PcAxy43A 与木聚糖酶Xyn10C 共同进行降解,发现三种酶对阿拉伯木聚糖的降解产物几乎全部为阿拉伯糖和木糖,底物转化率达到95.33%;同样,将来源于E.parvum的α-L-AFase(EpABF62A)与一种GH10 家族木聚糖酶、GH43 家族β-D-木糖苷酶和GH67 家族α-葡萄糖醛酸酶共同作用于添加了纤维素酶的玉米芯糖化过程中,葡萄糖、木糖和阿拉伯糖的转化率分别达到94.0%、91.8%和82.6%[21]。多种研究结果表明,与单一使用α-L-AFase 降解阿拉伯木聚糖相比,联合使用多种半纤维素降解酶系能够显著提高底物的水解效率和底物转化率。这种多种酶参与降解底物的模式不仅能够降低底物的水解成本,而且有助于推动复杂底物的高值化利用。因此,构建更加稳定的α-L-AFase 协同降解酶系统成为当前推动和实现复杂底物降解的研究热点。
5 α-L-AFase 的应用
半纤维素的完全生物转化离不开α-L-AFase 的关键作用,因而α-L-AFase 逐渐成为农业和工业等领域中富有潜力的工具酶之一。随着基因工程和酶工程技术的发展,越来越多的酶制剂生产实现了纯度高、生产成本降低和生产周期缩短等优点,实际生产应用中对α-L-AFase 的需求也日益增加。α-L-AFase广泛应用于提高面食制作质量、果汁澄清、改善葡萄酒风味、提高饲料利用率和特殊药物成分研制等领域,在食品加工、饲料和医疗保健等行业起到了举足轻重的作用。
5.1 在发酵面食制作中的应用
小麦等农作物的种子富含大量的阿拉伯木聚糖等半纤维素成分,同时也是面食类食品的主要来源。α-L-AFase 能够与内源小麦粉酶等水解酶共同将添加至小麦粉中的戊聚糖分解为游离态戊糖,从而提高酵母菌对糖类的利用率,在一定程度上促进面团发酵,同时改善发酵面食的质地和口感[52-54]。Xue 等[54]将经过来自Thermotoga marotima的木聚糖酶和α-L-AFase 处理后的麦麸添加至馒头中,发现经两种酶处理后馒头的抗延展性、软化性、吸水性、延展性、稳定时间、孔隙率和感官特性等均得到有效改善。Zhou 等[55]将T.marotima中 的α-L-AFase 与 来 自C.thermocellum的木聚糖结合结构域(CtXBD6)融合,发现融合酶能够提高对不溶性阿拉伯木聚糖底物的催化性能,并增加以小麦粉为原料的面包的比体积、粘结性和弹性。越来越多的α-L-AFase 将应用到发酵类面食的工业化制作之中,探究其合适配方、提高α-L-AFase 与其他水解酶的协同作用效率及健全食品的安全性评价制度将是未来值得思考的问题。
5.2 在果汁澄清中的应用
水果中富含大量的碳水化合物多糖,其中也不乏半纤维素的存在。多糖、蛋白质等物质在果汁储存过程中容易形成沉淀,而α-L-AFase 与果胶酶能够联合用于果汁的澄清,其中α-L-AFase 用于水解半纤维素的阿拉伯糖侧链,而果胶酶可以消化果胶材料[56-57]。鼠李半乳糖醛酸聚糖I 果胶是植物初代细胞壁的主要成分,在商业鸡尾酒制作尤其是其中的果汁澄清工艺中难以消化,向其中添加Aspergillus aculeatinusO822 来源的α-L-AFase 可将果汁粘度降低70%,而且果汁的过滤流速和产量均得到一定提升[58]。彭程等[59]发现向葡萄柚汁中添加15 U/mL的来自Aspergillus niger的α-L-AFase 可将果汁澄清度提高15.18%,表明α-L-AFase 也可以对柑橘类果汁有明显的澄清作用。因此,α-L-AFase 在提高果汁溶解度和澄清度、优化果汁制作工艺等方面发挥着独特的优势。
5.3 在酿酒工业领域的应用
除了在发酵面食制作及果汁澄清中具有重要作用,α-L-AFase 还可以应用到葡萄酒、啤酒等酿酒工业中,用以改善酿造工艺。研究表明,葡萄酒最重要的品质是其特有的香气,在酿酒过程中添加α-LAFase 能够增加葡萄酒的风味,改善葡萄酒的品质[60]。葡萄酒中绝大多数风味物质是游离形式的单萜类化合物,然而葡萄酒中的大多数单萜烯与糖类结合后不具有香气[61-63],α-L-AFase 和β-D-吡喃葡萄糖苷酶、β-葡萄糖苷酶等水解酶的协同作用可以高效分解与单萜烯结合的糖类物质,并释放单萜烯以促进葡萄酒香味的形成[62,64]。例如Ravanal 等[65]从Penicillium purpurogenum中分离纯化了一种α-LAFase(ABF3),并对同样来源于该菌株的β-葡萄糖苷酶联合应用于葡萄酒的风味增加进行了研究,发现两种酶的共同作用比商业酶制剂释放更多的萜烯类物质并生成更高的香气指数。此外,α-L-AFase 也能够降解啤酒生产中用到的大麦麦芽的阿拉伯糖侧链,同时促进其他水解酶对麦芽的分解,有效提高大麦麦芽汁的过滤速度,缩短啤酒的生产周期[66-67]。
5.4 在饲料领域的应用
作为能够分解阿拉伯木聚糖的水解酶,α-LAFase 在动物饲料加工领域也颇有优势。阿拉伯木聚糖属于半纤维素,能够为动物提供重要的营养物质并促进肠道蠕动,是多数食草类动物饲料的主要成分之一,然而很多食草动物由于自身不分泌分解半纤维素的酶而对饲料的吸收能力降低[68-70]。α-L-AFase能去除阿拉伯木聚糖中阿拉伯糖残基的侧链,因此在饲料生产过程中添加α-L-AFase 有助于提高半纤维素的利用率[71-72]。对肉鸡饲料和一些杂粮混合饲料的研究表明,添加含有α-L-AFase 的饲料酶可以裂解饲料中阿拉伯木聚糖等一些聚合物之间的化学键,降低纤维类物质在肠道中的粘度和有害作用,最终减少非淀粉多糖的营养抑制作用,提高动物对饲料营养成分的总消化率[73-74]。
5.5 在医药保健领域的应用
α-L-AFase 在医药保健领域的主要应用是参与制备生物活性物质人参皂苷Rd 及功能性益生元。人参皂苷Rd 来源于人参,具有抗炎、保护神经、抗氧化等多种特殊生物学活性,而人参皂苷Rc 为Rd 与α-L-阿拉伯呋喃糖苷键结合形成的糖苷[75-76],因而可用α-L-AFase 水解人参皂苷Rc 上的α-L-阿拉伯呋喃糖苷残基来制备获得人参皂苷Rd[77-78]。据报道,多种微生物来源的α-L-AFase 都可以用于制备人参皂苷Rd,例如Bacillus subtilis、Thermotoga thermarum、C.saccharolyticus等[79-81],其中多数α-L-AFase 表现出了良好的水解性能。此外,α-L-AFase还能够高效地与木聚糖酶等水解酶协同降解玉米皮等农副产物,产生具有益生元功能的木聚糖和阿拉伯低聚糖,为开发功能性保健食品提供了重要元素[82]。因此,α-L-AFase 在医药保健领域显示出独特的应用潜力和优势,为人类的健康与发展提供了一定帮助。
6 结论与展望
α-L-AFase 因其具有水解半纤维素中α-L-阿拉伯呋喃糖苷基的特性,在改良发酵面食、果汁、酿酒等食品加工工艺、提高动物饲料利用率、制备功能性保健品等领域都具有重要的应用前景。目前,研究者已对多种微生物来源的α-L-AFase 的酶学特性、结构与催化机制、协同作用和应用等方面开展多样化的研究,并在该酶的重组菌株构建和表达等方面取得了重大突破,使酶的活性、耐热性和稳定性得到提高。在此背景下,如何获得应用范围广泛、能高效发酵制备、靶向转化和结构修饰的新型α-L-AFase 将是未来的研究方向。然而,由于天然阿拉伯木聚糖底物的复杂性与多样性,α-L-AFase 对不同类型底物的催化方式仍需进一步探索,研究如何提高α-LAFase 与其他水解酶之间的协同作用效率仍具有突破和创新的空间。此外,酶研究的一个重要基础是阐明酶的结构和功能,以探索其催化机制和分子修饰。面对天然阿拉伯木聚糖底物的多样性,研究不同家族α-L-AFase 对于不同底物的位点识别和降解机制,探索基于α-L-AFase 的多酶复合催化系统,也成为实现α-L-AFase 高效应用的发展趋势。

