银杏内酯B 对肥胖小鼠的改善作用研究
尹忞强,罗来庆,汤海莲,陈金女,李 琴,黄露怡,焦宇知,
(1.江苏食品药品职业技术学院,江苏淮安 223001;2.江苏联合职业技术学院苏州旅游与财经分院,江苏苏州 215000)
肥胖是一种由于能量代谢失衡导致体内脂肪过度积累的慢性代谢性疾病[1]。据报道,全球约有6.5 亿成年人和3.4 亿儿童和青少年(5~19 岁)患有肥胖症[2]。而截至2019 年,我国约有46%的成年人和15%的儿童肥胖或超重[3],同时,肥胖的患病率还在快速升高。大量研究证实,肥胖与常见的慢性疾病如心血管疾病、2 型糖尿病、高血压以及某些类型的癌症密切相关[4-6]。甚至,肥胖还被认为是导致COVID-19 恶化的危险因素之一[7]。因此,肥胖的预防和改善对我国公民的公共健康具有重要意义。
银杏是我国独有的一种中生代孑遗植物,银杏果和银杏叶为传统中药品种[8]。其中银杏叶性平、味苦涩,归心、肺经,具有活血化瘀、通络止痛、化浊降脂的功效[9]。有研究显示,银杏内酯B(ginkgolide B,GB)能够通过PI3K/Akt 信号传导通路抑制血小板活化,是银杏叶提取物发挥血小板拮抗作用的主要成分[10]。同时也有文献表明,GB 可有效改善阿尔茨海默症大鼠学习记忆能力[11],高剂量GB 也可改善帕金森病模型大鼠行为学,增强抗氧化应激能力,减轻炎症损伤,具有一定的保护作用[12]。与此同时,GB 也被证实具有一定的抗肺癌作用[13]。但目前GB 对肥胖干预作用的相关研究仍较少。
因此,本研究拟通过高脂膳食诱导建立C57BL/6J 小鼠肥胖模型,进一步采用不同剂量的GB 进行干预处理,分析各组小鼠的肥胖指标以此探究GB 对肥胖可能的改善作用。本研究将为银杏叶活性成分对肥胖的预防和改善提供科学依据,同时也为银杏叶的进一步开发利用提供参考。
1 材料与方法
1.1 材料与仪器
GB 纯度>95%,上海诗丹德生物技术有限公司;ELISA 试剂盒 eBioscience 公司;苏木精、伊红、油红O 染色液 国药集团化学试剂有限公司;多聚甲醛、二甲苯 苏州晓东宜健公司;雄性C57BL/6J 小鼠 50 只,鼠龄4 周,体重18~20 g苏州卡文斯实验动物有限公司(许可证号:SCXK(苏)2018-0002);基础饲料、高脂饲料 江苏省协同医药生物工程有限责任公司;其他试剂均为分析纯。
TGL-16M 型高速冷冻离心机 上海卢湘仪有限公司;BS-600M 型全自动生化分析仪 深圳迈瑞有限公司;TB718 型石蜡包埋机 湖北泰维医疗科技有限公司;RM2245 型石蜡切片机 德国Leica 公司;BX51 型光学显微镜 日本奥林巴斯公司。
1.2 实验方法
1.2.1 肥胖小鼠模型构建及分组处理 C57BL/6J 小鼠在适应性喂养一周后被随机分为高脂模型组(n=50)与空白对照组(n=8),分别喂以高脂饲料和基础饲料,喂养16 周,以模型组小鼠体质量超过普通组平均体质量的20%为依据[10],筛选出肥胖小鼠32 只,随后按体重随机分为4 组,模型组(PG,n=8)、GB 低剂量组(GBL,n=8)、GB 中剂量组(GBM,n=8)和GB 高剂量组(GBH,n=8)。干预处理:PG 组每日1 次腹腔注射生理盐水5 mL/kg,GBL、GBM和GBH 组每日 1 次腹腔注射20 mg/kg、40 mg/kg、80 mg/kg 的GB 溶液,干预处理时间均为8 周。
1.2.2 体重及脂肪系数测定 实验开始前小鼠空腹12 h 称重,最后一次干预后,小鼠禁食12 h,称量小鼠体重。处死小鼠后,解剖,将肾周和附睾脂肪分离取出,称重,计算脂肪系数。
1.2.3 血脂相关指标测定 干预8 周后,各组小鼠空腹24 h 后进行眼眦取血,采用全自动生化分析仪测定TC、TG、LDL-C 和HLD-C。
1.2.4 病理观察 小鼠处死后,无菌条件下取部分肝脏和附睾脂肪。经4%多聚甲醛固定,然后脱水包埋在石蜡中,然后将肝组织和附睾脂肪组织切成5 μm 厚的切片,固定在载玻片上并烘干。随后将组织切片分别浸泡在二甲苯、梯度浓度的乙醇和苏木精中,并用树脂密封。肝组织固定后,加入最佳切割温度包埋剂包埋。然后,将组织冷冻成块并切成5 μm 厚的切片,冷冻切片在室温下干燥,并用10%的多聚甲醛固定。洗涤、浸泡和脱水后,加入油红O 染色液进行染色,并将切片浸入体积比为85%的异丙醇中。苏木精用于复染以显示细胞核。最后,在光学显微镜下观察染色切片,分析组织病理学的差异。
1.2.5 qRT-PCR 小鼠处死后,无菌条件下取部分肝脏,用Trizol 提取肝脏样本中总RNA,先将小鼠肝脏组织研磨破碎,随后加入Trizol 进行匀浆处理,室温放置5 min 后,加入氯仿振荡。4 ℃,10000×g 离心后取上层水相,使用异丙醇沉淀水相中的RNA。再次离心后使用75%乙醇洗涤RNA 沉淀。4 ℃,8000×g离心,弃沉淀,室温放置干燥RNA 沉淀后,加入无RNase 水吸打使得RNA 溶解。并用核酸蛋白定量仪检测RNA 的浓度和质量。根据所测RNA 浓度,严格按照说明书使用逆转录酶试剂盒将RNA 反转录为cDNA。将引物、cDNA 与SYBR Green Mix混匀,使用荧光定量PCR 仪扩增并检测荧光强度(表1)。参数如下:95 ℃预变性5 min;95 ℃变性10 s,53~58 ℃退火30 s,72 ℃延伸30 s。基因引物的设计参考引物数据库,以β-actin 为内参基因,采用2-△△CT法对PPARγ、UCP-2的mRNA 表达水平进行分析。
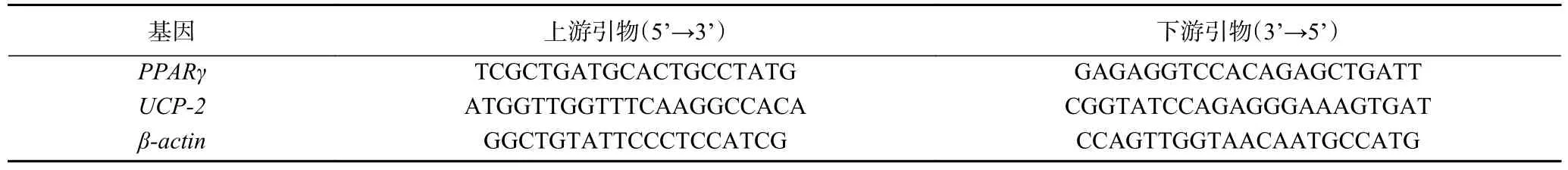
表1 qRT-PCR 引物序列Table 1 qRT-PCR primer sequence
1.3 数据处理
采用SPSS 26.0 对所有数据进行分析,结果均以平均值±标准差(Mean±SD)表示,进行单因素方差分析(one-way ANOVA),P<0.05 时具有统计学意义,采用GraphPad Prism 5.0 作图。
2 结果与分析
2.1 GB 对肥胖小鼠体重增长的影响
本研究首先采用高脂饮食诱导建立C57BL/6J小鼠肥胖模型,造模期间同时观察小鼠的生理状态,模型组和对照组两组小鼠进食量无明显差异,但肥胖模型组小鼠毛色明显油亮,饮水量较空白对照组有所增加;高脂膳食饲喂4 周后,肥胖模型组小鼠体重显著上升(P<0.05),16 周后,筛选出32 只肥胖小鼠,进行GB 干预处理。由图1 可知,GB 干预后,和PG组(7.35±0.61 g)相比,GBL 组(6.86±0.50 g)小鼠体重增长量略有下降,但无显著性差异(P>0.05),而GBM 组(6.00±0.52 g)和GBH 组(5.80±0.31 g)小鼠体重增长量均显著低于PG 组(P<0.05),分别下降了18.37%和21.09%。

图1 不同浓度的GB 对肥胖小鼠体重增长的影响Fig.1 Effects of different concentrations of GB on weight gain of obese mice
2.2 GB 对肥胖小鼠脏器脂肪系数的影响
为进一步评估不同浓度的GB 对肥胖小鼠内脏脂肪的影响,在干预8 周后,测量了各组小鼠的附睾和肾周脂肪系数。结果如图2 所示,与PG 组小鼠相比,GBH 组小鼠的附睾及肾周脂肪系数显著降低(P<0.05),分别降低了22.02%和36.51%;GBM 组小鼠附睾脂肪系数与PG 组相比下降了12.22%(P<0.05),肾周脂肪系数虽然略有下降(16.27%),但无显著性差异(P>0.05);而GBL 组小鼠的附睾及肾周脂肪系数和PG 组小鼠相比,均无显著性差异(P>0.05)。经过中高剂量的GB 干预后,肥胖小鼠的体重增长及内脏脂肪系数均得到不同程度的抑制,尤其是高浓度的GB 效果更明显,与空白对照组相近,差异无显著性(P>0.05)。此外,陆江等[14]的研究表明,银杏叶提取物可以降低肥胖犬的体重、体脂率,这与本研究结果类似。
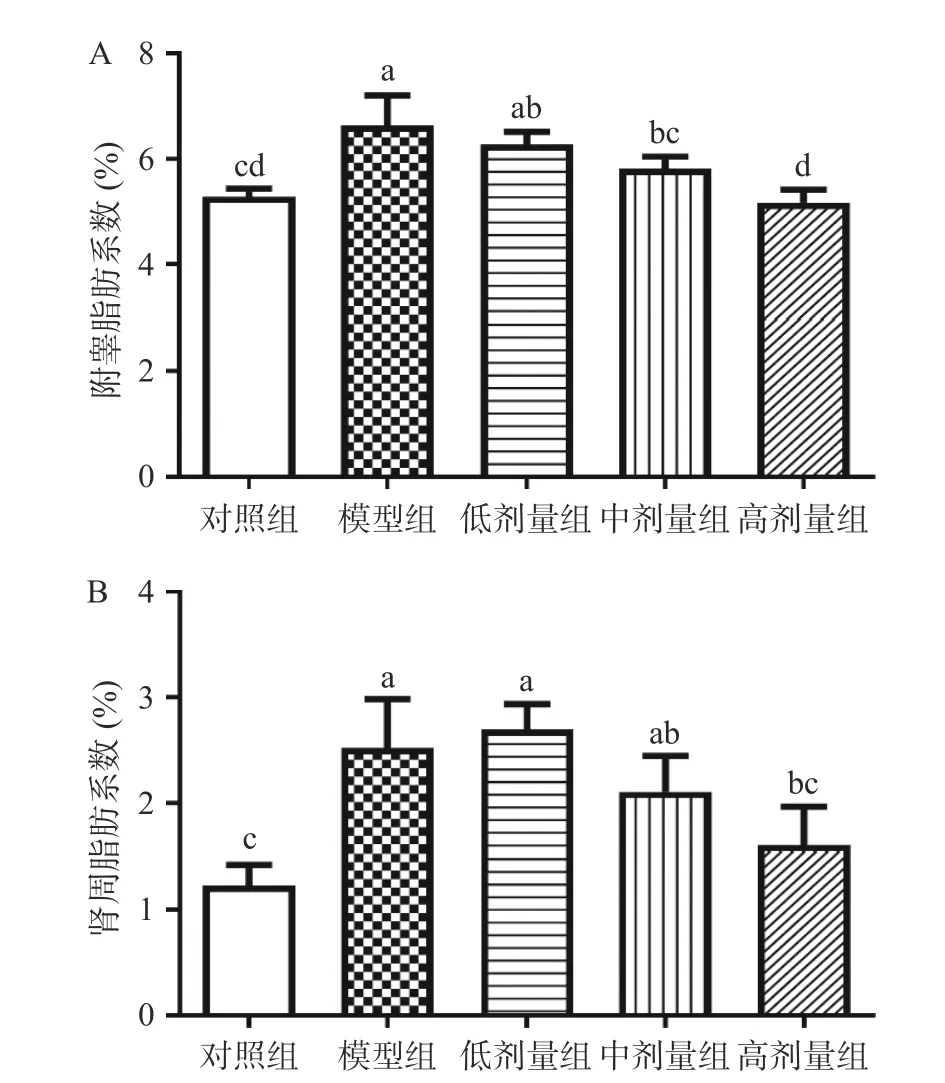
图2 不同浓度的GB 对肥胖小鼠内脏脂肪系数的影响Fig.2 Effects of different concentrations of GB on visceral fat coefficient of obese mice
2.3 GB 对肥胖小鼠血清TC、TG、LDL-C 和HDL-C的影响
本研究测定了各组小鼠血清TC、TG、LDL-C和HDL-C 水平,结果如图3 所示。与PG 组相比,GBM 组和GBH 组小鼠的血清TC 水平显著降低(P<0.05),分别降低了27.49%和38.16%;此外,GBM组和GBH 组小鼠的血清LDL-C 水平与PG 组相比也分别降低了26.44%和37.39%。但只有GBH 组小鼠的血清TG 水平较PG 组显著降低(P<0.05),降低了27.32%,GBM 组小鼠的血清TG水平有降低趋势但无统计学意义(P>0.05)。此外,与PG 组相比,GBM 组和GBH 组的HDL-C 水平显著升高(P<0.05),分别升高了38.33%和72.50%。这表明中高剂量的GB 能有效调节肥胖小鼠的血脂水平,其中,高剂量的GB 干预改善机体脂蛋白分布的效果更好。不同剂量的GB 均有效降低肥胖小鼠血清中的TG、TC 和LDL-C,并且这种抑制作用具有剂量依赖关系,另外,中高剂量的GB 还能显著(P<0.05)增加HDL-C 的浓度,这说明中高剂量的GB 干预能有效改善肥胖小鼠的血脂异常状态。颜景灏等[15]的研究也证实了银杏叶水溶液干预的肥胖大鼠血清TC、TG、LDL-C 和HDL-C 水平显著低于高脂对照组,且银杏叶水提取物浓度越高,改善效果越佳,表明银杏叶片水溶液在治疗高脂血症方面疗效明显,这与本研究结果一致。
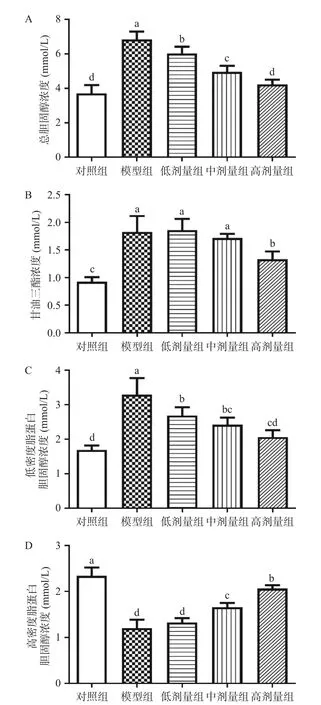
图3 不同浓度的GB 对肥胖小鼠血清指标的影响Fig.3 Effects of different concentrations of GB on serum indexes of obese mice
2.4 GB 对肥胖小鼠肝脏及脂肪染色的影响
本研究对各组小鼠肝脏切片进行油红O 染色,对附睾脂肪切片进行HE 染色,进行组织病理学观察。结果如图4 所示,肝脏油红O 染色结果显示,PG 组小鼠肝脏切片中有大量明显的红色脂滴,GBL 组小鼠肝脏切片中也有不同密度的红色脂滴,说明其小鼠肝脏中也存在脂肪沉积,而GBM 组及GBH 组小鼠肝脏切片中几乎未观察到红色脂滴,说明其肝脏脂肪沉积较少;此外,附睾脂肪切片的HE 染色结果显示,与PG 组相比,GBM 组及GBH组小鼠的附睾脂肪细胞显著减小。这表明中高剂量的GB 能有效改善肥胖小鼠肝脏的脂质变性,减少内脏脂肪沉积,也进一步说明了GB 能够改善脂肪代谢。
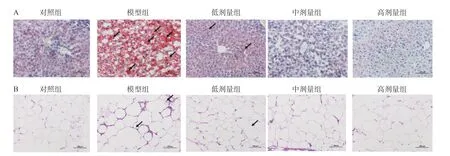
图4 不同浓度的GB 对肥胖小鼠肝脏及脂肪染色的影响(200×)Fig.4 Effects of different concentrations of GB on liver and fat staining of obese mice (200×)
2.5 GB 对肥胖小鼠脂肪组织中脂质代谢相关基因表达的影响
为进一步研究不同浓度GB 可能的影响机体脂质代谢机制,本实验探究了GB 对各组肥胖小鼠肝脏PPARγ、UCP-2基因表达的影响。结果如图5 所示,与PG 相比,GBM 组和GBH 组小鼠肝脏PPARγ的mRNA 表达水平显著降低(P<0.05),GBH 组小鼠肝脏PPARγ的mRNA 表达水平与空白对照组水平相近;同时,对UCP-2 的基因表达水平分析结果显示,与PG 相比,GBM 组和GBH 组小鼠肝脏UCP2的mRNA 表达水平显著升高(P<0.05),GBL 组和PG 组之间无统计学差异(P>0.05)。该结果说明,中高剂量的GB 干预能够降低肥胖小鼠肝脏PPARγ的表达,促进肥胖小鼠肝脏UCP-2 的表达。

图5 不同浓度的GB 对肥胖小鼠肝脏PPARγ、UCP-2 基因表达的影响Fig.5 Effects of different concentrations of GB on the expression of PPARγ and UCP-2 genes in liver of obese mice
实验发现,中高剂量的GB 显著抑制了PPARγ的mRNA 表达,而提高了UCP-2 的mRNA 表达。研究证实,肝脏中PPARγ过表达会导致脂肪在肝组织中积累[16-18],同时,文献[14,19]表明,银杏叶提取物能改善犬的肥胖症状,降低血脂,减少脂肪组织脂质沉积。其作用机制可能与银杏叶提取物激活AMPK 信号通路,抑制PPARγ信号通路有关,与本文研究结果相似[15,20-21]。UCP-2 在哺乳动物大部分组织中广泛分布,并且它能激活AMPK[22],使其通过自身磷酸化的增加促进下游ACC 磷酸化,从而增加脂肪酸的氧化,调节脂质代谢[23]。这说明UCP-2 是能量代谢的重要调节因子,其表达降低会使能量消耗减小,导致肥胖[24-25]。UCP-2 是线粒体产生活性氧的不良调节剂,而其过表达可阻止内皮细胞凋亡,它通过抑制活性氧生成和提高一氧化氮水平来改善血管内皮功能[26]。Lan 等[27]的研究表明,在UCP-2 抑制剂存在的情况下,姜黄素改善血管功能的作用被阻断。而在本研究中,中高剂量的GB 提高了UCP-2的mRNA 表达水平,这可能与改善小鼠肥胖机制相关。除此之外,有研究证实,PPARγ是UCP-2 的有效调节因子[28-30],因此推测中高剂量的GB 可能通过PPARγ-UCP-2 信号途径调节肥胖小鼠的机体能量和脂质代谢。
3 结论
本研究通过建立小鼠肥胖模型,给予肥胖小鼠不同浓度的GB 干预,通过比较其对肥胖小鼠体重和内脏脂肪系数、血清生化指标的影响来分析不同剂量的GB 对小鼠肥胖的改善作用。结果表明,在经过8 周40 mg/kg、80 mg/kg 的GB 干预,肥胖小鼠的体重和附睾及肾周脂肪系数均显著降低;此外,中高剂量的GB 均有效降低肥胖小鼠血清中的TG、TC 和LDL-C,另外,中高剂量的GB 还能显著增加HDL-C 的浓度,改善肥胖小鼠肝脏的脂质变性,减少内脏脂肪沉积。为进一步探究GB 改善肥胖作用的可能机制,本研究进一步研究了GB 对肥胖小鼠肝脏PPARγ、UCP-2基因表达的影响,结果发现中高剂量的GB 有效抑制了肥胖小鼠肝脏PPARγ的表达,促进肥胖小鼠肝脏UCP-2 的表达,这说明GB 对肥胖小鼠的改善作用可能和PPARγ-UCP-2 信号途径有关。本研究为GB 的进一步加工利用提供了理论依据,但值得注意的是,考虑到小鼠和人类的种群差异,GB 对于人体肥胖的改善作用还需要临床实验进一步证实。

