仿野生种植三叶青不同部位总黄酮分析及其抗炎、抗氧化能力比较
汪传宝,陈静文,王 可,仇凤梅,黄 真,钟晓明,
(1.浙江中医药大学药学院,浙江杭州 310053;2.嘉兴学院医学院,浙江嘉兴 314001)
三叶青(Tetrastigma hemsleyanumDiels et Gilg),又称金线吊葫芦、蛇附子、石抱子、三叶对,是一种具有重要药用价值的多年生常绿藤本植物[1]。作为一种珍贵的中草药材,三叶青在我国分布较广,常见于浙江、江西、福建、广西等地,全草皆可入药,以块根最佳[2]。药理研究表明,三叶青具有抗肿瘤[3]、抗病毒[4]、抗氧化[5]、抗炎[6]等生理活性。作为浙产地道药材,三叶青常被用于小儿高热惊厥、痢疾、活血散结、祛风化痰等治疗[7]。也有研究将三叶青添加到食用油中用作保健食品从而更有利于保留功效[8];将钙果和三叶青为主料加工成钙果三叶青营养片等。三叶青的黄酮类物质被广泛认为是其重要的药物组成部分[9],已有研究证实多种药理活性与黄酮类密切相关[10-12]。目前,因为三叶青药用价值较高,市场需求越来越大,导致三叶青市场价格突飞猛进,人们对于三叶青野生资源的过度采挖,造成其自然条件下的野生资源逐渐减少。三叶青人工种植是解决这一现状的主要手段之一[13]。又因其药用部位以块根为主,种植采收后的地上部分和根须[14]极少被合理利用,存在大量的资源浪费。近年来,已有学者从三叶青块根中分离出具有抗炎活性的物质,证实三叶青块根具有良好的抗炎活性[15]。本文从物质基础和功效方面比较仿野生种植三叶青不同部位间的差异,以期为仿野生种植三叶青质量控制提供参考依据,并对仿野生种植三叶青资源的合理开发利用提供更多选择。
1 材料与方法
1.1 材料与仪器
三叶青样品 浙江丽水仿野生种植栽培基地2021 年8 月份采收,经浙江中医药大学药学院资源研究所黄真教授鉴定为葡萄科崖爬藤属植物三叶青Tetrastigma hemsleyanumDiels et Gilg 的干燥全株;芦丁(纯度均>98%)、槲皮素(纯度均>98%)、山奈酚(纯度均>98%)、1,1-苯基-2-苦肼基自由基(DPPH)上海源叶生物科技有限公司;乙腈、甲醇 色谱纯,美国Tedia 公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+)酷尔化学;L-抗坏血酸(VC)、脂多糖(LPS)Sigma 公司;RAW264.7 小鼠巨噬细胞 由浙江省医学科学院惠赠;胎牛血清四季青公司;DMEM 培养基 Gibco公司;青霉素-链霉素溶液、PBS 缓冲液 Biosharp 公司;二甲基亚砜分析纯,国药集团化学试剂有限公司;NO 检测试剂盒 碧云天;其他试剂为分析纯;超纯水 Milli-Q 超纯水系统制备。
ME203E 电子天平 梅特勒-托利多仪器(上海)有限公司;RE-52AA 旋转蒸发仪 上海亚荣生化仪器厂;GZX-9140MBE 数显鼓风干燥箱 上海帅登仪器有限公司;HH-2 恒温水浴锅 上海宜昌仪器厂;UV-1800 紫外分光光度计 杭州宗灿科技有限公司;Waters 高效液相(HPLC)色谱仪 美国Waters 公司;ELX800 酶标仪 美国博腾仪器有限公司;二氧化碳培养箱 美国赛默飞世尔科技公司;超净工作台 丹麦Labogene 公司。
1.2 实验方法
1.2.1 三叶青不同部位总黄酮提取与含量测定
1.2.1.1 三叶青不同部位总黄酮的提取 仿野生种植三叶青茎叶、块根、根须置于阴凉干燥处,自然干燥、粉碎、过50 目筛处理后,收集作为样品粉末。精密称取三叶青样品粉末1.00 g,按照如下热回流提取工艺进行提取,料液比1:30 g·mL-1,温度83 ℃,提取时间65 min,乙醇浓度60%。滤液经抽滤后,用50 mL 容量瓶定容,备用[16]。
1.2.1.2 芦丁标准曲线的绘制 参考文献[17]并加以修改,标准品的制备:精密称取芦丁10.0 mg,用60%乙醇进行溶解,定容至10 mL 容量瓶中,摇匀后即得。测定方法:精密吸取配制好的芦丁对照品0.2、0.4、0.6、0.8、1.0 mL,分别加入到25 mL 容量瓶中,先加入1 mL 5%亚硝酸钠溶液,静置6 min 后再加入1 mL 10%硝酸铝溶液,静置6 min 后加入10 mL 4%氢氧化钠溶液,用纯水定容至25 mL,混匀后静置15 min。以纯水作为空白对照,采用紫外分光光度计测量各样品在510 nm 波长处的吸光度值,以吸光度(A)对芦丁质量浓度(X)进行回归,得到回归方程:A=10.613X-0.0171(R2=0.9999)。
1.2.1.3 三叶青不同部位总黄酮的测定 精密量取三叶青试样溶液2.0 mL,并置于25 mL 容量瓶中进行定容,按照“1.2.1.2”中所述方法操作,测定三叶青总黄酮得率,以如下公式进行计算:
式中,Y 为三叶青总黄酮得率,mg·g-1;C 为三叶青总黄酮的质量浓度,mg·mL-1;V 为三叶青提取液体积,mL;N 为稀释倍数;M 为三叶青样品质量,mg。
1.2.2 三叶青不同部位指标成分的含量差异测定
1.2.2.1 标准品溶液的制备 精密称取芦丁、山奈酚、槲皮素标准品各1.0 mg,向其中分别加入1 mL纯甲醇,使其完全溶解,稀释至1.0 mg/mL,储存备用。
1.2.2.2 供试品溶液的制备 取三叶青样品适量,粉碎后精密称量各不同部位粉末1.0 mg,置于圆底烧瓶中,采用醇提工艺[15]进行提取,滤液用旋转蒸发仪蒸干,用甲醇转移并定容至5 mL 容量瓶中,0.22 μm微孔滤膜过滤,取续滤液作为供试品。
1.2.2.3 色谱条件 采用Waters Sunfire C18 柱(4.6 mm×250 mm,5 μm)为色谱柱,以0.1%磷酸水为水相(A 相)-乙腈为有机相(B 相),梯度洗脱条件为(0~5 min,10% B;5~15 min,10%~12% B;15~30 min,12% B;30~35 min,12%~13% B;35~75 min,13%~43% B;75~90 min,43%~73% B;90~110 min,73%~100% B);流速:1.0 mL/min;检测波长:360 nm;柱温:30 ℃;进样量:10 μL。
1.2.2.4 线性关系考察 精密吸取适当的混合标准品溶液配制成浓度均为100 μg/mL 的混合标准品溶液,再依次稀释成50、20、10、5、1 μg/mL 的系列溶液,分别进样,在360 nm 波长下测定各组分的峰面积,以峰面积对标准品浓度进行线性回归,绘制标准曲线,并测定各成分的线性范围。
1.2.3 指纹图谱方法学考察
1.2.3.1 精密度实验 取同一批供试品溶液,在“1.2.2.3”条件下连续进样6 次[18],计算得出槲皮素峰相对保留时间和相对峰面积的RSD 值。
1.2.3.2 稳定性实验 取同一批供试品溶液,在“1.2.2.3”条件下,分别在0、2、4、8、12、24 h 进样测定[18],计算得出槲皮素峰相对保留时间和相对峰面积的RSD 值。
1.2.3.3 重复性实验 取6 份供试品溶液,在“1.2.2.3”条件下进样[18],计算得出槲皮素峰相对保留时间和相对峰面积的RSD 值。
1.2.4 三叶青不同部位黄酮提取物体外抗氧化能力测定
1.2.4.1 DPPH 自由基清除率测定 参考文献[19]并加以改进,将该提取工艺下得到的不同部位三叶青样品配制成0.10、0.20、0.40、0.80、1.00 mg/mL 质量浓度的样品溶液。精密量取三叶青待测液各2 mL,和含有2 mL 1×10-4mol/L 的DPPH 溶液充分摇匀后避光静置30 min,以纯水作为空白组,在517 nm 波长处测定吸光度,以VC为对照品。按下式计算清除率。
式中:Ao表示纯水和DPPH 溶液的吸光值;Ax表示三叶青样品和DPPH 溶液的吸光值;Axo表示三叶青样品和无水乙醇的吸光值。
1.2.4.2 ABTS+自由基清除率测定 参考文献[20]并加以改进,提前配制好7.4 mmol/L 的ABTS 溶液与2.6 mmol/L 的过硫酸钾溶液1:1 混合均匀,避光静置过夜后,制成ABTS 储备液。实验时用95%乙醇稀释,使其在734 nm 波长下的A 值为0.700±0.020。
将该提取工艺下得到的不同部位三叶青样品配制成0.10、0.20、0.40、0.80、1.00 mg/mL 质量浓度的样品溶液。取0.2 mL 样品溶液,加入0.8 mL ABTS 工作液,混匀,在室温下避光反应10 min,空白组选择用95%乙醇代替,在734 nm 波长下测定吸光度,以VC为对照品,按式(3)计算清除率。
式中:Ao表示95%乙醇和ABTS+溶液的吸光度;A 表示三叶青样品和ABTS+溶液的吸光度。
1.2.4.3 羟自由基清除率测定 参考文献[21]并加以改进,将该提取工艺下得到的三叶青不同部位配制成0.10、0.20、0.40、0.80、1.00 mg/mL 质量浓度的样品溶液。吸取2 mL 三叶青待测液于试管中,依次加入9 mmol/L 的硫酸亚铁溶液2 mL、9 mmol/L 的水杨酸-乙醇溶液2 mL 和9 mmol/L 的过氧化氢溶液2 mL,摇匀,在37 ℃条件下反应30 min,冷却后于510 nm 波长处测量吸光度,以纯水作为空白组,以同浓度的VC作为对照组,按式(4)计算清除率。
式中:Ao表示纯水+FeSO4溶液+水杨酸-乙醇溶液+H2O2溶液的吸光值;Ax表示三叶青样品+FeSO4溶液+水杨酸-乙醇溶液+H2O2溶液的吸光值;Axo表示三叶青样品+FeSO4溶液+水杨酸-乙醇溶液的吸光值。
1.2.4.4 铁离子还原力测定 参考文献[22]并加以改进,将该提取工艺下得到的不同部位三叶青样品配制成0.10、0.20、0.40、0.80、1.00 mg/mL 质量浓度的样品溶液。取1 mL 三叶青样品于试管中,加入2.5 mL 磷酸盐缓冲液(0.2 mol/L,pH7.4),2.5 mL 1.0%铁氰化钾溶液混合均匀后置于50 ℃条件下反应20 min,加入2.5 mL 10%三氯乙酸溶液,于4000 r/min 离心10 min,吸取上清液2.5 mL 于另一试管中,加入2.5 mL 蒸馏水和0.5 mL 三氯化铁溶液(0.1%),混匀后静置10 min,以同浓度的Vc 为对照品在700 nm 波长处测定吸光度值,吸光度值越大,说明该样品对铁离子的还原能力越强。
1.2.5 三叶青不同部位黄酮提取物抗炎能力测定
1.2.5.1 RAW264.7 细胞培养 将RAW 264.7 细胞培养于DMEM 完全培养基中(含10%胎牛血清),培养条件为37 ℃、5% CO2培养箱中,待细胞处于对数生长期后进行后续实验。
1.2.5.2 MTT 法筛选给药安全浓度 参考文献[23]并加以改进,待RAW264.7 细胞密度达到70%~80%时,调整细胞密度为1×105cell/mL,吹打均匀后,接种至96 孔细胞培养板中,设置空白组,正常组和给药组,给药组加入100 μL/孔的25、50、100、200、400、800、1600 μg/mL 系列浓度的三叶青提取物溶液,正常组不添加药物,代之等量的培养基;空白组不接种细胞,加入等量的培养基。每组设置6 个复孔,于37 ℃,5% CO2饱和湿度环境下培养24 h后,弃去培养液,用PBS 溶液洗涤2 次,每孔加入5 mg/mL MTT 工作液100 μL,于细胞培养箱中培养4 h 后,用移液枪吸去上清液,补加150 μL DMSO溶液,震荡溶解13 min,立即至酶标仪检测490 nm波长下的吸光度值,实验重复三次,按式(5)计算细胞存活率:
1.2.5.3 Griess 法测定NO 释放量 参考文献[23]并加以改进,待RAW264.7 细胞密度达到70%~80%时,调整细胞密度为1×105cell/mL,吹打均匀后,将细胞分为正常组、模型组、阿司匹林(Aspirin,阳性药)组和给药低中高组,分别接种于96 孔板中,每孔100 μL,于37 ℃、5% CO2培养箱中培养24 h后,模型组不加入药物,加入等量的培养基;阳性药组加入含阿司匹林的培养基溶液,使终浓度为100 μg/mL;给药组添加含待测样品的培养基溶液,分别以终浓度为50、100、200 μg/mL。每组设置3 个复孔,于37 ℃,5% CO2饱和湿度环境下培养24 h。其中模型组、阳性药组、给药组,在培养24 h 后,弃去原先培养基,加入200 μL 含1 μg/mL LPS 的DMEM 培养基,正常组代之等量的培养基,继续培养24 h。待测样品孔中加入各组培养上清液50 μL,标准品孔加入浓度0、1、2、5、10、20、40、60、100 μmol/L 各50 μL,零孔加入培养基50 μL。各孔中分别加入50 μL 的Griess Reagent Ⅰ,再加入50 μL 的Griess Reagent Ⅱ,在540 nm 波长下测定OD 值,根据试剂盒说明书计算NO 释放量,实验重复3 次。
1.3 数据处理
实验数据用IBM SPSS Statistics 26.0 软件进行统计分析,数据均为3 次平行实验的平均值,结果用平均值±标准偏差表示,并对实验结果进行配对t检验,P<0.05 为差异显著;采用GraphPad Prism 8 软件进行作图。
2 结果与分析
2.1 三叶青不同部位总黄酮含量
2.1.1 三叶青不同部位的黄酮提取物得率比较 分别称取三叶青茎叶,块根,根须三个部位药材粉末33.30 g,以最佳提取工艺提取,抽滤,旋蒸,烘干,计算提取物得率。结果显示,茎叶的提取物得率为8.96%±0.02%;块根的提取物得率为12.06%±0.02%;根须的提取物得率为7.23%±0.01%。
2.1.2 三叶青不同部位总黄酮含量差异 结果显示,茎叶总黄酮含量为11.86±0.23 mg·g-1;块根总黄酮含量为8.48±0.10 mg·g-1;根须总黄酮含量为7.52±0.02 mg·g-1。从得率和总黄酮含量比较看,茎叶部分的总黄酮含量最高,得率次于块根部分,在资源开发方面保证了产量,这有利于后续对三叶青茎叶部分的开发利用。
2.2 三叶青不同部位总黄酮HPLC 指纹图谱的建立
通过将三叶青色谱图导入“中药色谱指纹图谱相似度评价系统(2012 版)”中,如图1 所示,根据相同的保留时间共标定了10 个共有峰,三个部位的液相色谱图比较,茎叶的色谱峰更多,表明成分更丰富。从出峰的强度来看,茎叶样品的总峰面积更多,所含有的化学成分含量更多,这对三叶青茎叶化学成分进一步研究提供了参考。与混合对照品比对,指认其中三个指标成分,确认6 号峰为芦丁,8 号峰为槲皮素,9 号峰为山奈酚,可以进一步进行含量测定。

图1 三叶青样品HPLC 指纹图谱Fig.1 HPLC fingerprint of Tetrastigma hemsleyanum Diels et Gilg
2.3 指纹图谱方法学考察
2.3.1 精密度实验 取同一批块根样品为供试品,连续进样6 次,以8 号峰为参考峰,计算得出各样品峰相对保留时间和相对峰面积的RSD 值分别为0.5%、0.9%,表明该仪器的精密度良好。
2.3.2 稳定性实验 取同一批块根样品为供试品,分别在配制后0、2、4、8、12、24 h 进样测定,以8 号峰为参考峰,计算得出各样品峰相对保留时间和相对峰面积的RSD 值分别为0.1%、1.0%,表明供试品在24 h 内的稳定性良好。
2.3.3 重复性实验 取6 份块根样品为供试品,分别进样,以8 号峰为参考峰,计算得出各样品峰相对保留时间和相对峰面积的RSD 值分别为0.5%、1.3%,表明该方法的重复性良好。
2.4 标准曲线的绘制与线性范围的确定
通过查看各标准品在200~400 nm 下的光谱图,发现芦丁、槲皮素、山奈酚在360 nm 左右有较强吸收,于是对各标准品在360 nm 波长下对各峰进行积分。以标准品对应峰的峰面积为纵坐标,标准品浓度为横坐标,绘制标准曲线,如图2 所示,线性方程分别为:芦丁,y=878.39x-689.21,R2=0.9993;槲皮素,y=3199.5x-5555.1,R2=0.9992;山奈酚,y=3725.6x-2189.5,R2=0.9994。芦丁,槲皮素,山奈酚均在1~100 µg/mL 范围内呈现线性关系。

图2 三叶青不同部位指标成分含量比较(±s,n=3)Fig.2 Comparison of contents of index components in different parts of Tetrastigma hemsleyanum Diels et Gilg(±s,n=3)
2.5 三叶青不同部位指标成分的含量差异
将三叶青的三个不同部位进行HPLC 检测,对三个指标成分进行分析。结果表明,芦丁,槲皮素和山奈酚在块根样品中含量都是最高。芦丁含量由高到低依次为块根(4.99 mg/kg)、根须(2.79 mg/kg)、茎叶(2.49 mg/kg)。槲皮素含量由高到低依次为块根(30.93 mg/kg)、根须(14.75 mg/kg)、茎叶(9.59 mg/kg)。山奈酚含量由高到低依次为块根(4.89 mg/kg)、根须(4.28 mg/kg)、茎叶(3.43 mg/kg)。从总体上看,块根中的三种指标成分含量最多[24],但是从总黄酮含量以及高效液相色谱图分析,茎叶中有着更加丰富的成分,表明三叶青不同部位间各化学成分不同,各成分含量也不尽相同,这与蓝艳等[25]对不同产地三叶青中化学成分测定的结果相似。可能的原因是三叶青在生长过程中化学成分富集的部位不同,且茎叶部位的成分种类更多可能跟光合作用有关,值得进一步开发利用。
2.6 三叶青不同部位体外抗氧化能力差异
2.6.1 三叶青黄酮提取物对DPPH 自由基的清除能力 由图3 可知,随着样品质量浓度的增大,三叶青不同部位对DPPH 自由基的清除率逐渐提高,在质量浓度为0.8 mg/mL 时,三叶青茎叶的清除率为95.08%,IC50值为0.2107 mg/mL;块根的清除率为91.53%,IC50值为0.3134 mg/mL;根须的清除率为94.12%,IC50值为0.2058 mg/mL。而VC对DPPH的清除率在0~0.1 mg/mL 的范围内急剧增加,达到96.67%,此后基本维持在此水平。由此可见,三叶青提取物对DPPH 自由基具有一定的清除能力,但与Vc 相比能力较弱。且三叶青不同部位之间也有差异,茎叶和根须的清除能力较块根强一些。张进军等[26]对浙产三叶青地上部分抗氧化活性评价,测得对DPPH 自由基清除率的IC50值为0.1902 mg/mL,与本实验所得结果相符,为仿野生种植三叶青更加全面、客观的评价抗氧化能力提供了参考。

图3 三叶青对DPPH 自由基清除率的影响Fig.3 Scavenging effect of Tetrastigma hemsleyanum Diels et Gilg on DPPH radical
2.6.2 三叶青黄酮提取物对ABTS+自由基的清除能力 由图4 可知,随着质量浓度的增大,三叶青不同部位对ABTS+自由基的清除率逐渐提高,在质量浓度为0.6 mg/mL 时,三叶青茎叶的清除率为97.56%,IC50值为0.2315 mg/mL;块根的清除率为89.64%,IC50值为0.3758 mg/mL;根须的清除率为99.91%,IC50值为0.2587 mg/mL。而VC对ABTS+自由基的清除率在0~0.1 mg/mL 的范围内急剧增加,达到99.70%,此后基本维持在此水平。由此可见,三叶青提取物对ABTS+自由基具有一定的清除能力,但与VC相比能力较弱。且三叶青不同部位之间也有差异,茎叶和根须的清除能力较块根强一些。
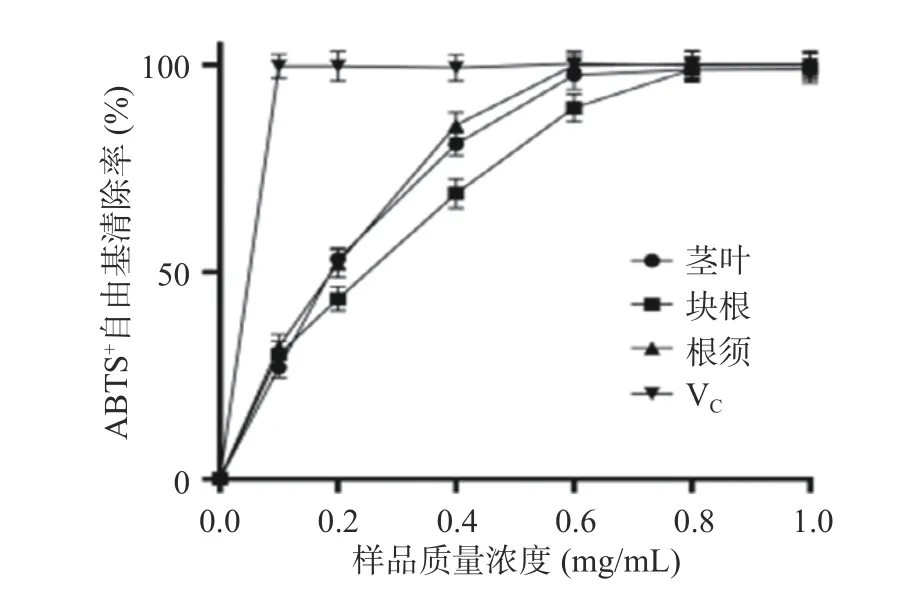
图4 三叶青对ABTS+自由基清除率的影响Fig.4 Scavenging effect of Tetrastigma hemsleyanum Diels et Gilg on ABTS+ radical
2.6.3 三叶青黄酮提取物对羟自由基清除能力 由图5 可知,随着质量浓度的增大,三叶青不同部位对羟自由基的清除率呈现上升趋势。当浓度达到1.0 mg/mL 时,三叶青茎叶的清除率为77.50%,IC50值为0.7625 mg/mL;块根的清除率为68.21%,IC50值为0.8967 mg/mL;根须的清除率为78.96%,IC50值为0.7856 mg/mL。而VC对羟自由基的清除率在0~0.4 mg/mL 的范围内呈上升趋势,在0.4 mg/mL时达到100%。由此可见,三叶青提取物对羟自由基具有一定的清除能力,但与VC相比能力较弱。且三叶青不同部位之间也有差异,茎叶和根须的清除能力较块根强一些。
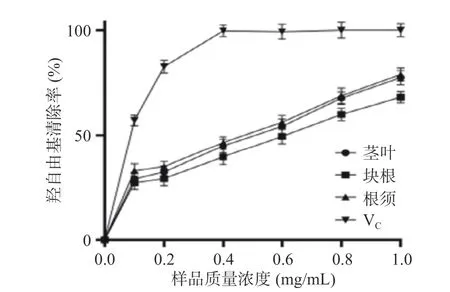
图5 三叶青对羟自由基清除率的影响Fig.5 Scavenging effect of Tetrastigma hemsleyanum Diels et Gilg on hydroxyl radical
2.6.4 三叶青黄酮提取物的还原能力 由图6 可知,在测试的质量浓度范围内,VC和三叶青的还原能力随着浓度的升高而增强。在1.0 mg/mL 时,VC的吸光度值为0.785;三叶青茎叶、块根、根须的吸光度值分别为0.172、0.153、0.184。虽然三叶青的还原力较VC弱,但也表现出一定的还原力,且茎叶和根须的还原能力较块根更强。
2.7 三叶青不同部位抗炎能力测定
2.7.1 MTT 法筛选给药安全浓度 如图7 所示,三叶青三部位的给药浓度在25~200 μg/mL 范围内时,RAW264.7 细胞存活率无明显下降,表明三叶青提取物在此浓度范围内无细胞毒性,可作为安全给药剂量范围。当三叶青给药浓度上升到400 μg/mL 时,细胞存活率显著性下降(P<0.05),表明此时已产生细胞毒性。故本实验选用25~200 μg/mL 作为安全剂量浓度,用于后续实验。

图7 三叶青黄酮提取物对RAW264.7 细胞存活率的影响(±s,n=3)Fig.7 Effect of flavonoid extract of Tetrastigma hemsleyanum Diels et Gilg on the viability of RAW264.7 cells(±s,n=3)
2.7.2 三叶青对LPS 诱导的RAW264.7 细胞NO 释放的影响 炎症是生物体对抗外来有害物质或损伤的防御性反应,通过释放NO 等炎症介质或因子对抗细菌、病毒等入侵物质,以维持机体平衡。NO 是一种独特的内源性信号分子,参与正常生理活动;然而,炎症反应过度爆发时,NO 会异常过量表达,导致炎症加剧,其与多种炎症疾病的发生和发展密切相关,通常被认为是炎症产生的标志和用作体外抗炎药物筛选模型[27-28]。本实验采用LPS 刺激RAW264.7细胞产生炎症介质NO 对待测样品进行抗炎活性筛选,结合MTT 法所得的安全浓度影响,实验结果表明,与正常组相比,模型组细胞NO 含量极显著上升(P<0.001);与模型组相比,阿司匹林组细胞NO 释放量极显著性降低(P<0.001)。三叶青不同部位各给药组NO 释放量呈剂量依赖性降低,均有显著性差异(P<0.01),三叶青三个部位提取物均可以降低LPS 诱导的RAW264.7 细胞NO 含量,且块根和根须样品在浓度达到200 μg/mL 时,表现出比阿司匹林更好的抗炎活性图8。
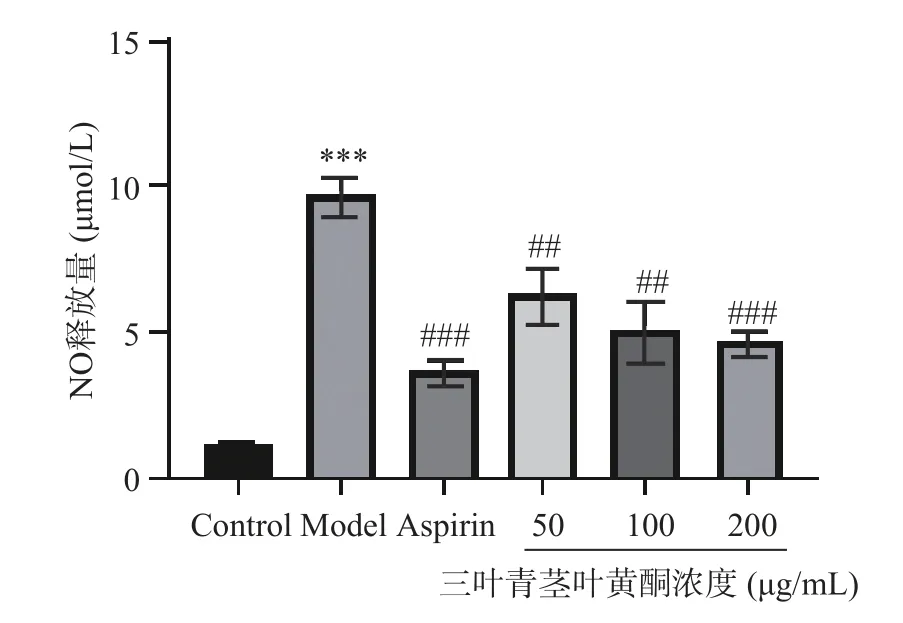

图8 三叶青黄酮提取物对LPS 诱导的RAW264.7 细胞NO 释放量的影响(±s,n=3)Fig.8 Effect of flavonoid extract of Tetrastigma hemsleyanum Diels et Gilg on LPS-induced NO release in RAW264.7 cells(±s,n=3)
3 讨论与结论
本研究采用醇提工艺,测出的结果与吉庆勇等[29]测定的人工种植和野生三叶青地下块茎的总黄酮含量相近,各部位之间总黄酮含量没有显著性差异。从指纹图谱分析可知,三叶青茎叶中的成分更多,提示三叶青茎叶可以作为三叶青功效性部位的可能。
常用的体外抗氧化活性[30]评价包括自由基清除能力和还原能力,指在自由基溶液中加入抗氧化剂,两者反应产生的光学变化差异来反映抗氧化活性或根据抗氧化剂能将铁氰化钾还原,在700 nm 处有最大吸收峰。吸光值越大,表明样品还原力越强。本实验采用DPPH、ABTS+、羟自由基法及铁离子还原法进行分析,三叶青三部位均具有一定的抗氧化活性,茎叶和根须的IC50值均比块根高,显示出三叶青茎叶和根须具有更强的抗氧化活性。
有研究报道三叶青黄酮可以通过减轻LPS 诱导的炎症细胞渗出和促炎因子分泌达到抗炎的作用[31],故本实验使用LPS 诱导的RAW264.7 巨噬细胞对三叶青不同部位进行抗炎活性研究,结果表明在安全浓度范围内,三叶青不同部位的黄酮提取物均能使细胞培养液中的NO 含量显著降低,这说明三叶青三部位均表现出良好的抗炎作用。
对于种植采收时抛弃的三叶青茎叶和根须而言,是一种很大的资源浪费。本实验为仿野生种植三叶青茎叶和根须的资源开发利用提供参考依据,也为加快三叶青药材全资源利用和食品、保健品的开发奠定基础。

