人参不定根总皂苷的提取工艺优化及其抗氧化与抗疲劳作用
邢艺缤,王馨悦,王慕尧,齐 欣, ,崔承弼,2,
(1.延边大学农学院,吉林延吉 133000;2.延边大学药学院,吉林延吉 133000)
疲劳是指由于运动过度而引起的机能生理功能减弱,导致不能持续维持特定的运动水平的现象,即运动性疲劳[1]。通常会表现为极度疲倦、疲惫或虚弱,若疲劳不能及时消除,还可造成一系列继发性问题,如焦虑、失眠、抑郁、身体功能障碍、认知障碍、能量失衡,严重甚至会导致与生物调节和免疫系统相关的严重疾病[2-3]。疲劳的机制很复杂,主要包括以下几种理论,一种是LD 和BUN 等代谢物的过度产生和积累导致肌肉疲劳[4];另一种是“自由基理论”,即自由基是体内各种生化反应的结果,具有强氧化性。自由基过度积累可导致生物大分子氧化,并影响人体器官。因此抗氧化和抗疲劳之间可能存在着关联[5]。
人参(Panax ginseng C.A.Mey)具有很高的药用价值,其主要成分是人参皂苷,是人参中主要活性成分,属于固醇类化合物,又称为三萜皂苷。人参皂苷主要的功效与作用包括提高机体免疫力、抗菌、改善心脑血管的供血不足、调节中枢神经系统以及抗疲劳和延缓衰老等,人参开发前景巨大,但由于野生人参受气候环境的变化经常造成质量波动,且随着近年来野生人参资源被过度开采,再加上人工种植栽培时间长,易受环境因素影响,不能满足国内外市场的需要。因此使用组织培养技术诱导和大规模生产不定根,是缓解人参皂苷供给不足,实现可持续生产的有效手段[6-7]。人参不定根(ginseng adventitious roots,GAR)是一种通过生物发酵技术培养出的人参组织培养物[8],GAR 在遗传信息层面与野生人参具有很高的相似性,还具有成本低、产量高、易于控制和生长周期短等独特优势[9-10],可得到更多的生物量及代谢产物,其所产生的人参皂苷含量、种类也与天然人参相似。Murthy 等[11]通过高效液相色谱法对组织培养的山参不定根和栽培的高丽参根中的人参皂苷进行了化学分析,发现两种植物中活性成分都含有Rb1、Rc、Rd、Rg1 等,且与正常人参相比,GAR 中人参皂苷的含量更高。屈青松等[12]优化了人参皂苷的提取工艺,提高人参皂苷转化率,并测定其具有抗氧化活性。蓝瑞高等[13]研究发现人参皂苷可以增加肌/肝糖原含量,降低LA、BUN 水平,有效缓解运动性疲劳。吕世鑫等[14]研究发现西洋参不定根总皂苷具有较好的DPPH 和OH 自由基清除能力,有较强的抗氧化性。目前GAR 已批准认为与5 年以下人参实质等同,可以作为新食品原料在食品中应用,但是利用生物反应器生产出的GAR,其化学成分积累及生物活性可能与传统人参相比具有其独特性,因此研究GAR 中的总皂苷具有重要意义。
本试验以乙醇回流法提取的GARS 为研究对象,采用单因素实验考察提取时间、提取温度、乙醇浓度、料液比对GARS 得率的影响,进一步进行正交试验对GARS 的提取工艺进行优化,测定其体外抗氧化活性,通过动物实验来评定其抗疲劳作用。本文探究了影响GARS 含量的多种因素及抗氧化、抗疲劳作用,为GAR 资源的开发利用提供了良好理论基础,为GAR 作为一种良好的抗氧化剂原料和开发具有抗疲劳性质的功能性食品提供参考。
1 材料与方法
1.1 材料与仪器
人参不定根 大连农科院提供,将其根洗净、切断、晒干;昆明小鼠 20 只,雄性,2 周龄,体重(18~22 g),延边大学实验动物中心提供,在恒温(23±2 ℃)、相对湿度55%±10%的食品研究中心动物室饲养,动物许可号:SYXK(吉)2020-0009;人参皂苷Re 标准品、ABTS 上海源叶生物科技有限公司;抗坏血酸(VC)国药集团化学试剂有限公司;DPPH、PTIO 梯希爱(上海)化成工发展有限公司;刺五加片 上海华源安徽仁济制药有限公司;肌/肝糖原测试盒、乳酸(LD)测试盒、乳酸脱氢酶(LDH)测试盒、尿素氮(BUN)测试盒 南京建成生物工程研究所。
DF-35 型落地式连续投料粉碎机 温岭市林大机械有限公司;HWS-24 型电热恒温水浴锅 上海一恒仪器有限公司;KQ3200DE 型数控超声波清洗器 昆山超声仪器公司;DHG-9620A 型立式鼓风干燥箱 上海百典设公司;LyoQuest-55 型实验型冷冻干燥机 西班牙Telstar 集团公司;N-1110 型旋蒸支架 东京理化器械株式会社;SK-0180-E 型摇床 大龙兴创试验仪器(北京)有限公司;TG16A-WS 型离心机、BXM-30R 型立式压力蒸汽灭菌 上海卢湘仪器有限公司;MS 3 basic 型涡旋混匀器 德国IKA 集团;SP-Max3500FL 型多功能荧光酶标仪 上海闪谱生物科技有限公司。
1.2 实验方法
1.2.1 人参不定根总皂苷的提取 将GAR 粉碎过80 目筛,得到粉末,用70%乙醇溶液按料液比1:10浸泡过夜,抽滤取上清液,沉淀继续按料液比1:10添加70%乙醇溶液混匀,重复抽滤步骤,合并滤液。将上清液在60 ℃条件下旋转蒸发,将残留物溶解于蒸馏水中,用水饱和正丁醇于分液漏斗中多次萃取至上层有机层澄清,合并上层,使用旋转蒸发器在50 ℃下蒸发正丁醇部分,加少量蒸馏水溶解后置于-80 ℃冷冻,冻干[15]。
1.2.2 人参不定根总皂苷含量测定
1.2.2.1 标准曲线的制备 取人参Re 对照品适量,精密称定,加甲醇制成每1 mL 含1 mg 的溶液,得到对照品溶液。精密吸取对照品溶液20、40、80、120、160、200 μL,分别置于具塞试管中,低温挥去溶剂,加入1%香草醛高氯酸试液0.5 mL,置60 ℃恒温水浴充分混匀后加热15 min,立即用冰水冷却2 min,加入77%硫酸溶液5 mL,摇匀;以对照品溶液作空白。消除气泡后按照“紫外-可见分光光度法”(通则0401),在540 nm 的波长处测定吸光度[16-17],经测定GARS 的标准曲线为y=1.9498x+0.0018(R2=0.9991)。
1.2.2.2 总皂苷含量测定 根据中国药典2015 版中人参总皂苷含量测定方法,取待测品约50 mg,精密称定,置于烧杯中,用25 mL 甲醇溶解并摇匀,精密吸取50 μL,照1.3.2.1 的方法,测定吸光度,带入GARS 的标准曲线,计算溶液中人参皂苷Re 含量,单位为mg/g,计算结果乘以校正系数0.84,即得[18]。
1.2.3 单因素实验 在利用乙醇水浴浸提法对GAR中的皂苷提取时,会有多种因素对提取效果产生影响。对主要影响因素:乙醇浓度、料液比、提取温度和提取时间进行单因素实验[19]。分别精密称取4 g GAR 粉末6 个样品,确定提取时间40 min,提取温度80 ℃,乙醇溶液浓度70%,料液比1:35 g/mL。分别考察乙醇浓度(40%、50%、60%、70%、80%、90%),料液比(1:20、1:25、1:30、1:35、1:40、1:45 g/mL),提取温度(40、50、60、70、80、90 ℃),提取时间(10、20、30、40、50、60 min)对GARS 含量的影响。
1.2.4 正交试验 在单因素实验结果的基础上,选择对GARS 含量影响最大的4 个因素[20],进行四因素三水平正交试验,因素与水平见表1。

表1 正交试验因素与水平Table 1 Factors and levels of orthogonal test
1.2.5 人参不定根总皂苷抗氧化活性测定
1.2.5.1 DPPH 自由基清除能力测定 用蒸馏水配制浓度为0.4、0.8、1.2、1.6、2.0 mg/mL 的人参不定根总皂苷提取液,取不同质量浓度的样品溶液20 μL加入配置好的DPPH 溶液180 μL 并充分混匀,在摇床450 r/min 避光反应20 min,以蒸馏水作为空白对照,以Vc 作为阳性对照,用酶标仪测量560 nm 波长处各组的吸光值,平行测定3 次,按公式(1)计算DPPH 自由基清除率[21]:
式中:A0为空白组吸光度;A1为实验组吸光度;A2为阴性对照组吸光度。
1.2.5.2 ABTS+自由基清除能力测定 用蒸馏水配制浓度为0.1、0.15、0.2、0.25、0.3 mg/mL 的人参不定根总皂苷提取液,取不同质量浓度的样品溶液30 μL 加入配置好的ABTS+溶液270 μL 并充分混匀,反应10 min,以蒸馏水作为空白对照,以Vc 作为阳性对照,用酶标仪测量405 nm 波长处各组的吸光值,平行测定3 次,按公式(2)计算ABTS+自由基清除率[22]:
式中:A0为空白组吸光度;A1为为实验组吸光度;A2为阴性对照组吸光度。
1.2.5.3 PTIO 自由基清除能力测定 用蒸馏水配制浓度为0.4、0.8、1.2、1.6、2.0 mg/mL 的人参不定根总皂苷提取液,取不同质量浓度的样品溶液0.2 mL加入配置好的PBS 贮备液、PTIO 溶液,水浴37 ℃避光反应3 h,以VC为阳性对照,用酶标仪测量在557 nm 波长处各组的吸光值,平行测定3 次,按公式(3)计算PTIO 自由基清除率[23]:
式中:A0为空白组吸光度;A 为实验组吸光度。
1.2.5.4 OH 自由基清除率的测定 用蒸馏水配制浓度为0.4、0.8、1.2、1.6、2.0 mg/mL 的人参不定根总皂苷提取液,取不同质量浓度的样品溶液2 mL、2 mL FeSO4溶液(10 mmol/L)、2 mL 水杨酸乙醇溶液(10 mmol/L)、再加入2 mL H2O2溶液(8.8 mmol/L)启动反应,在37 ℃恒温水浴加热30 min,以蒸馏水作为空白对照,以Vc 作为阳性对照,用酶标仪测量510 nm 波长处各组的吸光值,平行测定3 次[24],按公式(4)计算羟自由基清除率:
式中:A0为空白组吸光度;A1为实验组吸光度;A2阴性对照组吸光度。
1.2.5.5 O2-自由基清除率的测定 用蒸馏水配制浓度为0.4、0.8、1.2、1.6、2.0 mg/mL 的人参不定根总皂苷提取液,取不同质量浓度的样品溶液0.2 mL,加入pH8.2 的50 mmol/L 的Tris-HCl 缓冲液5.6 mL,于25 ℃水浴20 min,立即加入3 mmol/L 邻苯三酚溶液0.2 mL,反应5 min,用酶标仪测量510 nm 波长处各组的吸光值[25],平行测定3 次,按公式(5)计算O2-自由基清除率:
式中:A0为空白组;A1为实验组;A2为阴性对照组。
1.2.5.6 还原力的测定 用蒸馏水配制浓度为0.4、0.8、1.2、1.6、2.0 mg/mL 的人参不定根总皂苷提取液,取不同质量浓度的样品溶液2.5 mL,依次加入2.5 mL 0.2 mol/L 的磷酸盐缓冲溶液(pH6.6),2.5 mL 1%的K3Fe(CN)6溶液,于50 ℃水浴20 min,再加入2.5 mL 10%的三氯乙酸溶液,4000 r/min 下离心10 min。取2.5 mL 上清液,加入2.5 mL 蒸馏水,0.5 mL 0.1%的FeC13溶液,混匀反应10 min,以VC为阳性对照,用酶标仪测量700 nm 波长处各组的吸光值[26],平行三次测定。
1.2.6 试验动物分组与给药 将20 只昆明鼠平均分成五组,每组各4 只,依次分为空白对照组(蒸馏水)、阳性对照组(刺五加 500 mg/kg·BW)、高剂量组(GARS 500 mg/kg·BW)、中剂量组(GARS 250 mg/kg·BW)、低剂量组(GARS 50 mg/kg·BW)[27],正常饲养,并每天记录体重,适应性培养7 d 后连续灌胃28 d[28]。
1.2.7 小鼠爬杆时间测定 第28 d 灌胃1 h 后,进行小鼠爬杆实验。准备一根表面光滑的塑料棒,并把爬杆架放置于水温20~25 ℃、水深约30 cm 的水箱中进行试验,将小鼠放置在塑料棒的顶端,使其肌肉处于静力紧张状态,记录小鼠从爬杆开始,持续到肌肉疲劳,无力抱住塑料棒而掉落到水中的时间。按照此方法,于小鼠第3 次跌落时停止实验,累计3 次的总时间作为爬杆时间,爬杆结束后将小鼠擦干继续饲养[29]。
1.2.8 小鼠力竭游泳时间测定 待小鼠休息一晚后,将小鼠放置于水温20~25 ℃、水深约30 cm 的游泳箱中进行游泳实验,时刻观察小鼠,要保证小鼠尾部不触碰游泳箱底部,当发现小鼠静止漂浮于水面时用玻璃棒轻轻敲击小鼠身体,使其肌肉一直处于紧张状态,让小鼠不停的游泳。小鼠游泳力竭表现为头部沉入水中并在10 s 内不露出水面,将其捞出并记录时间[30]。
1.2.9 小鼠基础指标的测定
1.2.9.1 小鼠试验前后体重、体重增加量测定 每天在灌胃前测量小鼠的体重[31]并加以记录,于28 d 后依据各组数据进行分析。
1.2.9.2 小鼠肌糖原/肝糖原含量的测定 小鼠在力竭游泳实验后休息0.5 h,用乙醚迷晕后取眼球血,装入EP 试管中。将小鼠脱颈取出小鼠的肝脏、腿部肌肉,将其浸泡于生理盐水漂洗后,滤纸吸干,称重(样品重量≤100 mg 为宜,不要>100 mg),具体试验操作方法按照试剂盒说明书,对肌糖原/肝糖原含量进行测定。
1.2.9.3 小鼠血液中乳酸、乳酸脱氢酶、尿素氮含量的测定 用乙醚将小鼠迷晕后取眼球血,装入EP 试管中,置于冰袋上保持低温。将得到的血液进行离心,转速3000 r/min,温度25 ℃,时间10 min 后,按照试剂盒说明书,吸取上层血清测定乳酸、乳酸脱氢酶、尿素氮含量。
1.3 数据处理
使用Origin 软件对数据进行统计并绘制图表,以均值±标准偏差的形式表示;利用SPSS 22.0 进行统计学分析,采用单因素方差分析,P<0.05 表示存在显著性差异,P>0.05 表示无显著性差异。
2 结果与分析
2.1 人参不定根总皂苷提取工艺单因素实验结果
如图1A 所示,随着乙醇浓度的增加,GARS含量也随之提高,当乙醇浓度达到70%时,GARS 含量最高。而当乙醇浓度持续增加,GARS 含量会有所下降,其极性降低,这是因为乙醇浓度的不同导致极性也不同,70%乙醇极性与GARS 极性相似,根据相似相溶原理,得率较高,但乙醇浓度超出一定范围时,提取溶剂与GARS 极性会有很大差别,某些脂溶性物质的溶出量增加,各种杂质增多,会对皂苷的浸出有一定的影响,从而导致总皂苷含量降低,所以70%的乙醇溶液为最佳溶剂体积分数。
如图1B 所示,当料液比增加,GARS 含量呈现出递增趋势,在料液比1:30 g/mL 时,GARS 含量最大,之后呈现出下降趋势,其原因是当溶剂量增加时,试样与溶剂的接触面积也会随之增加,在料液比1:30 g/mL 时,溶剂充分包裹试样,然后持续增大溶剂量,不会影响GARS 的含量。另外,随着溶剂量的增加,非皂苷的杂质溶出也会随之增大,从而阻碍GARS 的溶出,并降低其含量,因此最优料液比是1:30 g/mL。
如图1C 所示,温度在40~70 ℃,GARS 含量随温度的增大而增大,当温度高于70 ℃,GARS 含量达到峰值,温度上升到90 ℃,GARS 含量也随之下降,但随着温度的升高,分子的热量提高溶液的粘度,总皂苷萃取系数的增加随水解速度的增加而增加;但温度过高易分解总皂苷的分子结构,对总皂苷的分子结构造成损伤,使其含量下降,因此70 ℃是提取最佳温度。
如图1D 所示,提取时间低于40 min,GARS含量随提取时间的延长而增加,在40 min 时达到高峰值,在超过40 min 后则渐趋稳定,但随着提取时间的逐步拉长,GARS 含量有小幅度降低,可能由于在最初阶段萃取溶液迅速包裹试样,提取液中皂苷类物质浓度迅速增加,而随着浸泡时间的增长,试样在提取液中慢慢沉淀,从而使得提取液中的有效物质降低,所以40 min 是最佳提取时间。
2.2 人参不定根总皂苷提取正交试验结果
在单因素实验的基础上,进行四因素三水平正交试验,正交试验结果与分析见表2。
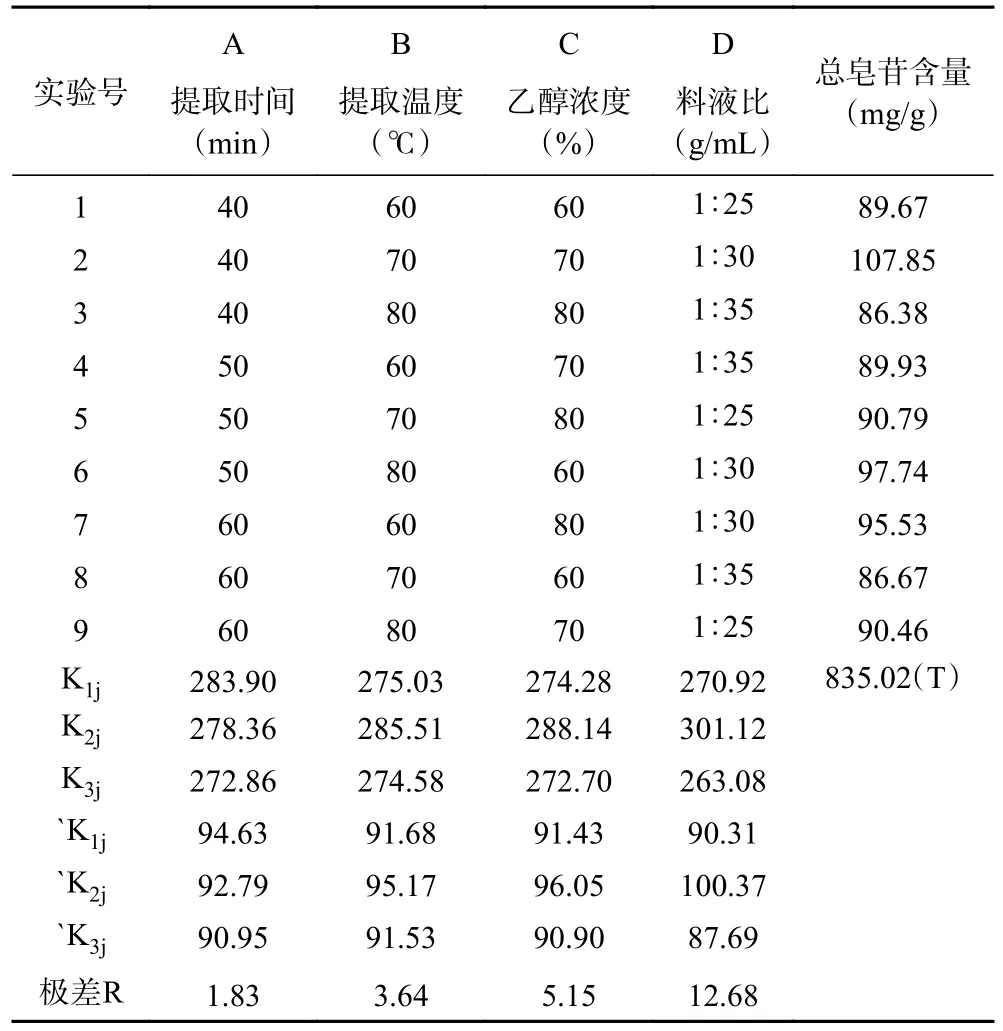
表2 正交试验结果与分析Table 2 Experimental results and analyses for optimization of total flavonoids
由表2 可知,依据直观分析法中极差R 的大小,对因素进行主次排列,次序为:D>C>B>A,即料液比是最主要的因素,其次为乙醇浓度,其最佳组合为A1B2C2D2。由表3 可知,乙醇浓度、料液比、提取温度和提取时间对GARS 的得率均有显著影响(P<0.05)。因此GARS 含量最高时的正交试验最佳方案为:乙醇浓度70%,料液比1:30 g/mL,提取温度70 ℃,提取时间40 min,该条件下提取到的GARS 含量为107.85 mg/g。方差分析结果如表3所示。
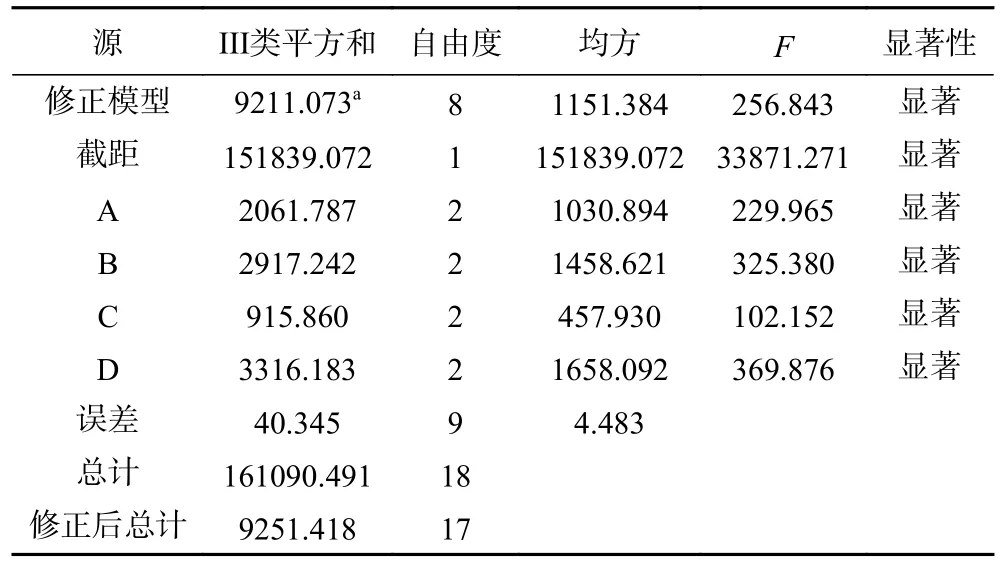
表3 方差分析结果Table 3 Analysis of variance results
2.3 人参不定根总皂苷抗氧化活性测定
DPPH 自由基在有机溶剂中长期存在的,其在波长715 nm 处的吸收能力最强。当DPPH 被清除时,其在最大吸收波长715 nm 处可以检测到吸光值逐渐减小,来判断抗氧化活性的强弱。由图2A 可知,随着浓度的不断增加,GARS 对DPPH 自由基的清除能力逐渐加强,并且在浓度0.4~1.2 mg/mL,GARS对DPPH 自由基清除率均有显著性差异(P<0.05),但浓度在1.2~2.0 mg/mL,GARS 对DPPH 自由基清除率逐渐放缓。由此可见,GARS 对DPPH 自由基具有一定的清除作用。
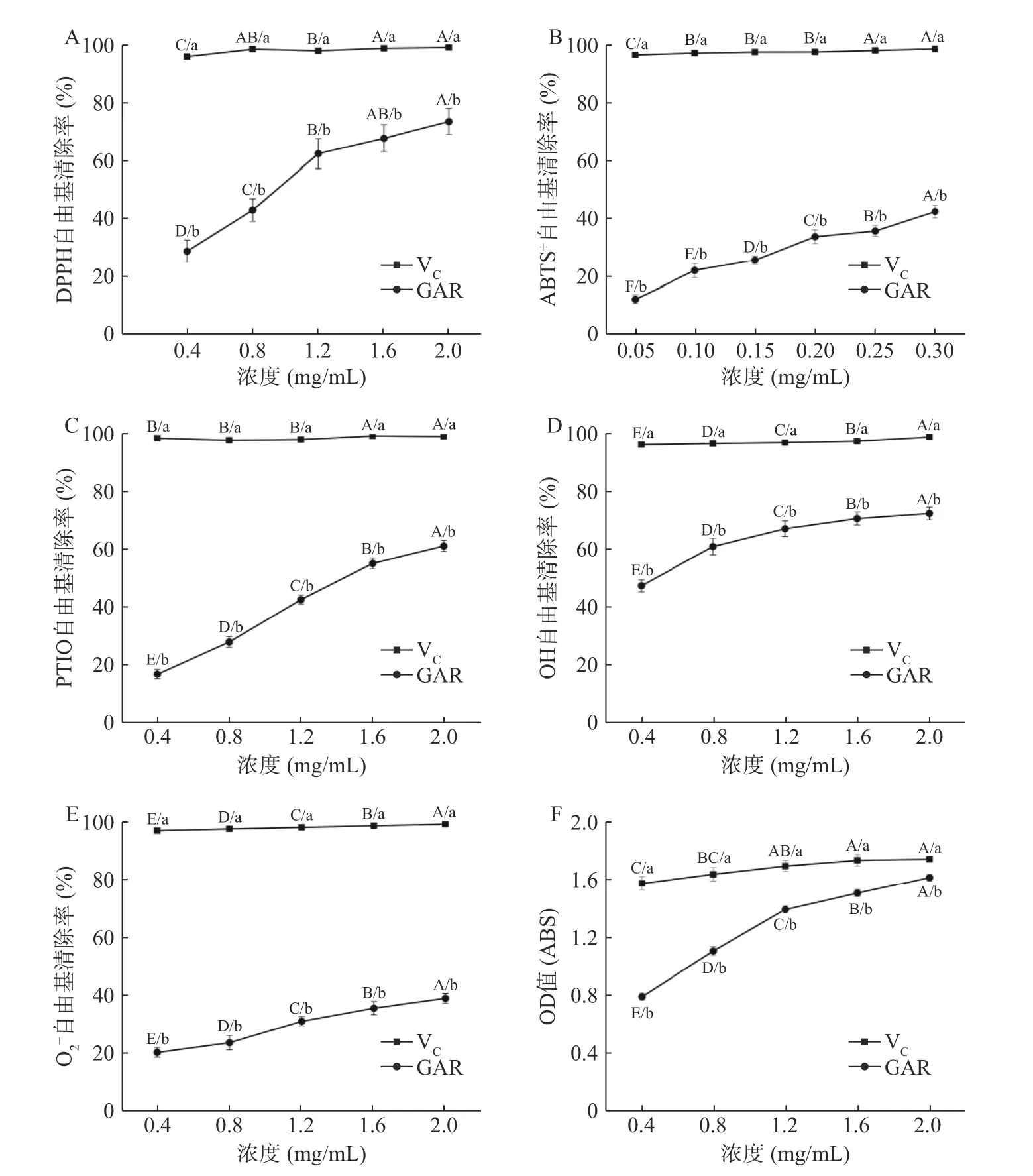
图2 人参不定根总皂苷的抗氧化活性的测定结果Fig.2 Determination results of antioxidant activity of GARS
过硫酸钾与ABTS+反应生成稳定的阳离子自由基,GARS 与自由基反应,使反应体系褪色,以此来检测样品的抗氧化能力。由图2B 可知,GARS 对ABTS+自由基的清除能力随着浓度增大而逐渐加强。虽然在浓度0.4~2 mg/mL,GARS 对ABTS+自由基清除率均有显著性差异(P<0.05),但与VC相比有较大的差距。由此可见,GARS 对ABTS+自由基有一定程度的清除作用。
PTIO 溶解后为紫色溶液,当有抗氧化剂清除PTIO 时,溶液颜色会减淡,通过测量吸光度的改变可以测量抗氧化活性。PTIO 有良好的稳定性,呈剂量依赖性关系且测量简单直接。由图2C 可知,随着浓度的不断增加,GARS 对PTIO 自由基的清除能力逐渐加强。GARS 浓度在0.4~2.0 mg/mL,其对PTIO自由基清除率均有显著性差异(P<0.05)。由此可见GARS 对PTIO 自由基具有一定的清除能力。
OH 自由基是活性氧自由基中毒性最大的一种自由基,若人体中有过多的OH 自由基,会影响细胞膜而产生活性氧和过氧化氢,从而导致诸如易疲劳、老化、突变、动脉硬化等症状,使人体的健康受到严重危害。由图2D 可知,随着GARS 浓度的不断增加,OH 自由基的清除能力逐渐加强。GARS 浓度从0.4 mg/mL 增长到2.0 mg/mL 过程中,其对OH自由基清除率均有显著性差异(P<0.05)。但随着浓度增长,其对OH 自由基清除能力逐渐趋于平稳。由此可见,GARS 对OH 自由基具有一定程度的清除能力。
O2-自由基是指在人体代谢中产生的未配对电子原子团,虽然其氧化性与其他氧自由基比较弱,但它在代谢过程中会分解成氧化性很强的单线态氧自由基或OH 自由基,从而造成生物大分子结构的变化或细胞组织损伤,使人产生疲劳。由图2E 可知,O2-自由基清除率随GARS 浓度的增加而升高,GARS 浓度在0.4~2.0 mg/mL,其对O2-自由基清除率均有显著性差异(P<0.05),但其对O2-自由基的清除率要远远低于VC。由此可见,GARS 对O2-自由基仅仅只有一定程度的清除作用。
抗氧化活性的机制主要包括还原力机制,链引发的抑制机制,过渡金属离子催化剂的折叠机制,过氧化物的分解和自由基清除机理。因此,一种化合物的还原能力可以作为具有潜在抗氧化活性的一个重要指标。由图2F 可知,随着浓度不断升高,GARS的还原性不断增强,并且还原性与其浓度呈正相关。GARS 的最大OD 值与VC只相差了0.13,由此可见,GARS 具有较强的铁离子还原能力。
2.4 人参不定根总皂苷抗疲劳作用测定
2.4.1 人参不定根总皂苷对小鼠爬杆与力竭游泳时间的影响 小鼠爬杆和力竭游泳时间是评价抗疲劳能力的两种实验模型,它们能够很好地评价小鼠的疲劳耐受能力,再现性较高。由表4 可知,灌胃高剂量组时,小鼠运动时间延长最多,灌胃蒸馏水与灌胃低剂量组的爬杆时间不存在显著性差异(P>0.05),灌胃中剂量组、高剂量组与低剂量组的爬杆时间相比存在显著性差异(P<0.05)。高、中、低剂量组均增加小鼠爬杆和力竭游泳时间,高剂量组增加小鼠运动时间最多,表明GARS 具有增强疲劳小鼠运动耐力作用,并随着浓度的增加,效果越明显。
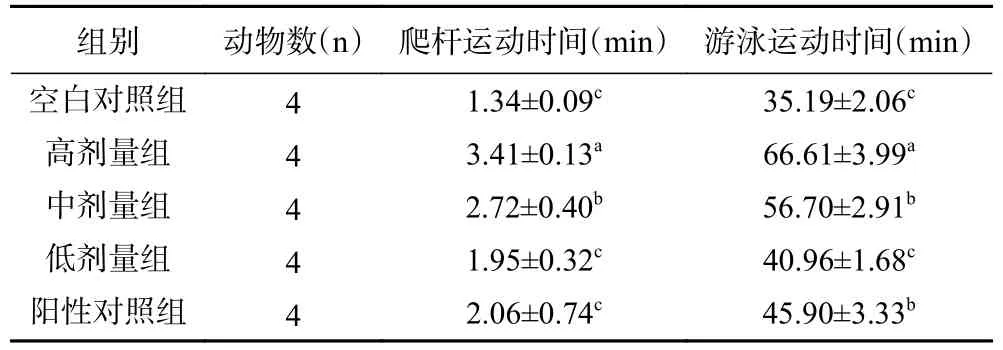
表4 小鼠爬杆和力竭游泳时间结果Table 4 Results of mice pole climbing and exhausted swimming time
2.4.2 小鼠试验前后体重、体重增加量结果 体重变化可以直接反映小鼠运动量的多少。由表5 可知,经过28 d 的灌胃后,空白对照组小鼠体重增长较快;灌胃刺五加提取物的阳性对照组小鼠体重较空白对照组小鼠有下降;灌胃蒸馏水小鼠的体重增加量与灌胃GARS 的高、中、低剂量组的体重增加量存在显著性差异(P<0.05),相比于空白对照组小鼠,高、中、低剂量组小鼠体重有明显降低,其中高剂量组体重最轻,表明小鼠运动加剧,并随着GARS 浓度增加,小鼠运动量逐渐增加。

表5 试验前后小鼠体重指标变化Table 5 Mouse index results before and after the test
2.4.3 小鼠肌糖原和肝糖原含量测定结果 糖原是主要的能源储备物质,糖和糖原在体内可以相互转化。在机体调节下,血糖浓度高时,糖可以转化为糖原储存;血糖浓度低时,糖原又可以转化为糖释放到血液中,以维持血糖浓度。所以,糖原储备的多少直接影响运动能力的强弱。在机体剧烈运动时,肝糖原可以转化为糖进入血液而供能;肌糖原通过无氧酵解,直接为肌肉供能,以延长运动时间。因此,能量储备物质肝糖原和肌糖原可以作为机体抗疲劳指标。由表6 可知,灌胃蒸馏水小鼠的肌/肝糖原含量与低剂量组相比不存在显著性差异(P>0.05),灌胃中剂量组、高剂量组的肌/肝糖原含量与低剂量组相比存在显著性差异(P<0.05)。低剂量组灌胃剂量较少,对肌/肝糖原含量影响较小,因此与空白对照组相比差异不显著(P<0.05)。而高剂量组灌胃剂量最多,小鼠肌/肝糖原含量最高,所以高剂量对提高小鼠肌/肝糖原含量最有效,表明GARS 能增加小鼠体内肌/肝糖原的贮存,从而为运动提供更多能量。
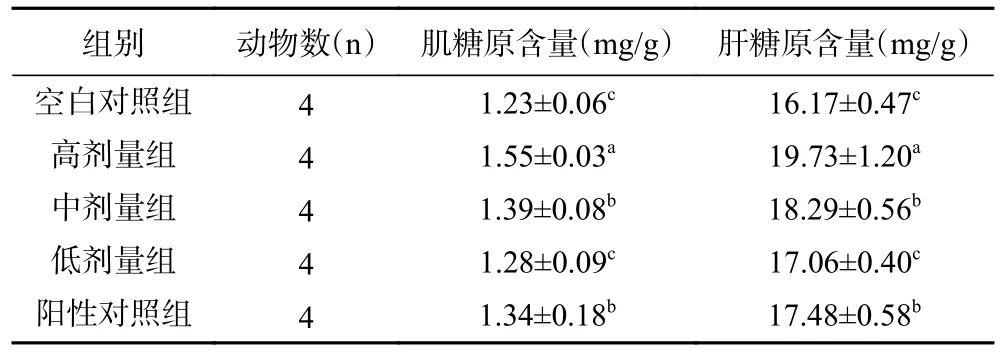
表6 各组小鼠肌糖原与肝糖原含量Table 6 Muscle glycogen and liver glycogen content in mice of each group
2.4.4 小鼠乳酸、尿素氮含量和乳酸脱氢酶活性测定结果 长时间的剧烈运动会增加肌肉的氧气消耗,导致机体相对缺氧,此时肌肉中的糖原会被分解产生乳酸,为机体提供能量。但大量乳酸的产生则会影响机体内环境的酸碱平衡,引起肌肉酸痛,导致肌肉运动能力下降。同时为了满足能量需求,蛋白质的代谢显著增加,使肝脏中的尿素水平明显增加,过量的尿素会在体内积累并对机体造成危害。BUN 的含量在一定程度上可以反映机体的疲劳程度。LDH 的主要作用是将肌肉中过多乳酸转变为丙酮酸,从而减少乳酸的积累。LDH 活力越强,乳酸的转变越多,抗疲劳性就越强。由表7 可知,灌胃蒸馏水小鼠的LD 含量与低剂量组相比存在显著性差异(P<0.05),灌胃中剂量组与低剂量组相比不存在显著性差异(P>0.05)。空白对照组小鼠LD 含量最高,高剂量组LD 含量最低。灌胃高剂量组时对于降低LD 含量最有效;灌胃蒸馏水小鼠的BUN 含量与低剂量组相比存在显著性差异(P<0.05),灌胃中剂量组与低剂量组相比不存在差异性显著(P>0.05)。空白对照组小鼠BUN 含量最高,高剂量组BUN 含量最低,灌胃高剂量组对于降低BUN 含量最有效,表明GARS 能减少蛋白质分解,降低疲劳小鼠血清尿素氮的生成;灌胃蒸馏水小鼠的LDH 活性与低剂量组相比存在显著性差异(P<0.05),灌胃中剂量组与低剂量组相比存在显著性差异(P<0.05),灌胃高剂量组与中剂量组相比存在显著性差异(P<0.05)。空白对照组LDH 活性最低,高剂量组LDH 活性最高。灌胃高剂量组时对于提高LDH 活性最有效,表明随着GARS 浓度增大,体内乳酸脱氢酶的活力增强,从而减少体内乳酸的累积。
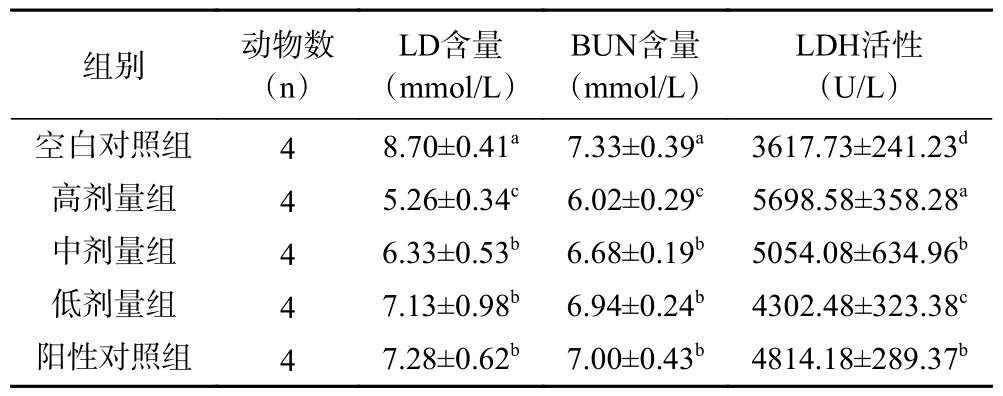
表7 各组小鼠LD、BUN 含量和LDH 活性Table 7 LD,BUN content and LDH activity of mice in each group
3 结论
本实验通过优化提取工艺,有效减少对提取活性成分的影响,缩短提取时间,从而提高GARS 含量。通过体外抗氧化实验和动物实验,表明GARS具有抗氧化和抗疲劳活性,与人参总皂苷的功能相似。因此本研究为研发GARS 抗氧化和抗疲劳相关药物和功能性食品等深加工产品提供理论基础和技术参考。但本试验没有测定体内抗氧化活性,难以反映GAR 在体内真实的抗氧化水平,不能确定GARS是否有通过清除体内自由基来缓解疲劳的作用,有待进一步研究。

