长链非编码RNA RP11-641D5.1通过靶向微小RNA-486-5p调控急性髓系白血病细胞增殖、细胞周期和免疫逃逸实验研究
敖会芳,黄 华,王红权,刘 俊,郭春梅,姚 云
(1.荆楚理工学院附属中心医院 荆门市人民医院血液内科,湖北 荆门 448000;2.荆楚理工学院附属中心医院 荆门市人民医院感染性疾病科,湖北 荆门 448000;3.大连医科大学附属第一医院肿瘤科,辽宁 大连 116011)
急性髓系白血病是成年人常见的血液系统肿瘤,起源于髓系造血干/祖细胞,表现为异常的幼稚细胞和原始细胞过度增殖[1-2]。急性髓系白血病患者5年生存率较低,且发病率表现为逐渐上升趋势,严重危害患者的生命健康[3]。目前,急性髓系白血病的发病机制并不清楚。长链非编码RNA(Long non-coding RNA,lncRNA)是一类无蛋白编码功能的单链RNA分子,广泛表达于真核细胞中,参与调控基因的转录和翻译[4]。随着生物信息学的发展,越来越多的研究[5-7]表明,lncRNA作为一种功能性RNA,影响多种肿瘤如黑色素瘤、骨肉瘤、胆管瘤、白血病的发生和发展。lncRNA不仅能够作为急性髓系白血病的诊断标志物,还具有潜在治疗价值,其在急性髓系白血病的靶向治疗方面发挥重要作用[8-9]。根据lncRNAdb数据库分析发现,RP11-641D5.1基因位于人染色体3q26.2区域,负责编码长度为410个核苷酸长度的lncRNA。RP11-641D5.1在恶性肿瘤特别是急性髓系白血病中的表达和功能尚未明确。本研究基于基因表达综合数据库(Gene Expression Omnibus,GEO)分析显示,急性髓系白血病患者骨髓组织中RP11-641D5.1表达明显低于正常骨髓组织。因此,本研究通过上调RP11-641D5.1表达分析急性髓系白血病细胞增殖、细胞周期和免疫逃逸的变化及可能的分子机制,为寻找急性髓系白血病诊疗的潜在靶标提供理论依据。
1 材料与方法
1.1 实验细胞与主要试剂 人骨髓基质细胞HS-5和急性髓系白血病细胞株(HL-60、SKM-1、THP-1、KG-1、NB4)购自中科院上海细胞库。微小RNA(miR)-486-5p、miR-NC、阴性质粒和RP11-641D5.1质粒(批号:STLC006、STLC008、MILC003、MILC004)购自广州锐博生物公司;TRIzol试剂、细胞周期试剂盒(批号:631460、672349)购自日本Takara公司;荧光素酶野生型载体RP11-641D5.1-WT和突变型载体RP11-641D5.1-MUT(批号:KHC0532、KHC0648)购自武汉三鹰科技有限公司;酶联免疫吸附试剂盒、Lipofectamine 3000、反转录试剂盒(批号:12356151、12445032、12749869)购自美国Invitrogen公司;双荧光素酶报告基因试剂盒(批号:HZYY9684)购自杭州禹扬科技有限公司;磷酸化酪氨酸激酶(p-JAK)、磷酸化转录激活因子(p-STAT)、β-微管蛋白(β-Tubulin)、信号转导和转录激活因子3(SOCS3)、核内原癌基因c-myc抗体(批号:ab32101、ab267373、ab18207、ab280884、ab185656)购自英国Abcam公司。
1.2 细胞培养与转染 用含13%胎牛血清的DMEM培养基培养HS-5、SKM-1细胞,用含13%胎牛血清的IMDM培养基培养HL-60细胞,用含13%胎牛血清的RPMI-1640培养基培养THP-1、KG-1、NB4细胞,在恒温和恒湿培养箱中常规培养。转染前18 h,将对数生长期SKM-1细胞接种在24孔板,采用Lipofectamine 3000脂质体试剂分别将阴性质粒(NC组)和RP11-641D5.1质粒(RP11-641D5.1组)转染到SKM-1细胞,最终浓度为50 nmol/L。
1.3 实验方法
1.3.1 实时定量PCR(RT-qPCR)检测RP11-641D5.1和miR-486-5p表达:用TRIzol试剂提取细胞总RNA,采用无核酸酶的双蒸水溶解,通过Nano Drop分光光度分析总RNA的纯度和浓度。采用反转录试剂盒反转录2.0 μg RNA为cDNA,在PCR扩增仪中进行RT-qPCR。以GAPDH或U6为内参,引物序列见表1。采用2-ΔΔCt法分析RP11-641D5.1和miR-486-5p表达。
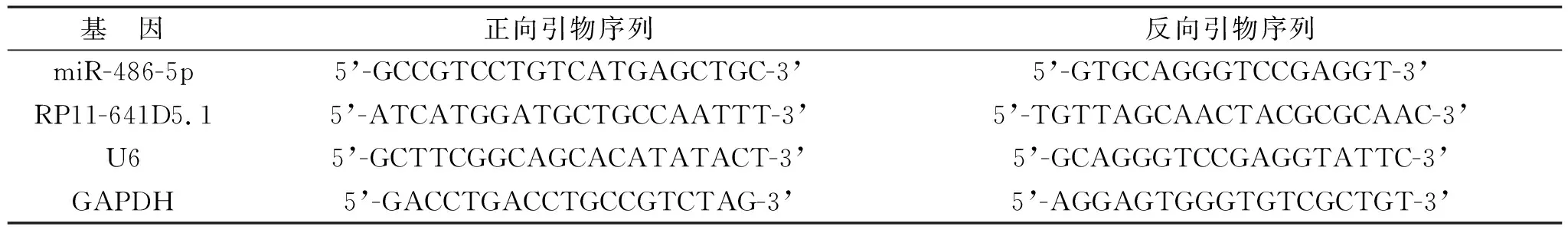
表1 各基因引物序列
1.3.2 集落形成实验检测SKM-1细胞增殖:将转染后的两组SKM-1细胞分别以3000个/孔重新接种于6孔板,每组5个复孔。恒温、恒湿培养11 d。采用2 ml无水甲醇固定SKM-1细胞,2 ml结晶紫染色,用双蒸水充分洗涤,烘干后观察两组SKM-1细胞的集落形成,统计分析并拍照。
1.3.3 流式细胞术检测SKM-1细胞周期:收集转染后的两组SKM-1细胞,制备为单细胞悬液。采用2 ml 75%乙醇在低温下固定SKM-1细胞,加入300 μl PI试剂染色15 min。通过筛网充分过滤两组细胞悬液,流式细胞仪分析SKM-1细胞的周期分布。
1.3.4 酶联免疫吸附实验检测细胞因子表达量:收集转染后的两组SKM-1细胞,分别加入T淋巴细胞共培养48 h。加入150 μl生物素标记的抗体工作液,室温下反应1.5 h。用磷酸盐缓冲液(PBS)洗5次,加入150 μl辣根过氧化物酶(HRP)标记的二抗工作液,室温下反应1 h。用PBS溶液洗5次,加入150 μl四甲基联苯胺(TMB)显色液,室温下反应1 h。加入150 μl终止液,采用全自动酶标仪分析各孔的光密度值,计算干扰素γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)的含量。
1.3.5 双荧光素酶报告实验检测RP11-641D5.1和miR-486-5p的靶向关系:用LncCeRBase软件预测RP11-641D5.1和miR-486-5p的结合位点。分别共转染RP11-641D5.1-WT与miR-NC、RP11-641D5.1-WT与miR-486-5p、RP11-641D5.1-MUT与miR-NC、RP11-641D5.1-MUT与miR-486-5p至对数生长期的SKM-1细胞,应用双荧光素酶报告基因试剂盒处理各组SKM-1细胞,荧光发光检测仪检测萤火虫荧光素活性以及海肾荧光素活性。
1.3.6 蛋白质印迹(Western blot)检测JAK-STAT3信号通路蛋白表达:配制含2%蛋白酶抑制剂的RIPA裂解液,提取转染后两组SKM-1细胞的总蛋白。取55 μg蛋白样品在13% SDS-PAGE胶电泳3 h,用260 mA电流转膜到聚偏二氯乙烯膜。加入快速封闭液,室温下封闭20 min。制备一抗稀释液,均按照1∶2000进行稀释,低温孵育一抗17 h。ECL显影试剂处理2 min后,在暗室内曝光并显影。

2 结 果
2.1 急性髓系白血病细胞株中RP11-641D5.1表达情况 见图1。RT-qPCR结果显示,相对于HS-5细胞,急性髓系白血病细胞株HL-60、SKM-1、THP-1、KG-1、NB4中RP11-641D5.1表达较低,且SKM-1细胞中表达最低(均P<0.05)。故后续采用SKM-1细胞进行实验。

注:与HS-5比较,*P<0.05;与SKM-1比较,#P<0.05图1 急性髓系白血病细胞株中RP11-641D5.1表达比较
2.2 两组SKM-1细胞RP11-641D5.1表达量比较 转染实验结果显示,NC组与RP11-641D5.1组中RP11-641D5.1相对表达量分别为1.03±0.25和10.17±0.79。与NC组比较,RP11-641D5.1组SKM-1细胞中RP11-641D5.1表达量升高(P<0.05)。
2.3 过表达RP11-641D5.1对SKM-1细胞增殖的影响 见图2。集落形成实验结果显示,NC组和RP11-641D5.1组SKM-1细胞集落形成数量分别为(116.86±15.43)个和(42.70±11.14)个。与NC组比较,RP11-641D5.1组SKM-1细胞集落形成数量减少(P<0.05)。

注:左图为两组细胞结晶紫染色结果;右图中,与NC组比较,*P<0.05图2 过表达RP11-641D5.1对SKM-1细胞增殖的影响
2.4 过表达RP11-641D5.1对SKM-1细胞周期的影响 见图3。流式细胞术结果显示,与NC组比较,RP11-641D5.1组G0/G1期细胞比例升高,S期和G2/M期细胞比例降低(均P<0.05)。

注:与NC组比较,*P<0.05图3 过表达RP11-641D5.1对SKM-1细胞周期的影响
2.5 过表达RP11-641D5.1对SKM-1细胞IFN-γ、TNF-α、IL-2含量的影响 见图4。酶联免疫吸附实验结果显示,与NC组比较,RP11-641D5.1组共培养的T淋巴细胞释放的细胞因子IFN-γ、TNF-α、IL-2含量升高(均P<0.05)。

注:与NC组比较,*P<0.05图4 过表达RP11-641D5.1对SKM-1细胞IFN-γ、TNF-α、IL-2含量的影响
2.6 双荧光素酶报告实验结果 见图5、6。LncCeRBase软件预测结果显示,RP11-641D5.1与miR-486-5p存在互补结合序列,miR-486-5p可能为RP11-641D5.1的靶基因。双荧光素酶报告实验结果显示,与miR-NC比较,miR-486-5p能够抑制RP11-641D5.1-WT的荧光素酶活性(P<0.05),而对RP11-641D5.1-MUT的荧光素酶活性无显著影响(P>0.05)。

图5 RP11-641D5.1与miR-486-5p的结合位点
2.7 过表达RP11-641D5.1对 miR-486-5p表达的影响 RT-qPCR结果显示,NC组与RP11-641D5.1组SKM-1细胞中miR-486-5p相对表达量分别为6.15±0.37和0.98±0.30。与NC组比较,RP11-641D5.1组SKM-1细胞中miR-486-5p表达水平降低(P<0.05)。
2.8 过表达RP11-641D5.1对JAK-STAT3信号通路蛋白表达的影响 见图7。Western blot结果显示,与NC组比较,RP11-641D5.1组JAK-STAT3信号通路蛋白p-JAK、p-STAT、SOCS3、c-myc蛋白表达水平降低(均P<0.05)。
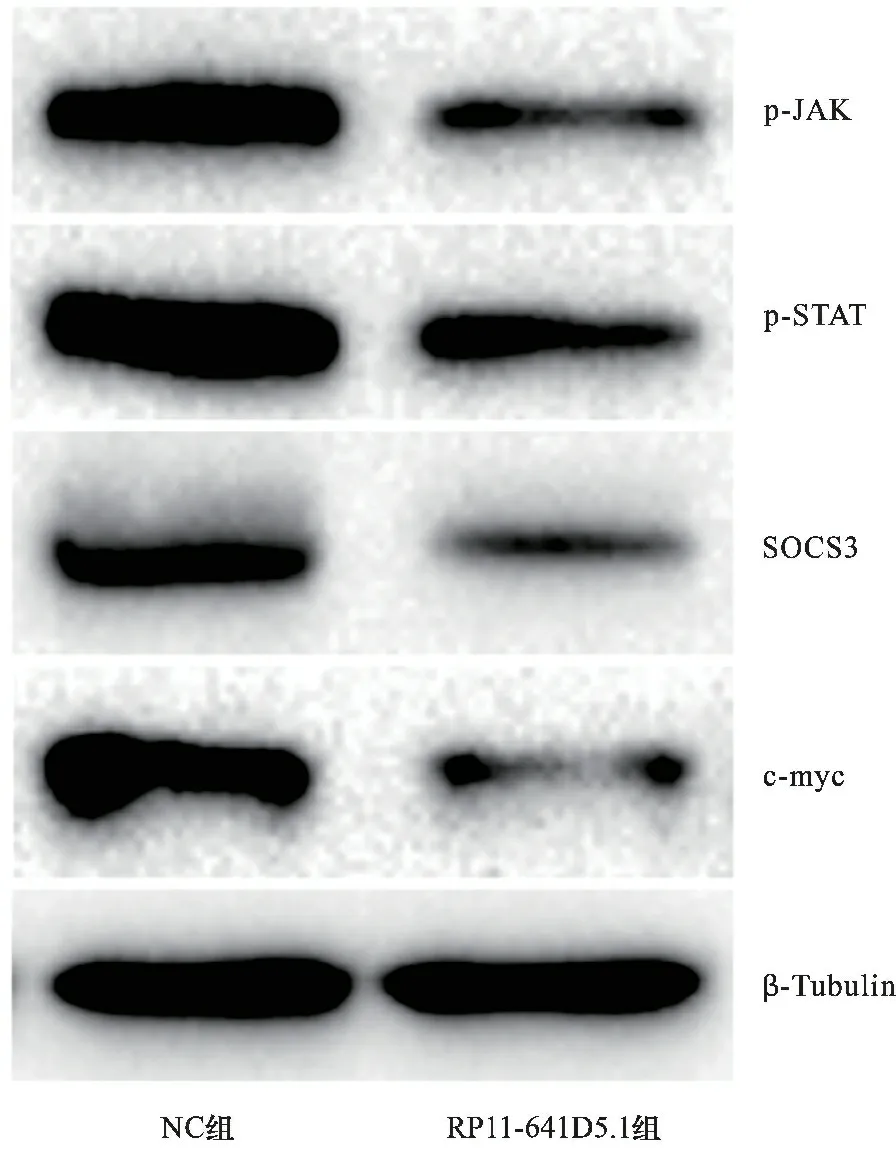
图7 JAK-STAT3信号通路蛋白电泳图
3 讨 论
lncRNA是非编码RNA家族的重要成员,参与细胞的各种活动如氨基酸代谢、脂肪消化、糖异生等[10-11]。近年来研究[12-13]发现,lncRNA在肺鳞癌、三阴性乳腺癌、鼻咽癌等多种肿瘤中异常表达,能够促进或抑制肿瘤细胞的生长、凋亡和免疫逃逸。越来越多的lncRNA被证明参与急性髓系白血病的发生、发展过程,与患者预后呈负相关或正相关[14-15]。例如,lncRNA USP30-AS1在急性髓系白血病中高表达,其高表达与急性髓系白血病预后不良有关,lncRNA USP30-AS1可促进急性髓系白血病细胞活力、免疫逃逸并抑制细胞凋亡[16]。研究[17]发现,与正常骨髓组织相比,lncRNA MAFG-AS1在急性髓系白血病中过表达,通过海绵化miR-147b促进急性髓系白血病HL-60细胞生长、细胞周期进展和上皮间充质转化。目前,RP11-641D5.1在肿瘤中的表达模式和作用研究较少。
GEO数据库分析显示,RP11-641D5.1在急性髓系白血病患者骨髓组织中呈低表达。本研究中,RP11-641D5.1在急性髓系白血病HL-60、SKM-1、THP-1、KG-1、NB4细胞中也呈低表达,其可能是急性髓系白血病诊断的分子标记。本研究结果显示,过表达RP11-641D5.1的急性髓系白血病SKM-1细胞增殖活力显著降低,同时细胞在G0/G1期发生阻滞,细胞IFN-γ、TNF-α、IL-2含量增加,表明细胞的免疫逃逸显著被抑制,提示RP11-641D5.1在急性髓系白血病细胞中可能为抑癌基因。研究[18-21]证实,lncRNA主要作为竞争性内源性RNA充当分子海绵,定向结合miRNA。本研究利用LncCeRBase软件分析发现,miR-486-5p与RP11-641D5.1存在结合位点。双荧光素酶报告实验检测发现,RP11-641D5.1能够靶向结合miR-486-5p。miR-486-5p在卵巢癌、胰腺癌、非小细胞肺癌等多种恶性肿瘤组织和细胞中高表达,能够促进肿瘤细胞的生长和分化,在肿瘤发生及发展过程中发挥关键作用[22-24]。研究[25]表明,miR-486-5p在急性髓系白血病中表达上调,能够显著促进急性髓系白血病的恶性生物学行为。本研究采用RT-qPCR检测发现过表达RP11-641D5.1后miR-486-5p表达量下调。以上实验结果说明,RP11-641D5.1可作为miR-486-5p的竞争性内源性RNA发挥作用。多项研究表明,JAK-STAT3信号通路在急性髓系白血病细胞中异常表达,其激活能够加速急性髓系白血病细胞周期进展,促进肿瘤细胞的增殖和免疫逃逸。已有研究[23]证实,miR-486-5p主要通过介导激活JAK-STAT3信号通路促进急性髓系白血病的发展。本研究又发现,过表达RP11-641D5.1后JAK-STAT3信号通路相关蛋白p-JAK、p-STAT、SOCS3、c-myc活性降低。进一步研究证明RP11-641D5.1通过调控miR-486-5p表达参与急性髓系白血病的发展。
综上所述,RP11-641D5.1在急性髓系白血病中表达水平降低,可能通过下调miR-486-5p表达抑制急性髓系白血病细胞增殖、周期进展及免疫逃逸。RP11-641D5.1可能成为急性髓系白血病分子治疗的潜在靶点。本研究的不足之处在于RP11-641D5.1是否在体内同样对急性髓系白血病细胞的生长和免疫逃逸具有抑制作用,本研究下一步将通过建立急性髓系白血病小鼠模型探究RP11-641D5.1在体内的抑癌作用。

