胃息肉合并结直肠息肉风险诺谟图预测模型的构建与验证
赵洋洋 李紫琼 马 欣 木克热木·依明尼亚孜 高 峰
新疆维吾尔自治区人民医院新疆消化系统疾病临床医学研究中心,新疆乌鲁木齐 830000
结直肠癌为人类第三大常见癌症,全世界每年有200 多万人确诊,有100 万人死于结直肠癌[1]。通过结肠镜检查、切除结肠息肉是预防结肠癌的重要手段,人群中结肠腺瘤的检出率提高1%,则发生结直肠恶性肿瘤的概率可下降3%[2]。我国同时为胃癌高发国家,胃息肉为癌前病变,胃镜下行息肉治疗对降低胃癌的发生率具有重要意义[3]。一项纳入37 152 例患者的meta 分析发现,与无胃息肉患者比较,胃息肉合并发生结肠息肉的概率增加15%[4]。当患者行胃镜检查发现胃息肉时,临床医生不免会遇到问题,即是否应该建议患者行结肠镜检查,由于结肠镜的侵入性、不便性和所需的准备工作,若对每位胃息肉患者均完善结肠镜检查势必造成医疗资源浪费。查阅文献,目前尚无相应的管理策略。故本研究分析了胃息肉合并结肠息肉患者的基本资料,筛选出独立预测因子,更为重要的是,单纯筛查出预测因子无法形象、具体地表明各个因子之间的交互作用,故本研究建立了预测模型,并进一步验证模型的预测效能,为医务人员判断胃息肉合并结直肠息肉患者的风险及是否需进一步完善结肠镜检查提供理论依据。
1.资料与方法
1.1 一般资料
回顾性收集2021 年9 月至2022 年11 月新疆维吾尔自治区人民医院消化内科行胃镜检查诊断胃息肉并进一步完善结肠镜检查的患者679 例为建模组;依据结肠镜检查结果将其分为有结直肠息肉组与无结直肠息肉组。另收集2022 年12 月至2023 年5月新疆维吾尔自治区人民医院消化内科诊断胃息肉并完善结肠镜检查的患者241 例为验证组。本研究经新疆维吾尔自治区人民医院伦理委员会批准(YBK2022090229)。
1.2 纳入及排除标准
纳入标准:①完善胃镜及结肠镜检查,且胃镜下提示存在胃息肉;②一般资料完整。排除标准:①既往确诊结直肠息肉、肿瘤、炎症性肠病;②既往有胃、结直肠手术史;③合并有胃、结直肠恶性肿瘤,包括胃、结直肠黏膜高级别上皮内瘤变;④肠道准备不充分,或由各种原因所致的内镜检查不完整,存在结肠镜下漏诊可能;⑤严重的肝肾功能不全、凝血功能障碍。
1.3 研究方法
收集患者相关资料,包括性别、年龄、体重指数(body mass index,BMI)、幽门螺杆菌(Helicobacter Pylori,H.pylori)感染状况、胆固醇、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(lowdensity lipoprotein,LDL)、胆囊手术史、胆囊炎、高甘油三酯血症、高同型半胱氨酸血症、非酒精性脂肪性肝病、高血压病、冠心病、2 型糖尿病、吸烟史、饮酒史、内镜资料等。
胃息肉及结直肠息肉诊断依据医师内镜下诊断及病理结果;由至少5 年经验的内窥镜医生行胃肠镜操作;胃肠镜病理均至少由两位病理学专家确认。所有生化检验均为清晨空腹采集;H.pylori 感染诊断依据14C 或13C 呼气试验结果;吸烟定义为过去的半年内,每天吸烟≥1 支;饮酒定义为过去的3 个月内,摄入乙醇>50 g。
1.4 统计学方法
采用SPSS 26.0、R 4.1.3 统计学软件进行数据分析。计量资料采用均数±标准差(±s)表示,比较采用t 检验;计数资料采用例数或百分率表示,比较采用χ2检验;胃息肉合并结直肠息肉的影响因素采用logistic 回归分析,构建诺谟图预测模型;建立受试者操作特征(receiver operating characteristic,ROC)曲线评估模型的区分度;采用Hosmer-Lemeshow 拟合优度检验判断模型的拟合优度,并绘制校正曲线;绘制临床决策曲线图评估患者获益情况。以P <0.05 为差异有统计学意义。
2 结果
2.1 建模组与验证组一般资料比较
建模组与验证组一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。

表1 建模组及验证组一般资料比较
2.2 有结直肠息肉组和无结直肠息肉一般资料比较
建模组中有268 例发现结直肠息肉,发生率为39.5%。有结直肠息肉组和无结直肠息肉组非酒精性脂肪性肝病、H.pylori 感染、高同型半胱氨酸血症、2型糖尿病、高血压病、高甘油三酯血症、年龄比较,差异有统计学意义(P<0.05)。见表2。
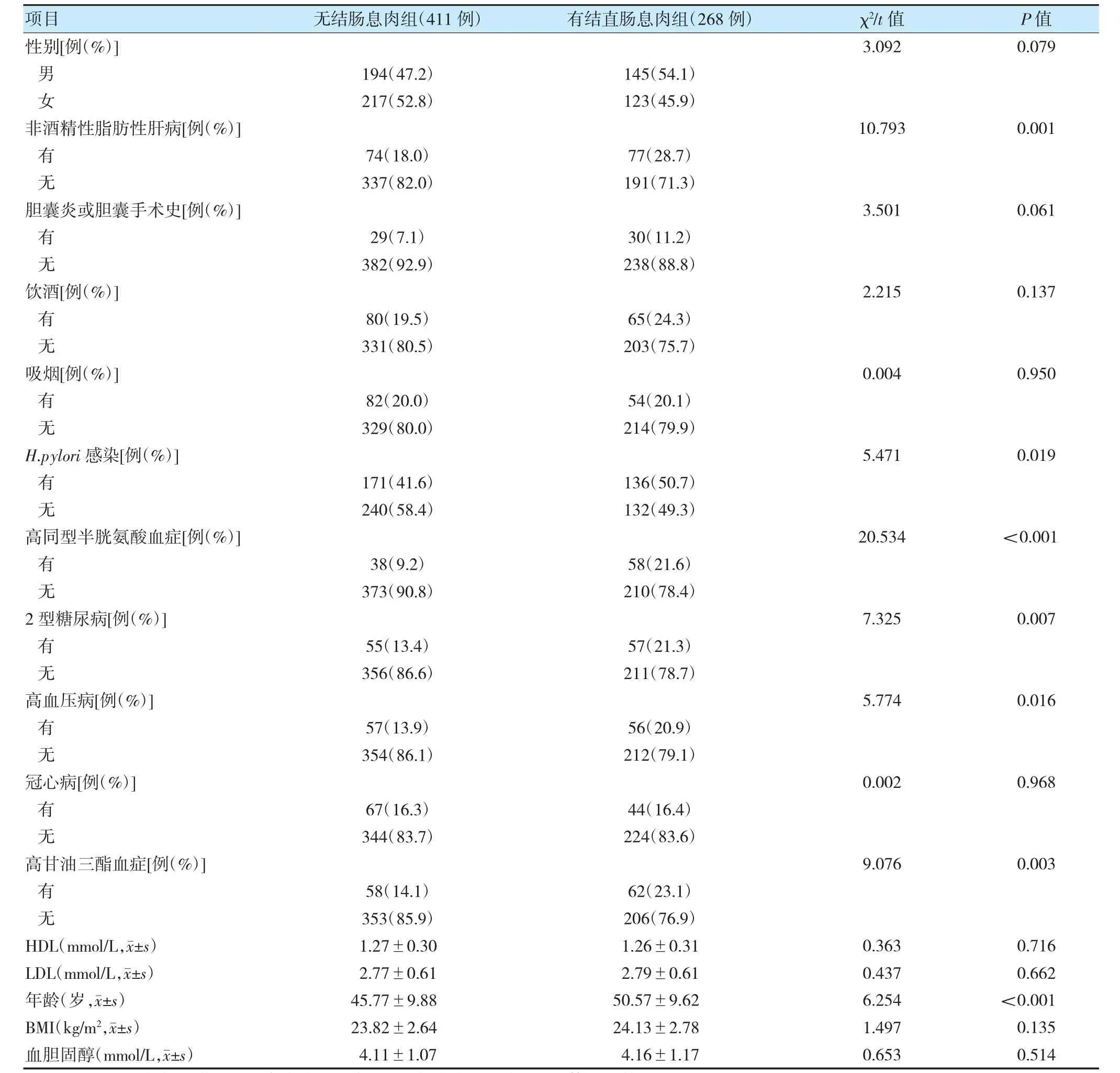
表2 有结直肠息肉组和无结直肠息肉一般资料比较
2.3 胃息肉合并结直肠息肉影响因素分析
以胃息肉是否合并结直肠息肉为因变量,“2.1”中差异有统计学意义(P<0.05)的因素作为自变量,相关赋值信息见表3。logistic 回归分析结果显示,非酒精性脂肪性肝病(OR=3.317)、H.pylori 感染(OR=3.018)、高同型半胱氨酸血症(OR=3.697)、高甘油三酯血症(OR=4.248)、年龄(OR=1.065)是胃息肉合并结直肠息肉的独立危险因素(P<0.05)。见表4。
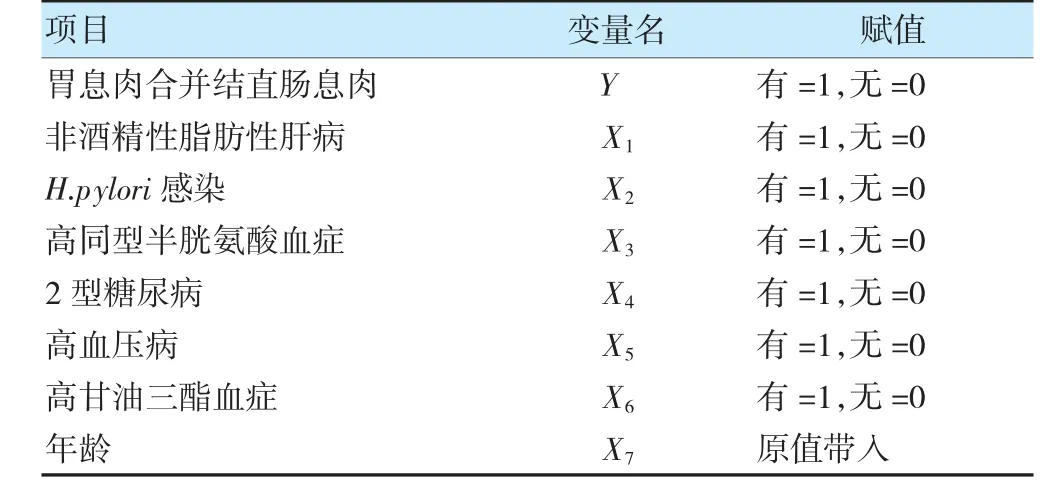
表3 变量赋值情况

表4 胃息肉合并结直肠息肉影响因素分析
2.4 胃息肉合并结直肠息肉的预测模型构建及验证
采用表3 中的预测因子构建预测模型,并绘制诺谟图,见图1;建模组诺谟图预测模型ROC 曲线的曲线下面积(area under the curve,AUC)为0.742,验证组AUC 为0.737,模型具有较好的区分度,见图2;预测模型经Hosmer-Lemeshow 拟合优度检验,校正曲线提示实际发生率和预测发生率拟合度好,见图3;决策曲线图显示模型获益阈值广泛,具有实用价值,见图4。

图1 胃息肉合并结直肠息肉风险诺谟图

图2 建模组与验证组的ROC 曲线

图3 建模组与验证组的校准曲线图

图4 建模组与验证组的决策曲线图
3 讨论
本研究建立了胃息肉患者发生结直肠息肉风险的预测模型,该模型包含的预测因子为非酒精性脂肪性肝病、H.pylori 感染、高同型半胱氨酸血症、高甘油三酯血症、年龄。模型对某事件结局的区分能力可通过绘制ROC 曲线并计算AUC 来评价,AUC 越接近1,提示模型对事件结局的区分能力越强[5]。本研究结果显示,建模组及验证组AUC 分别为0.742 及0.737,提示模型的区分度较好。经Hosmer-Lemeshow 拟合优度检验并绘制校正曲线,校正曲线与实际情况无明显偏倚,提示模型拟合度好,可充分利用数据反映实际情况。模型有较好的区分度及校准度仍是不够的,好的模型还需要有实用价值,故本研究进一步绘制决策曲线评估使用预测模型提供决策是否利大于弊[6-7]。本研究中决策风险曲线图提示该模型具有较为广泛的阈值概率,具有实用价值。在临床工作中,医务人员可使用此模型作为参考,更精确评估胃息肉合并结直肠息肉的风险,以及为是否建议进一步完善结肠镜检查提供依据,更加合理利用医疗资源。
本研究发现,胃息肉患者年龄越大,合并结直肠息肉的风险越大,与既往研究一致[8-9]。可能与随着年龄增长,胃酸、胃蛋白酶分泌衰减,更多的病原可逃避胃酸屏障,免疫系统对病变细胞的识别、清除能力下降有关,为结直肠息肉的发生提供有利环境[10]。Shiao 等[11]结果表明,结直肠肿瘤者血同型半胱氨酸水平明显高于健康人群,可能是因为高同型半胱氨酸降低了S-腺苷甲硫氨酸及叶酸水平,增加炎症反应及氧化应激,使细胞的正常合成、修复受损,促进细胞异常增生[12-14]。本研究未纳入叶酸这一指标,是因为血清叶酸水平受患者饮食影响大,可因患者抽血前饮食发生改变,但同型半胱氨酸受此影响较小[15]。甘油三酯水平升高促进结直肠息肉的发生,潜在的作用机制可能涉及三种途径:①高甘油三酯血症与高胰岛素血症和胰岛素抵抗有关,可抑制细胞凋亡;②高甘油三酯血症诱导炎症因子及活性氧的产生;③癌症干细胞与结肠息肉的发生有关,富含脂滴的癌症干细胞具有更高的致瘤潜能[1,16-18]。除上述代谢相关因素外,本研究显示,非酒精性脂肪性肝病可增加结直肠息肉发生的风险。Chen等[19]通过对414 例患者的病例对照研究发现,44.1%的非酒精性脂肪性肝病患者发现了结直肠息肉,而无脂肪肝的患者中,息肉检出率为27.1%。非酒精性脂肪性肝病被认为是高脂血症、胰岛素抵抗等疾病的肝脏表现,除上述可能机制外,非酒精性脂肪性肝病可影响胆汁酸的代谢及肠道菌群失调,对结肠上皮产生有害刺激,这可能是导致结直肠腺瘤发生的因素[20-22]。H.pylori 感染可作为独立预测因子,解释H.pylori 感染在结直肠息肉的形成和发展中作用的潜在机制,包括H.pylori 诱导的CpG 岛甲基化、炎症反应、肠道微生物组的改变及毒素和化学介质(如胃泌素)的释放及CagA 基因导致的细胞异常磷酸化等[23-26]。
本研究具有一定的局限性,对于某些强相关的因素,如结直肠肿瘤家族史、炎症性肠病等,因该类患者本身即建议行常规结肠镜检查,而不论有无其他危险因素,故本研究未将其纳入;本研究未进一步区分胃息肉及结肠息肉的病理类型,未来可进一步划分,尤其针对结直肠腺瘤。本研究虽对预测模型进行了验证,但数据来源于同一医疗机构,存在一定的选择偏倚;该模型部分使用回顾性数据,对某些因素,如吸烟、饮酒等,病案资料可能存在记录不完整而对结果有一定影响,未来可行前瞻性研究。
利益冲突声明:本文所有作者均声明不存在利益冲突。

