新型PCV2 衣壳融合蛋白在HEK293F 细胞瞬时表达研究
罗清平, 彭 妍, ALⅠ Mohsin, 庄英萍,, 郭美锦,
(1.华东理工大学生物反应器工程国家重点实验室, 上海 200237;2.上海国佳生化工程技术研究中心有限公司, 上海 200237)
猪圆环病毒2 型(Porcine Circovirus type 2,PCV2)是引发猪圆环病毒相关性疾病(Porcine Circovirus Associated Disease, PCVAD)的传染病原[1],已给全球猪养殖行业带来了巨大损失。目前已发现8 种亚型如 PCV2a、 PCV2b、 PCV2c、 PCV2d、 PCV2e、PCV2f、PCV2g 和PCV2h[2-3],其中PCV2b 流行最为广泛[4]。PCV2 病毒衣壳蛋白是构成病毒外壳结构的唯一结构蛋白,含有中和表位诱导机体产生保护性免疫反应,被广泛应用于亚单位疫苗开发生产。目前PCV2 亚单位疫苗技术路线主要采用原核生物和杆状病毒/昆虫表达系统。现国内外开发上市的多种PCV2 疫苗能够减少疾病的发生,也造成新病毒株的产生,引起免疫逃逸问题。因此,开发新型PCV2疫苗及探索新的表达方式具有非常重要的意义。
PCV2 衣壳蛋白在多个宿主表达系统中进行了表达研究。采用大肠杆菌[5]和毕氏酵母[6-7]表达全长PCV2 衣壳蛋白时存在难表达问题,在切除蛋白N 端前导序列能够改善蛋白的表达水平[8]。另外,杆状病毒/昆虫系统具有高效表达外源蛋白的表达系统[9-10],采用pFastBac 载体和Sf9 细胞, 获得PCV2 衣壳蛋白150 μg/mL 的表达水平[11]。然而,在哺乳动物细胞系统表达PCV2 衣壳蛋白方面研究相对缺乏。瞬时基因表达(Transient Gene Expression, TGE)技术是将外源表达载体瞬时转染哺乳细胞实现外源蛋白快速表达的方式。由于能够快速获取目标蛋白并进行后续蛋白研究,该技术得到广泛应用[12-15]。尽管存在对一些外源蛋白瞬时表达水平低的问题[16-19],但有研究报道,采用降低培养温度、提高培养系统渗透压、补加蛋白胨添加物,以及细胞本身工程化改造等方式能够提高外源蛋白瞬时表达水平[20-24]。
本文对不同宿主细胞、转染试剂、转染试剂与质粒比例及孵育时间等多个因素进行考察,研究在哺乳动物细胞瞬时表达PCV2 病毒衣壳蛋白对细胞转染效率的影响。采用电泳阻滞实验及负染色透射电子显微镜方法揭示了混合时间对PEⅠ与DNA形成复合物的电荷与大小存在影响。另外,为了提高PCV2 衣壳蛋白的表达水平以及增强蛋白免疫原性,本文对PCV2 衣壳蛋白进行了工程化改造,设计如下:以免疫逃逸型猪圆环病毒2b 型NDSU41513毒株衣壳蛋白,去除N 端富含碱性氨基酸的41 位氨基酸,并通过链接子在C 端与猪源ⅠgG Fc 片段进行连接,设计出新型PCV2 Capsid (△1-41aa)-Fc(pig)protein(PCFP)分子。在3 L 反应器中对HEK293F细胞进行瞬时转染,成功实现了PCFP 融合蛋白在哺乳细胞HEK293F 中的表达,为病毒类蛋白在哺乳动物表达系统中的表达和制备提供很好的探索。
1 材料与方法
1.1 目的基因、细胞株、培养基及试剂
实验采用猪圆环病毒2 型 NDSU41513 毒株编码的衣壳蛋白基因(GenBank accession number KR 816332.1)。哺乳细胞细胞株HEK293F、Escherichia coliDH5α、质粒pEGFP-N1 和pcDNA3.1(+)来自实验室保藏。细胞株CHO-K1 由中科院友情提供。限制性内切酶NheⅠ和Hind ⅠⅠⅠ采购自德泰生物科技(南京)有限公司。pfu 酶,T4 DNA 连接酶等购自赛默飞世尔科技(中国)有限公司。25 kDa 和40 kDa线性聚乙烯亚胺转染试剂 (PEⅠ) 采购自懋康生物技术有限公司。摇瓶中所用培养基为Union 293 培养基,采购自永联生物科技(上海)有限公司。生物反应器培养中所用培养基为OPM-293 CD05 培养基,采购自上海奥浦迈生物科技有限公司。纯化及电泳分析所用试剂采购自碧云天生物科技有限公司。兔抗衣壳蛋白多克隆抗体一抗采购自美国Abcam 公司。HRP 标记的山羊抗兔抗体二抗采购自艾美捷科技有限公司。完全弗氏佐剂及不完全弗氏佐剂采购自西格玛奥德里奇(上海)贸易有限公司。商业化抗PCV2 亚单位疫苗(CSV)采购自青岛易邦生物工程有限公司。商业化小鼠(Mouse)圆环病毒2 型抗体(PCV-2-Ab)试剂盒采购自江苏菲亚生物科技有限公司。
1.2 实验仪器
蛋白纯化仪(美国GE 公司,AKTA explorer);搅拌式生物反应器(中国上海国强生化工程装备有限公司,FAS-3L 型);细胞培养自动控制系统软件(中国上海国强生化工程装备有限公司,V2.0 版本); PCR(Polymerase Chain Reaction)核酸扩增仪(中国北京东胜创新生物科技有限公司);超净工作台(中国苏州博讯仪器有限公司,ETC811 型);透射电子显微镜(日本电子株式会社,JEM-1400 型);超声破碎仪(美国Misonix 公司,QsonicaLLCQ125 型);CountStar 细胞计数仪(中国上海睿钰生物科技有限公司,MD F4 型);葡萄糖乳酸生化分析仪(中国山东省科学院生物研究所,SBA-40E 型)
1.3 实验方法
1.3.1 载体构建 构建pEGFP-N1-Capid 载体。以猪圆环病毒2 型 NDSU41513 毒株编码的衣壳蛋白基因(GenBank accession number KR816332.1)为基础,进行密码子优化, DNA 序列通过化学合成克隆到pUC57 载体(德泰生物科技有限公司)。在pUC57-Capsid 载体中,通过pEGFP-N1-Capid(PENC)引物用pfu 酶PCR 扩增出PCV2 衣壳蛋白基因片段(表1)。PCR 扩增反应条件为:95 ℃、3 min(95 ℃、25 s,66 ℃、20 s,72 ℃、40 s) 25 循环,72 ℃、1 min。使用TianGen纯化试剂盒(天根生化科技北京有限公司),回收PCR 扩增目标片段DNA,将回收PCR 产物与空载体pEGFP-N1 分别进行NheⅠ和Hind ⅠⅠⅠ酶双酶切,处理后使用T4 DNA 连接酶连接,构建载体pEGFP-N1-Capid。构建pcDNA3.1(+)-Capsid(△1-41aa)-Fc(pig)载体。Capsid(△1-41aa)-Fc(pig)基因序列是由PCV2衣壳蛋白基因通过链接子Linker(GSGGGSGGGG SGGGS)与猪血清免疫球蛋白G(ⅠgG)重链Fc 区域基因(序列ⅠD 为Gen Bank accession number AAD 38418.1)连接构成。表达的蛋白为PCFP 融合蛋白。同样将经密码子优化的Capsid(△1-41aa)-Fc(pig)序列通过化学合成克隆到pUC57 载体上。通过带有NheⅠ和Hind ⅠⅠⅠ酶切位点的pcDNA3.1(+)-Capsid(△1-41aa)-Fc(pig)(PDCF)引物(表1),PCR 扩增出Capsid(△1-41aa)-Fc(pig)基因片段。回收的扩增产物与空载体pcDNA3.1(+)DNA 分别进行限制性内切核酸酶NheⅠ和Hind ⅠⅠⅠ酶双酶切。T4 DNA 连接酶连接,构建重组质粒pcDNA3.1(+)-Capsid(△1-41aa)-Fc(pig)。
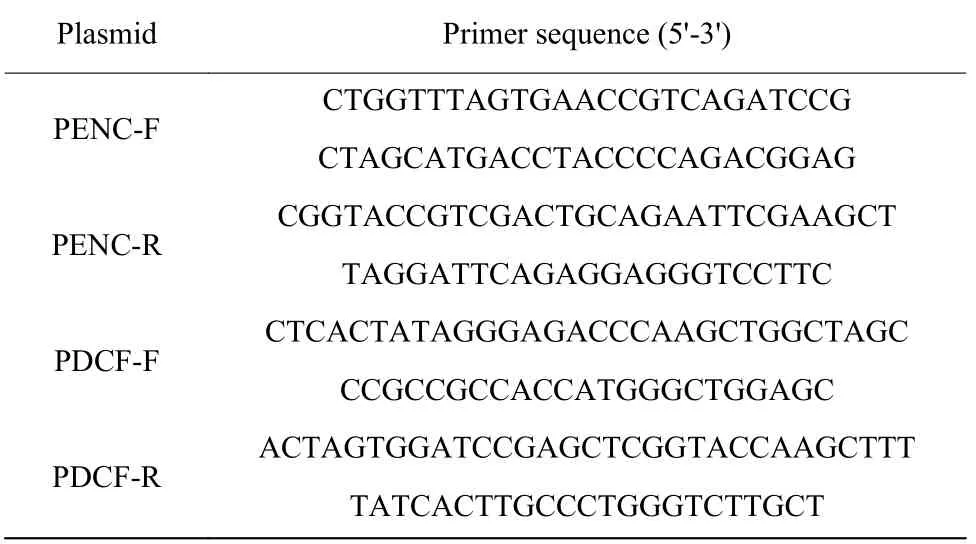
表1 实验所用的引物Table 1 Primers used in this study
1.3.2 细胞培养及转染表达方法 在摇瓶中进行培养。将悬浮HEK293F 细胞和CHO-K1 细胞接种在含有HT 的Union 293 培养基中,置于37 ℃、85%湿度、φ=5.0%二氧化碳、100 r/min 转速的摇床中培养。细胞在对数生长阶段,细胞活率超过95%细胞扩增。细胞转染时,DNA 质量浓度为1 mg/L,PEⅠ(Polyethylenimine)浓度依实验要求设定,将PEⅠ和DNA 按照相同体积进行混和,室温下静置30 min。将配制的PEⅠ/DNA 复合物加入到细胞密度约为1.0 ×106cells/mL 待转染细胞(HEK293F 或CHO 细胞)中。将细胞置于37 ℃、φ=5.0%二氧化碳、90 r/min转速的二氧化碳恒温摇床中进行培养。流加培养模式为补加葡萄糖,维持葡萄糖质量浓度为2~5 g/L。在3 L 生物反应器中对HEK293F细胞进行培养。将装1.2 L OPM-293 CD05 培养基的反应器的搅拌转速设定为120 r/min,温度维持在37 ℃,pH 控制在7.0±0.1,溶解氧浓度为50%。当活细胞密度为2.0×106cells/mL 时,以质量浓度2 mg/L pcDNA3.1(+)-PCV2 Capsid(△1-41aa) –Fc(pig)质粒,将PEⅠ-40kDa与质粒按照质量分数比6∶1 进行混合,孵育30 min后,瞬时转染HEK293F细胞。每天补加葡萄糖,维持葡萄糖质量浓度为2~5 g/L。
1.3.3 融合蛋白纯化 细胞生物反应器培养结束后离心收获细胞,将细胞湿重与pH7.4 的磷酸缓冲液按质量体积比1∶8 重悬,超声破碎。收集上清,0.22 μm膜过滤。同样,对细胞培养上清液,经0.22 μm 膜过滤收集进行亲和层析纯化。系统用平衡液以流速为4 mL/min 平衡10 个以上柱体积,然后将样品(流速为1.0 mL/min)进行上样至完成。使用0.1 mol/L 甘氨酸(pH 为3.0)的洗脱液进行洗脱,收集洗脱组分。使用1 mol/L Tris-HCl,pH 8.5 中和液,以体积比1∶10中和洗脱组分。
1.3.4 核酸琼脂糖电泳鉴定 配制1.0%(10 g/L)并添加有10000x GelRed 核酸染料的核酸琼脂糖凝胶,加入1x TAE 缓冲液,将分析样品与6x 上样染色缓冲液混匀进行上样。设定电压150 V,运行30 min。电泳完成后,拍照分析。
1.3.5 Western blot 分析 将样品进行SDS-PAGE 蛋白电泳,采用湿转方式电转到PVDF 膜。以350 mA电流模式,电转90 min。电转后的PVDF 膜,用PBST洗涤液进行清洗,再用快速封闭液(QuickBlockTM Western,上海碧云天生物技术有限公司)进行封闭15 min。将PVDF 膜置于一抗(兔抗衣壳蛋白多克隆抗体,体积比1∶1 000,美国Abcam 公司)中,于4 ℃下过夜孵育。用二抗(HRP标记的山羊抗兔抗体,体积比1∶2 500,艾美捷科技有限公司)室温孵育2 h。使用超敏ECL(Enhanced Chemiluminescent)化学发光试剂盒配制显色液(P0018S,碧云天生物技术有限公司),用Tanon 5020 仪器进行拍摄。采用ⅠmageJ 图像分析系统对PCFP 融合蛋白的表达量进行检测分析。
1.3.6 高分辨透射电子显微镜观测 取20 μL PEⅠ/DNA 复合物样品加在碳包裹铜网上。室温放置15~30 min,用滤纸吸附掉多余样品,用3%(30 g/L)磷钨酸(Phosphotungstic Acid, PTA)进行负染色,静置10 min,上样,观测样品形态与大小。对病毒样颗粒样品先稀释10 倍,取20 μL 测试目标蛋白样品加在碳包裹铜网上。采用相同的操作方式,观测样品形态与大小。
1.3.7 小鼠免疫及小鼠抗衣壳蛋白血清抗体检测
将4~6 周龄雌性BALB/c 小鼠在特定无病原体动物(SPF)级动物实验室饲养,保持在温度和光照受控的环境以及可随意获取食物和水条件,并在正式实验前饲养7 d。小鼠按随机分组,每组5 只小鼠。免疫方式采用腹腔注射。将PCFP 蛋白透析用缓冲液(1×PBS,pH 7.4)稀释,再按体积比1∶1 与完全弗氏佐剂或不完全弗氏佐剂进行混合乳化,制备成质量浓度为100 μg/mL 的实验疫苗,用于首免或加强免疫。在首免12 d 后进行一次加强免疫,注射体积为200 μL。小鼠眼眶取血,在第1 d、第14 d、第30 d 及第45 d 进行采集。转速1 000 r/min,10 min 离心。使用小鼠(Mouse)圆环病毒2 型抗体(PCV-2-Ab)试剂盒对样本进行抗体浓度测定。试剂盒采用衣壳蛋白作为抗原包被,根据试剂盒说明书进行操作,测定样品数值。小鼠免疫评测如表2 所示。
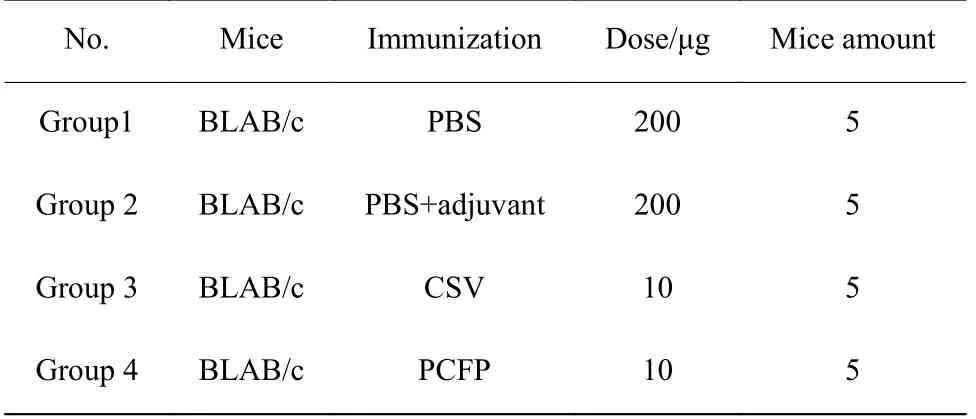
表2 小鼠免疫评测Table 2 Ⅰmmunogenicity evaluation in mice
1.3.8 数据统计 数据以means ± SD 表示平均值±标准误差。采用图形和数据统计分析软件(美国GraphPad Software 有限责任公司,GraphPadPrism 8 版本)进行分析,并使用未配对的t 检验(Student’s test)确定显著性。 *p<0.05 被认为具有统计学意义。
2 结果与讨论
2.1 重组质粒构建
采用PENC 引物(表1) 进行PCR 扩增,获得猪圆环病毒2 型 NDSU41513 毒株编码的衣壳蛋白基因(GenBank no.KR816332.1)片段。如图1(a)所示,在750 bp 处有PCR 扩增条带,条带大小与预期相符。将目标片段与pEGFP-N1 质粒双酶切后进行连接,构建pEGFP-N1-Capsid 重组质粒。DNA 测序显示重组质粒序列与目的序列完全一致,pEGFP-N1-Capid 重组质粒构建成功。设计了新的PCV2 衣壳融合蛋白PCFP,即将PCV2 衣壳蛋白的N 端1-41 位氨基酸切除,同时在C 端连接上猪ⅠgG Fc 片段。化学合成目的基因片段, 随后利用PDCF 引物(表1)进行PCR 扩增。如图1(b)所示,1 394 bp 处显示的条带大小与预期相符。将扩增的目的片段与pcDNA3.1(+)质粒双酶切后进行连接,构建pcDNA3.1(+)-Capsid(△1-41aa)-Fc(pig)重组质粒,并通过核酸序列测序确认质粒构建成功。

图1 PCR 扩增产物Fig.1 PCR products
2.2 PCV2 Capsid 基因在两种不同宿主细胞转染的差异
CHO-K1 和HEK293F 细胞广泛应用在外源蛋白瞬时表达。然而,对于不同性质的蛋白,不同细胞往往表现出不同的表达偏向性[25]。本文分别考察了空载体和带有PCV2 Capsid 基因的pEGFP-N1 质粒(pEGFP-N1-Capsid)在CHO-K1 和HEK293F 不同细胞转染效率的差异。结果显示(表3),在CHO-K1细胞中,转染空载质粒pEGFP-N1 的转染效率为24.12%,GFP 平均荧光强度值(RFU)为4 924.01,而转染pEGFP-N1-Capsid 质粒时,转染效率非常低,GFP的RFU 仅为82.90。而在HEK293F 细胞中,转染pEGFP-N1 质粒的转染效率达到35.48%,GFP 的RFU为13 506.92,pEGFP-N1-Capsid 质粒的转染效率仅为7.06%,GFP 的RFU 为434.63。实验结果表明,带有PCV2 Capsid 基因能够降低两种宿主细胞转染效率。然而,相对于CHO-K1 细胞,HEK293F 细胞在瞬时表达PCV2 Capsid 中表现出更好偏向性。
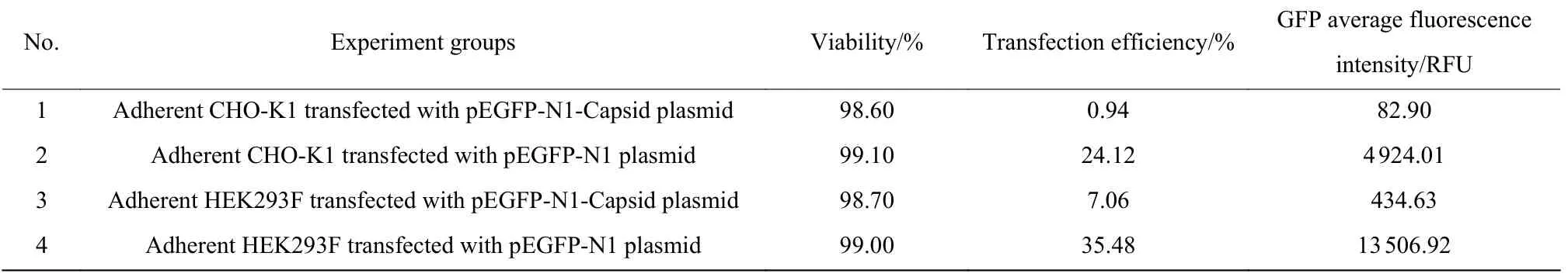
表3 pEGFP-N1 和pEGFP-N1-Capsid 质粒在HEK293 细胞和CHO-K1 细胞中转染效率Table 3 Transfection efficiency of pEGFP-N1 and pEGFP-N1-Capsid plasmids transfected into HEK293 cells and CHO-K1 cells
2.3 不同PEI 转染试剂在细胞转染效率上的差异
为了提高转染效率,实验采用HEK293F 细胞作为瞬时转染宿主细胞,w(PEⅠ)∶w(DNA)为1∶4,在分批培养和流加-分批培养两种模式下分别考察了不同PEⅠ转染试剂(PEⅠ-25 kDa 和PEⅠ-40 kDa)对转染效率的影响。结果显示(图2(a)),采取流加培养模式,采用PEⅠ-40 kDa 转染试剂,获得实验最高转染效率35%。另外,PEⅠ-40kDa 实验组的最大活细胞密度可达到6.2×106cells/mL,细胞活率为86%。而PEⅠ-25 kDa 实验组的最大活细胞密度为3.9×106cells/mL,细胞活率为78%(图2(b),2(c))。因此,在两种不同的培养模式下, PEⅠ-40kDa 转染试剂在HEK293F 细胞上表现出更好的转染性能,可能是PEⅠ-40kDa 的低细胞毒性,获得更高的细胞密度和转染效率。
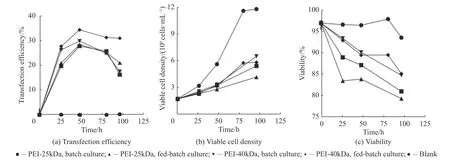
图2 PEⅠ-25kDa 和PEⅠ-40kDa 转染试剂的细胞转染效率比较Fig.2 Transfection efficiency of PEⅠ-25kDa and PEⅠ-40kDa transfected into HEK293F
实验也考察不同孵育时间对PEⅠ/DNA 复合物形成表观电荷定性研究。以300 ng 质粒pEGFP-NⅠ-Capsid DNA 量,转染试剂为 PEⅠ-40kDa,按PEⅠ/DNA不同质量分数比(0, 1∶4、1∶2、 1∶1、2∶1、4∶1、8∶1)配制,各样品体积都为40 μL 的混合液。混合液在室温下分别静置孵育3 min 和30 min 后,在1.0%琼脂糖凝胶进行电泳阻滞实验。结果显示, 静置孵育时间3 min的PEⅠ/DNA 混合样品都向正极方向迁移(图3(a)),表观电荷表现为带负电。而静置孵育时间30 min 的PEⅠ/DNA 混合样品,不同PEⅠ/DNA复合物样品没有出现向正极方向迁移的条带,表观电荷表现为正电(图3(b))。另外,细胞转染效率实验显示,对孵育时间3 min 的混合物进行细胞转染,转染效率非常低(数据未显示)。这种差异有可能是带负电质粒DNA不能被PEⅠ有效包裹,存在游离或吸附在PEⅠ外表面形式,影响DNA 进入细胞体内。

图3 电泳阻滞实验(EMSA)分析PEⅠ/DNA 不同质量分数比下相互结合能力Fig.3 Electrophoretic mobility shift assay (EMSA) for the binding ability of different PEⅠ/DNA mass fractions
2.4 透射电子显微镜观测PEI/DNA 复合物
首先实验考察对PEⅠ/DNA 不同质量分数比转染HEK293F 细胞转染效率的差异。实验结果显示,在质粒质量浓度为1 mg/mL 条件下,细胞转染效率随着PEⅠ与DNA 质量分数比提高而增强。 在w(PEⅠ)∶w(DNA)为8∶1 时,细胞转染效率达到最高,为18.4%(图4)。为了探究不同w(PEⅠ)∶w(DNA)对细胞转染效率影响的原因,采用透射电子显微镜来观测不同比例的PEⅠ/DNA 复合物在外观形状和尺寸大小的差异。结果显示(图5),在w(PEⅠ)∶w(DNA)为1∶1 时,复合物呈现为大于300 nm、松散且无规则形态。而在w(PEⅠ)∶w(DNA)为6∶1 时,复合物呈现为15~80 nm 大小颗粒形态。因此,PEⅠ/DNA 复合物比例影响形成复合物的大小与形态。由于细胞的胞吞作用是细胞摄入外源物质的重要方式,15~80 nm 大小的PEⅠ/DNA 复合物会有利于细胞的摄入,提高转染效率。
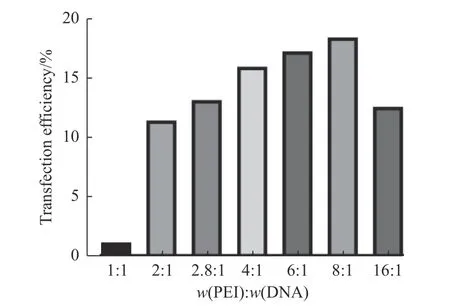
图4 PEⅠ/DNA 不同质量分数比转染HEK293 细胞的转染效率Fig.4 Transfection efficiency of different mass fractions of PEⅠ/DNA transfected into HEK293 cells

图5 负染色透射电子显微镜观测 PEⅠ/DNA 复合物的大小和形态Fig.5 Size and morphology of the PEⅠ/DNA complexes determined by negative staining transmission electron microscopy
2.5 PCFP 蛋白在3 L 反应器瞬时表达及其分子自组装
在3 L 反应器中考察新型PCV2 衣壳融合蛋白PCFP 在HEK293F 细胞中瞬时表达情况。在HEK293F活细胞密度为2.0×106cells/mL,pcDNA3.1(+)-PCV2 Capsid(△1-41aa) –Fc(pig)质粒质量浓度为2 mg/L,PEⅠ-40kDa 与质粒以质量分数6∶1 比例混合,孵育30 min 瞬时转染。结果显示,细胞具有较好的生长状态,最大活细胞密度达到5.0×106cells/mL(图6(a))。葡萄糖质量浓度维持在2~5 g/L,细胞代谢副产物乳酸低于2.7 g/L 水平(图6(b))。对培养6 d细胞上清以及超声处理的细胞沉淀进行亲和纯化(图6(c))。Western blot 分析显示,获得了一清晰目标条带(图6(d)),表达量约为3.8 mg/L。实验成功实现了在3 L 反应器上瞬时转染HEK293F 细胞表达新型PCV2 衣壳融合蛋白PCFP。对纯化的PCFP蛋白进行负染色透射电镜观测,结果显示,PCFP 在透射电镜观测下呈现大小约为41 nm 蛋白纳米颗粒,形态类似于PCV2 灭活病毒(图7)。PCFP 自组装纳米病毒样颗粒特性,将为获得更好免疫原性的疫苗研制提供结构基础。

图6 3 L 生物反应器中的PCFP 表达与纯化Fig.6 Expression and purification of PCFP in a 3 L bioreactor
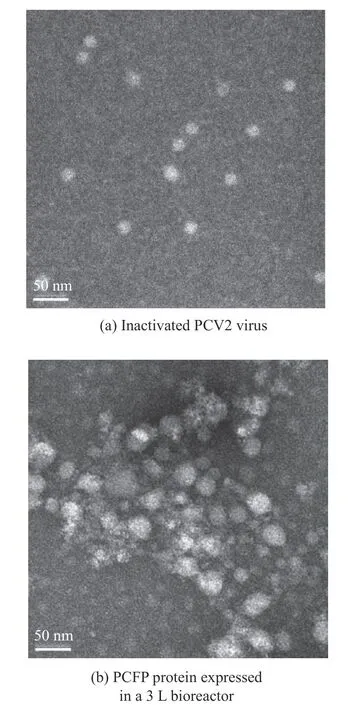
图7 负染色透射电子显微镜观测 PCFP 蛋白大小与形态Fig.7 Size and morphology of the PCFP protein determined by negative staining and transmission electron microscopy
PCV2 新型融合蛋白PCFP,能够在3 L 反应器中获得表达。主要原因如下:(1)对PCV2 衣壳蛋白富含碱性氨基酸的去除,降低了蛋白等电点,从11.02 改变为9.84。(2)通过在C 末端融合猪ⅠgG Fc 片段,进一步将等电点降低到8.78。(3)HEK293F细胞更适合表达病毒蛋白,最终在3 L 反应器中获得3.8 mg/L 瞬时表达水平。此外,实验通过负染色透射电镜对PCFP 蛋白样品观测发现,PCFP 蛋白能够自发形成形态类似于PCV2 病毒,大小约为41 nm颗粒。已有研究报道,当PCV2 Capsid 去除N 端核定位序列会影响病毒结构稳定性[26]。而本研究设计的PCFP 蛋白能自主装形成约为41 nm 颗粒,推测可能是由于PCFP 蛋白Ⅰg Fc 形成链间二硫键,形成类病毒纳米颗粒的主要原因。另外,研究表明,抗原提呈细胞(Antigen-Presenting Cells,APC)处理抗原时,抗原构象的稳定性会影响免疫原性和免疫极化。而在APC 细胞专职表达的Fc-γ 受体 (FcγR) 可以被高度特异性捕获和呈递,从而增强细胞免疫反应[27]。因此,可以推测PCFP 蛋白中的Fc 片段靶向APC 能增强机体免疫反应,获得更好的免疫效果。
2.6 PCFP 蛋白免疫原性考察
对PCFP 蛋白及商业PCV2 疫苗 (CSV)免疫小鼠的血清进行 ELⅠSA 测定,以评估PCV2 Capsid 特异性抗体的产生情况。实验采用没有ⅠgG Fc 标签的重组PCV2 Capsid 蛋白作为包被抗原,消除来自Fc 片段的干扰。结果显示(图8),PCFP 和 CSV 免疫的小鼠都产生抗 PCV2 Capsid 特异性抗体。在第1 次免疫 (days post injection,dpi) 及在第12 dpi 加强免疫后,抗 PCV2 Capsid 特异性抗体迅速增加,在 30 dpi后获得较高的抗体浓度。同时也发现PCFP 蛋白免疫小鼠组比CSV 免疫的小鼠组产生更高浓度抗PCV2 Capsid 特异性抗体(p<0.05)。显然,PCFP 蛋白能够有效诱导机体免疫系统产生抗PCV2 衣壳蛋白的特异性抗体。
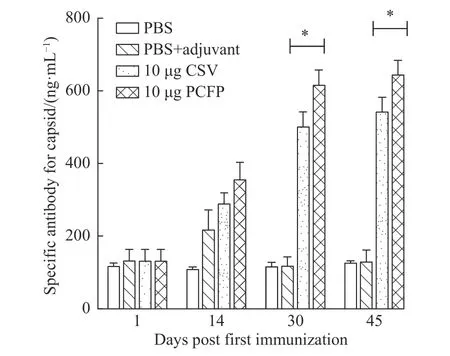
图8 抗PCV2 衣壳蛋白特异性抗体水平Fig.8 Specific antibodies levels of anti-PCV2 capsid
3 结 论
对PCV2 衣壳蛋白瞬时转染条件进行考察,采用HEK293F 转染宿主细胞,PEⅠ-40kDa 转染试剂,w(PEⅠ)∶w(DNA)为1∶4,孵育30 min 进行转染并进行流加培养,细胞转染效率可达到35%。采用电泳阻滞实验及负染色透射电子显微镜方法分析发现,复合物的表观电荷及大小是影响转染效率的重要原因。同时,我们成功在3 L 反应器中以HEK293F为宿主细胞进行新型PCV2 衣壳融合蛋白PCFP 瞬时表达,获得3.8 mg/L 表达水平,并发现PCFP 蛋白具有自组装大小41 nm 类病毒纳米颗粒特性,同时能有效诱导机体免疫系统产生抗PCV2 衣壳蛋白的特异性抗体。并且PCFP 产生抗PCV2 衣壳蛋白抗体的浓度高于商业亚单位疫苗(CSV)。
与商业化杆状病毒/昆虫系统生产PCV2 衣壳蛋白相比, 本文所采用HEK293F 细胞瞬时转染的表达量仍存在差距,但采用建立和筛选稳转高产细胞株,以及在培养基和工艺方面进一步优化仍具有很大的经济实用性潜力。

