姜黄素介导的骨髓间充质干细胞外泌体对 ACC-M细胞增殖、迁移和侵袭的影响
程 昊,吴发印,刘智丹
(遵义医科大学第五附属(珠海)医院口腔颌面外科,珠海 519100)
腺样囊性癌(adenoid cystic carcinoma,ACC)约 占头颈部恶性肿瘤的1%,是最常见的唾液腺恶性肿瘤,多发生于唾液腺组织,其特点是侵袭性强,经常发生血行转移,淋巴结转移较为罕见[1]。ACC 的预后较差,治疗方式的进步对ACC 的治疗结果没有明显影响,患者长期生存期低与复发转移密切相关[1-2]。ACC 的治疗通常为根治性手术切除和术后放疗,同时针对ACC 患者的靶向分子治疗也被广泛研究,但该病缓慢的病程限制了其临床疗效[3]。目前,迫切需要研究新的治疗方法来提高ACC 患者的治疗效果。外泌体是由45 个多泡体内部囊泡与质膜融合而成的纳米囊泡,大量的研究[4]已经证实,外泌体在ACC 的发生、发展中具有重要的作用。最近研究[5]发现,中药介导的骨髓间充质干细胞(BMSCs)外泌体在治疗癌症上具有很大的治疗潜力。然而中药介导的BMSCs 外泌体在治疗ACC 上的作用还不清楚,其中姜黄素是被证实的具有抗肿瘤功效的中药[6],本研究将通过体外实验探究姜黄素介导的BMSCs 外泌体对调控ACC-M 细胞增殖的影响。
1 材料和方法
1.1 细胞
ACC-M 细胞(货号:bio-105915)和人BMSCs(货 号:bio-090476)购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。
1.2 药物与主要试剂
姜黄素(纯度:95%;上海源叶生物科技有限公司,中国);DMEM 培养液(上海瑞永生物科技有限公司,中国);肿瘤易感基因101(TSG-101)、CD63、CD9、重组人钙连蛋白(calnexin)、上皮钙黏素(E-cadherin)、神经钙黏素(N-cadherin)、波形蛋白(vimentin)、转化生长因子β1(TGF-β1)、细胞外信号调节激酶(ERK)抗体、磷酸化-细胞外信号调节激酶(p-ERK)(Abcam 公司,英国);二抗(上海西宝生物科技股份有限公司,中国);细胞计数试剂盒-8(CCK8)(爱必信生物科技有限公司,中国);transwell 小室(北京杰辉博高生物技术有限公司,中国);多聚甲醛(南京化学试剂股份有限公司,中国);TRIzol 试剂(成都化夏化学试剂有限公司,中国);引物的设计和合成均由上海碧云天有限公司提供。
1.3 仪器
SpectraMax i3x 多功能酶标仪(上海美谷分子仪器有限公司,中国);StepOneTM实时荧光定量PCR仪(应用生物系统公司,美国);Ts2R/Ts2 倒置显微镜(上海千欣仪器有限公司,中国)。
1.4 方法
1.4.1 药物处理与分组 参考文献[7]的方法,使用7.5 μmmol/L 的姜黄素与BMSCs 细胞共培养72 h 后,收集培养液,离心后收集上清液,并按文献方法分离外泌体并进行鉴定。ACC-M 细胞培养在DMEM培养液中,并将ACC-M 随机分为4 组:control 组、BMSC-Exo 组、Cur-BMSC-Exo 组和Cur 组。Control 组 为正常培养的ACC-M 细胞;BMSC-Exo 组为使用未经姜黄素处理的BMSCs 外泌体160 μg/mL(本研究在预实验姜黄素处理的BMSCs 外泌体浓度筛选中,发现浓度为160 μg/mL 时,ACC-M 细胞存活率接近50%,因此后续选择此浓度进行实验)与ACC-M细胞共培养;Cur-BMSC-Exo 组使用姜黄素处理的BMSCs 外泌体160 μg/mL 与ACC-M 细胞共培养;Cur 组为用7.5 μmmol/L 的姜黄素处理ACC-M 细胞,所有分组培养48 h 后进行后续实验。
1.4.2 外泌体的分离与鉴定[5]使用DMEM 培养液培养人BMSCs,待BMSCs 汇合度至80%后,使用磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗细胞,然后将BMSCs 细胞培养在不含血清的DMEM 的培养液中。培养2 d 后,离心机分离并收集细胞培养液,在过滤后进行超速离心,收集沉淀后使用PBS 进行溶解,然后使用蛋白质印迹法(Western blotting)检测外泌体标志性蛋白。
1.4.3 Western blotting[8]使用RIPA 裂解液提取各组ACC-M 细胞总蛋白,并使用二喹啉甲酸(bicinchoninic acid,BCA)试剂盒检测蛋白质浓度,然后经垂直电泳分离蛋白后,进行转膜。使用脱脂牛奶进行封闭。然后加入一抗TSG-101(1∶1 000)、CD63(1∶1 000)、CD9(1∶1 000)、calnexin(1∶1 000)、E-cadherin(1∶10 000)、N-cadherin(1∶5 000)、vimentin(1∶1 000)、TGF-β1(1∶1 000)、p-ERK(1∶1 000),4 ℃下孵育过夜,然后使用0.1%PBS 进行冲洗后,加入二抗(1∶2 000),然后加入增强化学发光(enhanced chemiluminescence,ECL)显色液进行显影,然后进行拍照和灰度值分析。
1.4.4 CCK-8 实验[9]收集细胞,将ACC-M 细胞接种于96 孔板中,接种密度为4×103个/孔,进行分组处理后培养48 h,之后每孔加入10 μL 的CCK-8试剂,继续在37 ℃培养箱中孵育2 h 后使用酶标仪检测吸光度值,并计算细胞存活率,计算公式:细胞存活率=(处理组吸光度值-空白组吸光度值)/(对照组吸光度值-空白组吸光度值)×100%。
1.4.5 Transwell 实验[10-11]收集各组细胞,调整密度为1×105个/mL,并在小室的上室加入无血清培养液,且每孔加入200 μL 的细胞,然后在小室的下室每孔加入600 μL 含有10%胎牛血清的培养液,并在37 ℃培养箱中继续培养48h,使用多聚甲醛进行固定,20 min 后使用0.1%的结晶紫进行染色,20 min 后显微镜下观察细胞迁移数目。侵袭实验:将Matrigel 加入到transwell 小室的上室中,在上室中加入100 μL 无血清的培养液,室温下静置0.5 h后弃培养液,在上室加入200 μL 的细胞,在下室加入600 μL 的培养液(含10%血清),培养48 h 后,使用4%的多聚甲醛对滤膜进行固定20 min 后使用苏木精对其染色10 min。之后擦去表面上非侵袭性的细胞,最后通过显微镜观察并计数。
1.4.6 实时定量聚合酶链反应(RT-qPCR)[12]使 用TRIzol 试剂提取ACC-M 细胞总RNA,并检测提取的RNA 的浓度,将RNA 反转录为cDNA,然后配制荧光定量RCR 反应体系,并以GAPDH 为内参,进行PCR 反应。最后根据2-ΔΔCt法分析TGF-β1和ERK mRNA 相对表达量。TGF-β1 引物序列:F,5'-GGATACCAACTATTGCTTCAGCTCC-3';R,5'-AGGCTCCAAATATAGGGGCAGGGTC-3'。ERK引物序列:F,5'-CAGAGATTGAGACTGCGTGGC-3';R,5'-AAGGAACCGGATCCCACATC-3'。GAPDH引物序 列:F,5'-AGAAGGCTGGGGCTCATTTG-3';R,5'-AGGGGCCATCCACAGTCTTC-3'。
1.5 统计学方法
使用SPSS 26.0 软件对所有数据进行分析,正态分布的数据均以均数±标准差(±s)表示,每组重复5 次,2 组之间比较使用t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 外泌体的鉴定
Western blotting 实验检测外泌体中外泌体标志物TSG-101、CD63、CD9 和calnexin 的蛋白表达,结果如图1 所示。与cell 组比较,外泌体组(BMSC-Exo组和Cur-BMSC-Exo 组)中TSG-101、CD63、CD9 蛋白高表达,而calnexin 蛋白呈低表达,表明成功获得外泌体。
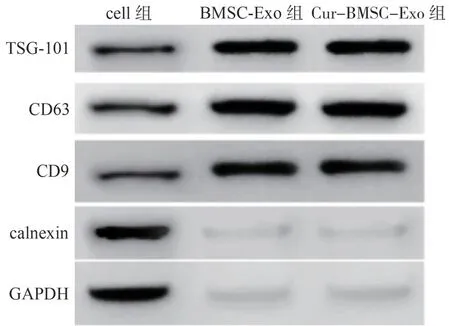
图1 Western blotting 检测外泌体标志物的表达Figure 1 Expression of exosome markers detected by Western blotting
2.2 Cur-BMSC-Exo 对ACC-M 细胞存活率的影响
CCK-8 检测培养48 h 后ACC-M 细胞存活率,control 组、BMSC-Exo 组、Cur-BMSC-Exo 组、Cur 组 的细胞存活率分别为(100.00±2.53)%、(96.78± 3.75)%、(67.21±5.15)%和(80.22±4.65)%。与 control 组比较,BMSC-Exo 组ACC-M 细胞存活率无明显变化(P>0.05);与BMSC-Exo 组比较,Cur-BMSC-Exo 组和Cur 组ACC-M 细胞存活率均显著降低(P<0.05),且Cur-BMSC-Exo 组细胞活力下降水平显著高于Cur 组(P<0.05)。详见图2。
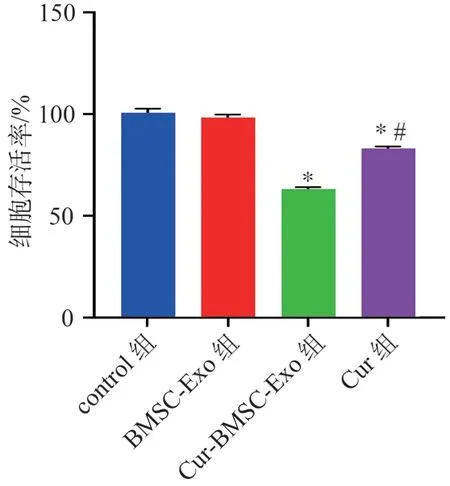
图2 CCK-8 检测培养48 h 后ACC-M 细胞存活率Figure 2 Survival rate of ACC-M cells after 48 h of culture detected by CCK-8 assay
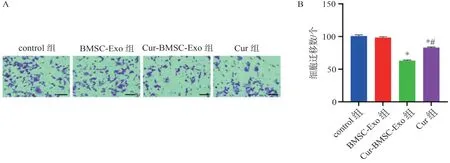
图3 Transwell 实验检测各组细胞迁移情况Figure 3 Cell migration in each group detected by transwell experiment

图4 Transwell 实验检测各组细胞侵袭情况Figure 4 Cell invasion in each group detected by transwell experiment
2.3 Cur-BMSC-Exo 对ACC-M 细胞迁移的影响
Transwell 实验检测各组细胞迁移情况,结果如图3 所示。control 组、BMSC-Exo 组、Cur-BMSC-Exo组、Cur 组的迁移细胞数分别为(100.40±2.61)、(97.89±2.12)、(62.63±1.60)、(82.95±1.21)个。与control 组比较,BMSC-Exo 组细胞迁移无明显变 化(P>0.05);与BMSC-Exo 组比较,Cur-BMSCExo 组和Cur 组ACC-M 细胞迁移数目均明显降低(P<0.05);与Cur-BMSC-Exo 组比较,Cur 组细胞迁移数量增加(P<0.05)。
2.4 Cur-BMSC-Exo 对ACC-M 细胞侵袭的影响
Transwell 实验检测各组细胞侵袭情况,结果如 图4 所 示。Control 组、BMSC-Exo 组、Cur-BMSCExo 组、Cur 组的细胞侵袭数分别为(120.40±8.87)、(117.80±9.02)、(62.00±8.88)、(90.00±7.88)个。与control 组比较,BMSC-Exo 组侵袭数量差异无统计学意义(P>0.05);与BMSC-Exo 组比较,Cur-BMSC-Exo 组和Cur 的细胞侵袭数量均明显降低(P<0.05);与Cur-BMSC-Exo 组比较,Cur 组细胞侵袭数量显著增加(P<0.05)。
2.5 Cur-BMSC-Exo 对ACC-M 细胞迁移和侵袭相关蛋白表达的影响
由图5和表1可见,与control组比较,BMSC-Exo组E-cadherin、N-cadherin 和vimentin 蛋白表达差异无统计学意义(P>0.05);与BMSC-Exo 组比较,Cur-BMSC-Exo 组和Cur 组的E-cadherin 蛋白表达水平均显著增加,而N-cadherin 和vimentin 蛋白表达水平均显著降低(P<0.05),且Cur-BMSC-Exo 组和Cur 组之间的差异具有统计学意义(P<0.05)。
表1 各组细胞迁移和侵袭相关蛋白表达情况(±s,n=5)Table 1 Expression of migration and invasion-related proteins in each group (±s,n=5)
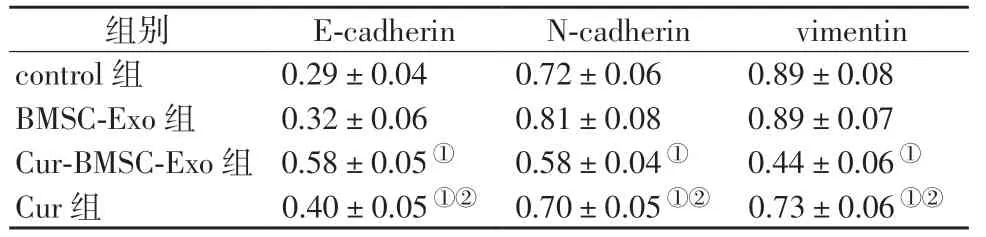
表1 各组细胞迁移和侵袭相关蛋白表达情况(±s,n=5)Table 1 Expression of migration and invasion-related proteins in each group (±s,n=5)
①表示P<0.05,与BMSC-Exo 组比较;②表示P<0.05,与Cur-BMSCExo 组比较。
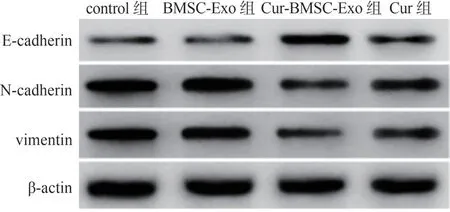
图5 各组细胞迁移和侵袭相关蛋白表达情况Figure 5 Expression of migration and invasion-related proteins in each group
2.6 Cur-BMSC-Exo 对ACC-M 细 胞TGF-β1/ERK通路的影响
由图6 和表2 可见,与control 组比较,BMSC-Exo 组TGF-β1 和ERK mRNA 相对表达量和蛋白表达水平均无明显差异(P>0.05);与BMSC-Exo 组比 较,Cur-BMSC-Exo 组 和Cur 组 的TGF-β1、ERK mRNA,TGF-β1、p-ERK 蛋白表达水平均显著降低(P<0.05),且Cur 组mRNA 水平和蛋白水平显著高于Cur-BMSC-Exo 组(P<0.05)。
表2 各组细胞TGF-β1/ERK 通路相关基因表达情况(±s,n=5)Table 2 Expression of TGF-β1/ERK pathway-related proteins in each group (±s,n=5)

表2 各组细胞TGF-β1/ERK 通路相关基因表达情况(±s,n=5)Table 2 Expression of TGF-β1/ERK pathway-related proteins in each group (±s,n=5)
①表示P<0.05,与BMSC-Exo 组比较;②表示P<0.05,与Cur-BMSC-Exo 组比较。
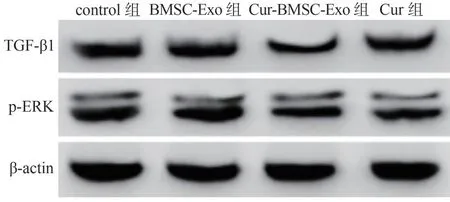
图6 各组细胞TGF-β1/ERK 通路相关蛋白表达情况Figure 6 Expression of TGF-β1/ERK pathway-related proteins in each group
3 讨论
外泌体被定义为是在细胞通信和疾病中发挥重要作用的细胞外囊泡,几乎所有种类的哺乳动物细胞都分泌脂质双层囊泡,由包括癌细胞在内的多种真核细胞释放的外泌体,对肿瘤的侵袭和转移具有调控作用[13-15]。因此,外泌体在癌症进展中具有关键作用,它们不仅可以作为癌症诊断和预后的生物标志物,而且还可以作为药物传递载体和可重构的治疗系统。姜黄素是从姜黄根茎中提取的多酚类药物,具有抗炎、抗肿瘤等功效,然而由于姜黄素具有水溶性差、渗透性较差等缺点,姜黄素的药用价值大打折扣[16]。近年来关于外泌体作为载药系统提高中药疗效的研究已备受关注[17]。外泌体作为药物载体可在多种疾病中发挥重要作用。有研究[18]表明,外泌体因其天然良好的稳定性,以及能较好地穿越脑血屏障的特点,在脑部疾病中可作为良好的载 体。此外,外泌体作为载体在中药治疗肿瘤中也具有不可忽视的作用,如张婷等[19]在研究中发现,姜黄素预处理的外泌体可通过诱导细胞凋亡减缓肝癌的进程。然而关于姜黄素预处理的外泌体是否对ACC-M 细胞也具有显著的作用,此前学界还不清楚。
不少学者[20]已经证实间充质干细胞可通过分泌因子发挥对疾病的治疗作用。本研究通过体外培养将姜黄素与人BMSCs 共培养,然后将载有姜黄素的BMSCs 外泌体与ACC-M 细胞共培养,结果发现,载有姜黄素的BMSCs 外泌体与ACC-M 细胞培养后,ACC-M 细胞的存活率、迁移及细胞数均明显减少,提示载有姜黄素的BMSCs 外泌体可以发挥显著的抑癌作用;同时还发现载有姜黄素的BMSCs 外泌体处理组对ACC-M 细胞活力、迁移和侵袭能力的抑制作用显著高于单独使用姜黄素处理组,提示以BMSCs 外泌体为载药载体可增强姜黄素对腺样囊性癌的疗效。
本研究发现,携带姜黄素的BMSCs 外泌体可显著降低TGF-β1 和p-ERK 蛋白表达水平,表明携带姜黄素的BMSCs 外泌体可能通过调节TGF-β1/ERK 信号通路发挥抑癌作用。有研究[21]已经证实,TGF-β1/ERK 信号通路的激活会加速肿瘤的进展,且诱导多种促癌蛋白的发生;相反,TGF-β1/ERK 信号通路的抑制可明显抑制肿瘤的转移速度[22]。我们的研究结果与先前学者的报道[21]相似。
综上所述,我们发现人BMSCs 分泌的外泌体可作为姜黄素的载体抑制ACC-M 细胞的增殖和转移,并调控TGF-β1/ERK 信号通路。本研究为今后间充质干细胞源性外泌体治疗ACC 提供参考。然而本研究仍然存在不足之处,外泌体作为载药系统对姜黄素药用价值的提高效率仍需进一步确定。

