漆酶-原儿茶醛交联鱼皮胶原蛋白水凝胶的研究
杨长凯,李国英*
(1.四川大学皮革化学与工程教育部重点实验室,四川 成都 610065;2.四川大学制革清洁技术国家工程实验室,四川 成都 610065)
引言
水凝胶具有类似细胞外基质(ECM)的亲水三维网络结构,为伤口提供透气和湿润的环境,优化伤口床的炎症微环境,成为了当前的研究热点[1-2]。胶原蛋白(COL)是一种具有良好生物相容性和生物降解性的可再生生物质资源[2-3],其来源丰富易得,可以从牛[4],猪[5]和鱼[6]的皮肤组织结构中提取。与哺乳动物COL 相比,鱼皮COL 作为一种可再生的COL 资源,并未受到克雅氏病和牛海绵状脑病流行的限制,从而受到科研人员的重视[7]。然而,鱼皮COL 在使用过程中仍然受到了一定的局限,如热稳定性低,变性温度远低于37 ℃,力学性能相对较差,更加容易降解[8]。酶法交联因具有反应条件温和、不产生副产物、高特异性以及无毒性的特点在制备COL 水凝胶中备受青睐。
漆酶(LAC,EC 1.10.3.2)是一种多铜的氧化酶,各种酚类、非酚类芳香族化合物和酪氨酸残基可以作为底物被催化,形成自由基,进而导致其他非酶促次级反应如羟化、歧化和聚合等反应[9-10]。众所周知,胶原的氨基酸序列中存在酪氨酸(Tyr)残基,一种含有酚羟基的芳香族极性α-氨基酸,这为LAC催化交联COL 奠定了基础[11]。然而,胶原分子的三螺旋结构造成的空间阻碍作用会在一定程度影响LAC 的可及性,从而弱化了LAC 对胶原分子的交联作用。研究表明,LAC 的交联效应可以通过添加一种小分子酚类物质来增强[12]。原儿茶醛(PAL;3,4-二羟基苯甲醛)是一种从草药丹参的根部获得且含有儿茶酚结构的小分子酚类物质,具有良好的生物相容性,已被作为一种潜在的天然生物交联剂用于胶原基生物材料。例如,以高碘酸钠作为氧化剂,通过PAL 与胶原分子之间的氨基交联得到了稳定的胶原水凝胶[13]。另一项研究中,PAL 首先可以通过醛基和氨基的反应与脱细胞的猪心包进行结合,随后利用PAL 分子的酚羟基与过硫酸铵之间的氧化还原反应产生交联,以进一步提高生物假体心脏瓣膜的性能[14]。因此,PAL 具备作为增强LAC 交联效应的小分子酚类物质来构建胶原生物医用水凝胶的潜力。
本文通过漆酶、原儿茶醛和胶原之间的交联作用获得胶原基水凝胶,表征了其微观结构、物理性质和力学性能,探讨了PAL 参与下LAC 交联胶原的作用机理和对水凝胶性能的影响。
1 实验部分
1.1 主要材料与试剂
白鲢鱼皮COL,按照Zhang 等人[15]的方法提取;PAL(纯度≥98%),上海绿叶有限公司;醋酸,分析纯,成都科隆化学品有限公司;LAC(来自Trametesversicolor),上海源叶生物技术有限公司;I 型胶原酶,上海麦克林生化科技有限公司。
1.2 胶原水凝胶的制备
COL 被溶解在0.1 mol/mL 醋酸溶液中,质量浓度为5 mg/mL。LAC 被溶解在去离子水中并进行离心,过滤获得澄清透明的LAC 溶液,浓度为5 U/mL。将胶原氨基和PAL 按照一定的物质的量比(1∶0,1∶0.5,1∶1,1∶2)进行混合,调节pH 值至5.0,并搅拌24 h 后,加入LAC 溶液,搅拌均匀,利用8 mol/mL NaOH 调节混合溶液的pH 值至(5.0±0.2),最终获得凝胶原液,并倒入12 孔板模具成胶。所有操作均在冰水浴条件下进行,各组凝胶最终组份浓度如表1 所示。对获得的水凝胶依次命名为:COL-LAC、COL-PAL1 -LAC、COL-PAL2 -LAC、COL-PAL3-LAC。

表1 COL-PAL-LAC 水凝胶组分浓度Tab.1 Components and their concentrations of COL-PAL-LAC hydrogels
1.3 测试方法
1.3.1 傅里叶变换红外光谱(FTIR)
采用溴化钾压片法,使用傅里叶变换红外光谱仪(Nicolet IS 10,美国赛默飞)对样品进行扫描,设置范围参数4 000~650 cm-1,分辨率为2 cm-1,平均进行扫描32 次。
1.3.2 X 射线光电子能谱(XPS)
通过XPS(K-Alpha,美国赛默飞)对COL 和冻干后的COL-LAC,COL-PAL1-LAC 凝胶样品进行扫描分析,并利用Avantang 软件对扫描结果进行处理。
1.3.3 扫描电子显微镜(SEM)
使用SEM(Apreo 2C,美国赛默飞)观察各组水凝胶的横截面形貌,用液氮脆断冻干的凝胶,并固定在导电胶表面,喷金,在5 kV 的加速电压下进行测试。
1.3.4 流变学测量
水凝胶的流变测量由流变仪(MCR 302,德国安东帕)评估,包括储存模量(G')和损失模量(G'')。水凝胶的动态频率在20 ℃下从0.01 Hz 到10 Hz 变化,线性区域内的恒定应变为5%。
1.3.5 压缩性能测试
使用万能试验机(UTM 2102,中国三思纵横)以每分钟2 mm 的恒定应变速度和0%~70%应变范围来评估水凝胶的强度。压缩模量由低应变下的应力-应变曲线斜率获得。每个样品进行3 次平行实验,取平均值。
1.3.6 热重分析(TG)
冻干水凝胶的热降解是使用热重分析仪(TG 209F1,德国耐驰)进行。将大约3~5 mg 的冻干水凝胶进行50~800 ℃的加热,加热速度恒定为10 ℃/min,氮气作为保护气体。
1.3.7 体外的酶促降解
I 型胶原蛋白酶溶解在磷酸盐缓冲液(PBS,pH=7.4)中,溶液的最终浓度为1 U/mL。冻干的凝胶样品(M0)在37 ℃下与I 型胶原酶溶液孵化。样品以3 mL/mg 样品的体积进行孵化,每隔一天更换一次酶溶液。然后在第1、2、4 和7 天收集样品。每组样品用PBS 溶液洗三次,用去离子水清洗三次,然后冻干后称量(M1)。耐酶降解率根据公式(1)计算:
2 结果与分析
2.1 FTIR 分析
原分子的三股螺旋结构通常通过计算酰胺III 带和1 450 cm-1处的吸光度比值AIII/A1450来验证其完整性。COL-LAC、COL-PAL1-LAC、COL-PAL2-LAC和COL- PAL3- LAC 凝胶的AIII/A1450比值分别为0.96,0.95,1.00 和0.93,均大于胶原变性产物明胶的0.59[18],说明各组凝胶中胶原结构稳定。这表明LAC-PAL 催化交联作用温和,并未破坏胶原结构。

图1 各组凝胶的FTIR 谱图Fig.1 FTIR spectra of the prepared hydrogels
2.2 XPS 分析
为了研究凝胶机理,对COL、COL-LAC、COL-PAL1-LAC 进行XPS 分析。图2a 为凝胶全谱分析图,在532.08、400.08 和285.08 ev 分别归属于O 1S、N 1S 和C 1S。我们进一步对每组凝胶的C 1S 进行了分封拟合分析。图2b 为COL 的C 1S图谱,在283.98、285.18 和287.08 ev 出现的特征峰,可分别归属于C-H/C-C、C-N/C-O 和COOH[19]。图2c 为COL-LAC 的C 1S 图谱,在284.88、286.28 和288.08 ev 处的典型特征峰可分配给C-C/C-H、C-N/C-O 和COOH。显而易见,COL-LAC 的C 1S 图谱在288.98 ev 出现了新的特征峰,可归属于C=O,这可能是由于胶原分子链中的Tyr 残基被LAC 氧化形成了醌活性基团。 通过进一步分析COL-PAL1-LAC 的C 1S 图谱(图2d) 并与COL-LAC 对比发现,归属于C-N/C-O 的峰形变得尖锐,这可能PAL 的大量引入导致的。综上所述,在LAC 作用下,PAL 的酚羟基被氧化成醌自由基,从而可能与胶原的氨基、Tyr 残基或者PAL 分子之间发生迈克尔加成反应或席夫碱反应。COL-LAC凝胶和COL-PAL-LAC 凝胶的可能机理如图3 所示。

图2 水凝胶XPS 全谱(a),COL,COL-LAC 和COL-PAL1-LAC 的C 1s 光谱(b,c 和d)Fig.2 Full XPS spectrum of hydrogels (a) and the C 1s spectra of COL (b),COL-LAC (c) and COL-PAL1-LAC (d)

图3 COL-LAC 和COL-PAL-LAC 水凝胶可能的凝胶机理示意图Fig.3 Schematic possible gelation mechanisms of COL-LAC and COL-PAL-LAC hydrogels
2.3 水凝胶实物图和SEM 分析
图4(a)、4(b)和4(c)分别为各组水凝胶的直观图、冻干后样品的形态以及SEM 图。如图4a 所示,在LAC 作用下胶原呈现透明凝胶状,且在PAL 引入后,水凝胶颜色发生改变,随着PAL 含量的增加,颜色由棕黄色(COL-PAL1-LAC) 到褐色(COL-PAL2-LAC) 转变,直至深褐色且偏黑色(COL-PAL3-LAC),这说明LAC 催化氧化PAL 分子时产生了醌基团[20]。如图4(b)所示,COL-LAC 凝胶冻干后呈塌陷状态,COL-PAL-LAC 各组凝胶整体结构相对稳定,表明LAC 和PAL 与胶原之间的交联作用有利于保持凝胶的整体骨架。如图4(c)为凝胶的微观结构,COL-LAC 的SEM 图呈现较大的片状结构,且相对松散,而COL-PAL1-LAC 整体相对紧密,COL-PAL2-LAC 凝胶的微观结构则出现了局部致密现象。与此同时,随着PAL 含量的进一步增加,COL-PAL3-LAC 凝胶的微观结构更加紧密,这说明PAL 含量的增加能够加强LAC 作用下PAL 与胶原之间的交联作用,增强LAC 交联胶原的交联效应。

图4 各组水凝胶(a)、冻干后的水凝胶(b)和SEM(c)Fig.4 Photos of the prepared hydrogels (a) , the lyophilized ones (b) and their SEM images (c)
2.4 流变学
分别对各组凝胶的流变性能进行了研究。图5(a)和5(b) 为分别为各组水凝胶的G"和G'。所有水凝胶的G'都高于G",证明了各组材料具有水凝胶典型的粘弹性行为。通过比较在0.1 Hz 频率下的G'可知,与COL-LAC凝胶的49.74 Pa 相比,PAL加入后,各组凝胶的G'出现了明显增加, 其中COL-PAL1-LAC 凝胶的G'最高达到了224.60 Pa,这表明PAL 的参与能够进一步增强LAC 作用下胶原凝胶的力学性能。随着PAL 含量的增加,COL-PAL2-LAC 和COL-PAL3-LAC 的G' 分别为206.58 Pa 和169.40 Pa,凝胶的G'呈现下降趋势,这可能是LAC 作用下PAL 分子之间的相互作用增加形成多聚体导致在一定程度上破坏了胶原基材的整体骨架。

图5 各组水凝胶的储能模量(a)、损耗模量(b)、应力-应变曲线(c)和压缩模量(d)曲线Fig.5 Energy storage modulus (a), loss modulus (b), typical tensile stress-strain curves (c) and compressive modulus (d) of the prepared hydrogels
2.5 压缩性能
与此同时,进一步测量凝胶的压缩模量来反映凝胶的力学性能。如图5(c)所示,根据各组凝胶的应力- 应变曲线计算出 COL-LAC、COL-PAL1-LAC、COL-PAL2-LAC 和COL-PAL3-LAC 水凝胶的压缩模量分别为4.27、7.19、9.40 和6.77 kPa(图5(d))。由此可知,PAL 的加入导致LAC 作用下胶原凝胶后的力学性能增强,其中COL-PAL2-LAC 水凝胶的压缩模量达到了COL-LAC 水凝胶的2.2 倍左右,进一步表明了PAL 的参与有利于LAC 作用下胶原水凝胶力学性能的改善。
2.6 热重分析
采用所有水凝胶的TGA和热重曲线研究各组凝胶的热降解行为,如图6(a)所示,观察到了热降解行为的两个阶段,包括被吸收的水和结构水的损失,以及COL 凝胶的分解。在50~150 ℃温度范围内,主要的减重行为是由于胶原凝胶中的水蒸发和胶原分子之间的氢键断裂。随着温度从200 ℃增加到800 ℃,COL分子开始分解,三螺旋结构逐渐被破坏成多肽,这些多肽被裂解并蒸发为二氧化碳和水,导致第二阶段的质量损失[21]。从图6(a)可以看到,COL-LAC和各组COL-PAL-LAC 水凝胶的残留质量相较于纯COL均得到了提升。此外,与COL-LAC 水凝胶的残留质量相比,COL-PAL1-LAC 和COL-PAL3-PLAC 水凝胶残留质量差别不大,这可能是由于PAL 含量少导致LAC的催化交联作用不足以改善胶原整体的稳定性,而PAL含量过高则会导致LAC 作用下PAL 之间的相互作用形成大量多聚体从而对胶原分子骨架的整体结构造成破坏,引起稳定性的下降,这也可能是COL-PAL3-LAC 凝胶G' 下降的原因。 另外,COL-PAL2-LAC 水凝胶的残余质量从25.36%提高到了28.49%,表明适宜的PAL 含量有利于胶原水凝胶热降解的稳定性。
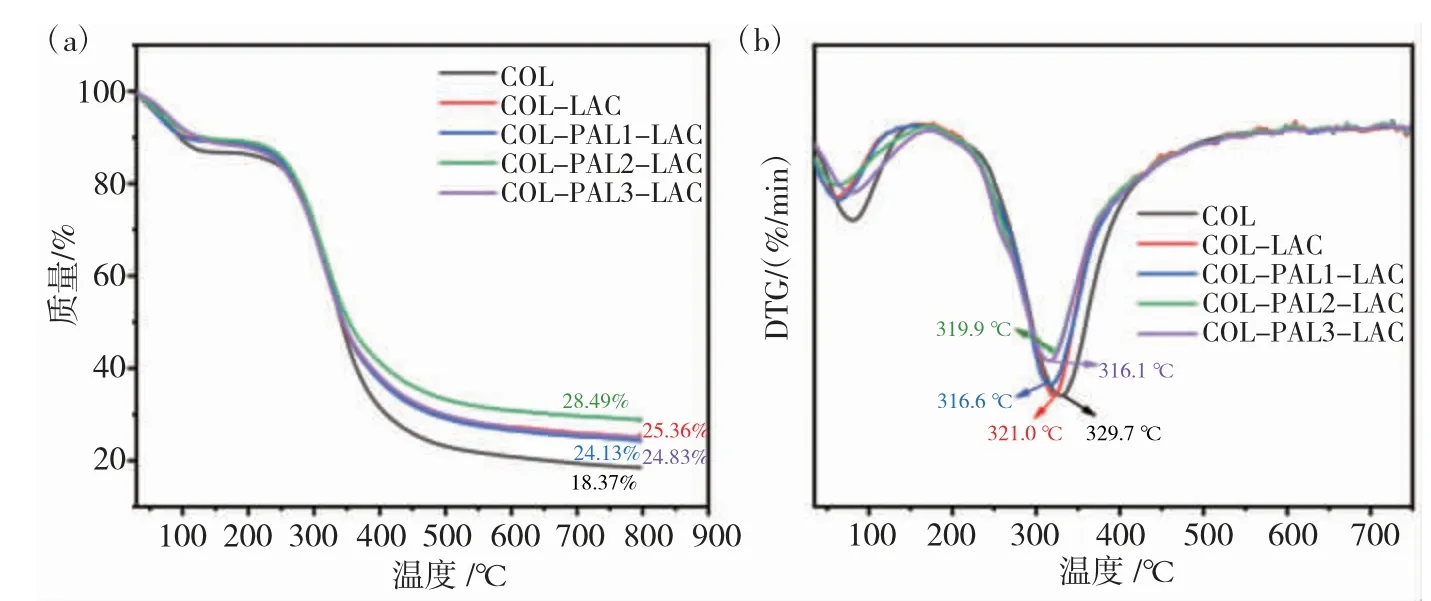
图6 各组水凝胶的TG(a)和DTG(b)曲线Fig.6 TG (a) and DTG (b) curves of the prepared hydrogels
2.7 耐酶降解分析
图7 是水凝胶的耐酶降解性质表征。实验中,COL-LAC 凝胶在24 h 内迅速降解,只留下非常少量的絮状物质,说明单纯的LAC 参与导致的胶原交联作用相对较差,这有可能与LAC 作用底物Tyr 含量较少有关。随着PAL 的引入,COL-PAL1-LAC 和COL-PAL2-LAC 在7 d 后才基本完全降解,而此时COL-LAC3-PAL 水凝胶的降解率在73%左右。由此可以看出,PAL 的参与增强了LAC 交联胶原水凝胶的交联效应,从而增强了胶原水凝胶的耐酶降解性质,且随着PAL 浓度的增加,胶原水凝胶的耐酶降解性质增强。
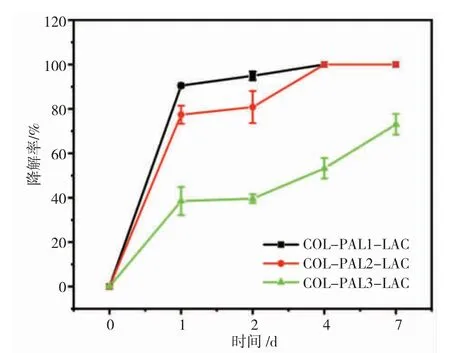
图7 各组水凝胶的酶降解Fig.7 Enzymatic degradation curves of the prepared hydrogels
3 结论
通过漆酶-原儿茶醛催化交联作用获得了一种胶原水凝胶,通过FTIR 和XPS 分析研究漆酶-原儿茶醛交联胶原的作用机理,探索了漆酶作用下不同原儿茶醛含量对胶原水凝胶的微观结构、力学性能、热稳定性和降解性的影响。实验结果表明,原儿茶醛可以增强漆酶的底物特异性,即为漆酶-多酚介体的交联效应。对漆酶-胶原水凝胶体系的力学性能、稳定性和耐酶降解性质有一定的提升作用,是获得胶原水凝胶的一种有效策略。

