绿茶中21 种黄酮醇糖苷类化合物的鉴别及地理溯源
黄永桥,高 亮,吴新文,李占彬,杨昌彪,毛敏霞*
(1 贵州省检测技术研究应用中心 贵阳550014 2 贵州省分析测试研究院 贵阳 550014)
茶在中国有着悠久的饮用历史,茶的各种生物活性、健康益处及独特的口感使其成为世界上广泛消费的饮料[1]。茶叶中富含儿茶素、黄酮醇、茶黄素等酚类化合物,其中黄酮醇糖苷类化合物(Flavonol glycosides,FGs)主要以糖苷的形式存在,在黄酮醇母体苷元的C-3 位有糖分子部分,黄酮醇母体苷元主要有杨梅素苷、槲皮素苷和山奈素苷,糖分子分为单糖(葡萄糖、半乳糖、鼠李唐等)、二糖和三糖[2-3]。迄今为止,已报道的茶叶中黄酮醇苷类化合物有20 多种[4-6]。
黄酮醇糖苷类化合物在生理活性方面有一定的功效,如抗氧化、降血脂、清除自由基、抵御紫外线、抗菌、抗癌、体重调节、维持骨密度和神经保护活性等生理功能[7-9]。有研究发现黄酮醇糖苷类化合物味觉阈值极低,呈苦涩味,对茶汤的苦涩味贡献较大,对茶汤中咖啡因的苦味具有正向增强作用;同时对茶汤的滋味和色泽等感官品质具有重要作用[10-12]。有学者提出黄酮醇糖苷类化合物与儿茶素相比,它们的稳定性相对较高,被认为是1 组有研究价值的生物标志物,用于区分茶叶的产地或品种[13-14]。
液相色谱-紫外检测因成本低且易操作,被广泛用于茶叶和饮料中酚类化合物的识别和定量分析[15-16]。然而,由于液相色谱法灵敏度较差且易受干扰,很难对茶叶中低含量的黄酮醇糖苷类化合物进行有效分离和准确定量。液相色谱-质谱联用仪技术具有选择性好、灵敏度高、分辨率好、重复性好等优点,是茶叶中黄酮醇糖苷类化合物分析常用的检测方法[17-18]。三重四极杆质谱仪(Triple quadrupole mass spectrometry,QQQ-MS/MS)可以产生分子、离子的特征产物离子,有良好的灵敏度和选择性,适用于目标物的定量分析[4,18-19]。四极杆/静电场轨道阱高分辨质谱(Quadrupole-orbitrap high resolution mass spectrometry,Q -Orbitrap HRMS)是一种高分辨率、宽质量范围和高灵敏度的方法,能对化合物进行精确质量数测定,适用于目标物与未知物的识别和筛查[20-21]。
本研究探讨用黄酮醇苷类化合物含量来分析绿茶地理溯源的可行性,通过高分辨质谱仪结合三重四极杆质谱仪,建立UPLC-Q-Orbitrap HRMS 结合UPLC-QQQ-MS/MS 分析茶叶中21 种黄酮醇苷类化合物的鉴别和定量方法。对不同地区绿茶中黄酮醇苷类化合物含量进行测定和比较,分析绿茶中黄酮醇苷类化合物的差异性及相关性。采用主成分分析(Principal component analysis,PCA)、方向传播算法-人工神经网络(Back pagation-artificial neural network,BPANN)、偏最小二乘法判别(Partial least squares discriminant analysis,PLS-DA)、线性判别(Linear discriminant analysis,LSD)等化学计量学分析模型,探究黄酮醇苷类化合物的差异性及相关性对绿茶产地判别及溯源的可行性分析,筛选重要化学标记,以期为茶叶指纹图谱和化学判别提供依据,为茶叶地理溯源研究和化学分类提供数据参考。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈(色谱纯级),德国默克公司;甲酸(色谱纯级),上海安谱实验科技股份有限公司;实验室用水为Milli-Q 纯水机制备。
槲皮素-3-O-葡萄糖-鼠李糖糖苷(Q-glurha)标准品、槲皮素-3-O-半乳糖糖苷(Q-gal)标准品、槲皮素-3-O-葡萄糖糖苷(Q-glu)标准品、山奈素-3-O-葡萄糖-鼠李糖糖苷(K-glu-rha)标准品、山奈素-3-O-葡萄糖糖苷(K-glu)标准品,均≥98%,上海安谱实验科技股份有限公司。
茶叶样品分别购自贵州省6 个地州市茶叶生产企业生产的40 批次绿茶,均选取当地茶叶进行生产的绿茶,其中遵义地区13 批次;铜仁地区4批次;黔南地区6 批次;黔西南地区4 批次;贵阳地区5 批次;黔东南地区8 批次。
1.2 仪器与设备
6470A 三重四级杆质谱仪、1290 超高效液相色谱仪,美国Agilent 公司;Q-Exactive HF-X 四极杆-静电场轨道阱高分辨质谱系统及Dionex UltiMate 3000 快速高效液相色谱系统,美国Thermo-Fisher 公司;GM200 刀式研磨粉碎仪,德国Retsch 公司;超声波清洗器,上海科导超声仪器有限公司;UMV-2 多管涡旋混合器,北京普立泰科仪器有限公司;Milli-Q 纯水机,美国Millipore 公司。
1.3 方法
1.3.1 标准溶液配制 准确称取Q-glu-rha、Qgal、Q-glu、K-glu-rha 和K-glu 标准品,分别用甲醇配制成质量浓度为1.0 mg/mL 的储备液;于-18℃保存。储备液用70%甲醇溶液稀释至质量浓度为0.02,0.05,0.2,0.5,1,2,5,10 μg/mL 制备标 准工作液,临用现配。
1.3.2 UPLC-Q-Orbitrap HRMS 分析条件
1.3.2.1 色谱 ZORBAX Eclipse Plus-C18 色谱柱(150 mm×2.1 mm,1.8 μm);流动相A:0.1%乙酸水溶液,B:乙腈;流速:0.3 mL/min;柱温:35 ℃;进样量:5.0 μL;梯度洗脱:0.0~2.0 min,2% B;2.0~8.0 min,2%~20% B;8.0~28.0 min,20%~65% B;28.0~35.0 min,65%~98% B;35.0~37.0 min,98%B;37.0~37.1 min,98%~2% B;37.1~40.0 min,2%B。
1.3.2.2 质谱 加热电喷雾离子源(HESI),负离子模式;离子源温度:350 ℃;离子传输管温度:325℃;喷雾电压:3.5 kV;鞘气流速:180 mL/min,辅助气:45 mL/min;扫描模式:Full MS-ddMS2;采集范围:m/z 100~900;一级扫描分辨率:70 000;二级子离子扫描分辨率:17 500;归一化碰撞能量(NCEs):40 eV,黄酮醇糖苷类化合物质谱信息见表1。

1.3.3 UPLC-QQQ-MS/MS 分析条件
1.3.3.1 色谱 ZORBAX Eclipse Plus-C18 色谱柱(150 mm×2.1 mm,1.8 μm);流动相A:0.1%乙酸水溶液,B:乙腈;流速:0.3 mL/min;柱温:35 ℃;进样量:2.0 μL;梯度洗脱:0~0.5 min,5% B;0.5~2.0 min,5%~16% B;2.0~3.0 min,16% B;3.0~13.0 min,16%~18.5% B;13.0~13.5 min,18.5%~20.0%B;13.5~14.5 min,20%~60% B;14.5~15.0 min,60%~90% B;15.0~17.0 min,90% B;17.0~17.1 min,90%~5% B;17.1~20.0 min,5% B。
1.3.3.2 质谱 电喷雾离子源(ESI),负离子扫描模式;多反应监测(MRM);毛细管电压:-3.5 kV;雾化器压力:68.95 kPa;干燥气和鞘气流速:10 L/min;干燥气和鞘气温度:300 ℃;子离子均选取脱去糖苷后的骨架苷元离子。
1.3.4 样品前处理 茶叶样品经粉碎后过425 μm 孔径的筛子,称取试样1.00 g 于50 mL 离心管中,准确加入30 mL 70%甲醇溶液,超声15 min,涡旋振荡10 min,5 000 r/min 离心10 min,取上清液过膜上机。
1.3.5 数据处理 试验数据计算采用Excel 2016版;图谱绘制和主成分分析采用Origin 2018 版;化学结构式绘制采用ChemDraw 7.0 版;差异显著性分析、方向传播算法-人工神经网络分析和线性判别采用SPSS 22.0 版;偏最小二乘判别分析使用SIMCA 14.1 版。
2 结果与讨论
2.1 黄酮醇糖苷类化合物的色谱分离
茶叶中富含较多氨基酸、有机酸、茶多酚(如儿茶素、茶黄素类、黄酮类及黄酮醇类)等成分。为了有效地对茶叶中的黄酮醇糖苷类化合物进行分离,试验选用150 mm×1.8 μm 的色谱柱,并对流动相组成进及其洗脱梯度行了对比优化,当使用乙腈-0.1%乙酸水做为流动相,采用梯度洗脱21 种化合物全部洗脱出来,且有较好的分离度,图1 为绿茶样品色谱图。

图1 绿茶中21 种黄酮醇糖苷类化合物的色谱图Fig. 1 Chromatograms of 21 flavonol glycosides in green tea
2.2 黄酮醇糖苷类化合物的识别
根据化合物的结构规律及裂解规律,结构式中减少不同的取代基,其质量数会相应减少。如羟基减少16 u、葡萄糖及半乳糖减少162 u、鼠李糖减少146 u、阿拉伯糖减少132 u 等[5,22-24]。研究表明[2-3,18,25],半乳糖和葡 萄糖为同分异构体,在 液相色谱有效的分离条件下,半乳糖的糖苷色谱峰时间会早于葡萄糖的糖苷,说明在极性上半乳糖>葡萄糖。
研究采用UPLC-Q-Orbitrap HRMS 对黄酮醇糖苷类化合物进行分析,根据其结构规律及裂解规律、与有标准物质的化合物进行比较(色谱图上的保留时间、母离子及其特征碎片离子)分析,并与相关文献进行比对,最终对21 种黄酮醇糖苷类化合物进行识别确认。图2 为Q-glu-rha-glu 二级质谱图。

图2 Q-glu-rha-glu 二级质谱图Fig. 2 MS2 spectra of Q-glu-rha-glu
2.3 UHPLC-QQQ-MS/MS 方法学验证
使用购买的5 种标准物质建立的定量方法进行方法学验证,选取同一茶样,按建立的分析方法分别进行标准曲线、重复性和加标回收试验。结果表明,在质量浓度0.02~10.00 μg/mL 的范围内,相关系数均大于0.99;加入相同加标量的标准品进行6 次平行试验,加标回收率在79.3%~106.5%之间,相对标准偏差在3.6%~7.9%之间,说明建立的定量分析方法有较好的回收率和重复性。
2.4 黄酮醇糖苷类化合物的定量方法
现阶段商品化的黄酮醇糖苷类化合物的标准品较少,文献报道[17-18,24,26-28]多采用相对定量的方法对其进行定量,即用已有标准品的黄酮醇糖苷类化合物对其它黄酮醇糖苷类化合物进行相对定量。本研究以Q-glu-rha 为标准品对其它没有标准品黄酮醇糖苷类化合物进行相对定量。配置有标准物质的5 种黄酮醇糖苷类化合物系列标准工作溶液,对其在茶叶中的含量进行准确定量分析。
2.5 茶叶中黄酮醇糖苷类化合物的含量
表2 显示不同地区绿茶中21 种黄酮醇糖苷类化合物的组成及含量,根据单因素ANOVA 检验分析结果,每批次样品均测定2 次。由表2 可知,不同地区的绿茶中总黄酮醇糖苷类化合物的含量存在差异,黔西南地区绿茶中总黄酮醇糖苷含量最高,黔南地区绿茶总黄酮醇糖苷含量最低。在21 种糖苷中K-glu-rha-glu 含量最高,占总含量的33.1%~57.8%;Q-gal-rha-rha 平均含量最低;3 种糖苷中以山奈素糖苷含量最高,其次为槲皮素糖苷,杨梅素糖苷含量最低;不同茶叶中以三糖苷的平均含量最高,二糖苷次之,平均含量最低的为单糖苷。
差异性分析结果显示,黔西南地区绿茶茶叶中总黄酮醇糖苷、槲皮素糖苷、山奈素糖苷、单糖苷、二糖苷含量显著高于其它地区(P<0.05),贵阳地区绿茶和黔东南地区绿茶中总黄酮醇糖苷、山奈素糖苷、单糖苷、二糖苷、三糖苷无显著差异(P>0.05);黔西南地区绿茶和黔东南地区绿茶中杨梅素糖苷含量显著高于其它地区(P<0.05);贵阳地区绿茶中三糖苷含量显著高于其它地区(P<0.05);遵义地区绿茶和黔南地区绿茶在总黄酮醇糖苷、杨梅素糖苷、槲皮素糖苷、山奈素糖苷、单糖苷、二糖苷、三糖苷含量无显著差异(P>0.05)。
6 个地区的绿茶中21 种糖苷中Q-gal 和Kgal 含量虽有差异但不显著(P>0.05);黔西南地区绿茶中Q-glu、M-glu、K-glu-rha 和K-glu 的含量显著高于其它几个地区绿茶(P<0.05)。贵阳地区绿茶中K-glu-rha-glu 含量显著高于其它几个地区,且为21 种糖苷化合物中含量最高。
2.6 不同地区绿茶的识别分析
2.6.1 主成分分析(PCA)在进行主成分分析之前,先对绿茶样本是否存在异常样本进行判定。Hotelling's T2Range 算法是常用一种常用的判定方法,当样本的值超过T2临界(99%)值时,说明该样本与其它样本间存在较大差异。结果如图3 所示,绿茶样本的值均未超过T2临界(99%)值,说明选取的绿茶样本可用于主成分分析模型的建立。

图3 绿茶样品的Hotelling's T2 Range 图Fig. 3 Hotelling's T2 Range plot of green tea samples
根据表2 计算出的每个茶叶中单个黄酮醇苷类化合物的含量,使用主成分分析PCA 来阐明每个茶叶中黄酮醇苷类化合物组成的贡献,以反映通过程序鉴别的茶叶样品的聚类。图4 显示了分配给不同程序的茶叶的得分图。前两个主成分分别代表6 个地区的茶叶样品的可变性的方差贡献率的42.1%和20.2%,累计方差贡献率为62.3%。

图4 依据21 种黄酮醇苷类化合物的含量对不同产地绿茶进行主成分分析Fig. 4 PCA plots of green tea from different producing area based on the content of 21 flavonol glycosides

从图4a 中可知,6 个地区的绿茶样品对应的分值有明显差异,各地区的茶样有较好的聚集且茶样且无重叠部分,PC1 和PC2 平面中6 个地区绿茶样品得到有效的聚类,样品的区分度较好。从图4b 的加载图中可以观察到变量的方向,PC1 和PC2 中除K-gal 和Q-gal 贡献较小外,其它化合物贡献均大于0.2,但不存在突出贡献变量。综上,不同产地绿茶样品可根据黄酮醇苷类化合物的含量进行PCA 聚类分析。
2.6.2 BP 人工神经网络分析(BP-ANN)使用SPSS 软件进行BP 人工神经网络分析,随机抽取70%的茶叶样本作为训练集,剩余的30%茶叶样本作为测试集,对BP 人工神经网络分析模型的识别能力和预测能力进行了评价。结果表明,该模型的输入层神经元为21 个、隐藏层神经元为13 个和输出层神经元为6 个,隐藏层层数为1。
从表3 可知,在模型训练和测试过程中,代表6 个不同地区的所有茶叶样品识别的准确率均为100.0%,说明BP 人工神经网络分析模型具有较好的适用性。根据模型中的重要性和规范化的重要性得知(图5),规范化的重要性大于80%的化学标记有9 个,分别为K-gal-rha-rha、K-glu-rha、K-gal、K-glu、K-glu-rha-rha、K-gal-rha-glu、Mgal-rha-glu、Q-gal-rha-glu 和Q-gal-rha-rha,其中K-gal-rha-rha 和K-glu-rha 的重要性达到100%。

表3 BP-ANN 的训练和测试结果Table 3 Model training and prediction results of the BP-ANN model
2.6.3 偏最小二乘法判别分析(PLS-DA)为确定分组样品的差异,进一步采用PLS-DA,以21种黄酮醇苷类化合物为自变量(X),6 个地区绿茶作为因变量(Y),建立PLS-DA 分析模型。结果表明,分析模型的拟合指数分别为R2X(cum)=0.992、R2Y(cum)=0.942,预测指标Q2(cum)=0.782,表明该模型能反映总自变量的99.2%,能反映总因变量的94.2%,预测能力为78.2%,说明建立的PLSDA 分析模型结果可靠。
PLS-DA 得分图(图6a)显示了R2X 中特征值贡献度最大的两个,且两个R2X 均没有特征贡献变量,说明21 种黄酮醇苷类化合物的值对该模型的总方差影响均衡。图6b 显示了在PLS-DA 预测模型中自变量对于分析结果的贡献率,变量值与各糖苷对于模型贡献率呈正相关。从图中可知,VIP 值>1 的变量有K-gal-rha-rha、K-glu-rhaglu、K-gal-rha、K-glu-rha-rha、Q-gal-rha-rha、Mgal-rha-glu、Q-glu-rha-rha 和K-glu-rha,该8 个变量可以作为绿茶中地理溯源的PLS-DA 模型最重要的化学标记成分。

图6 不同产地绿茶样品PLS-DA 分析结果图Fig. 6 Comparison of the PLS-DA analysis results of green tea samples from different regions
2.6.4 线性判别分析(LSD)LSD 以21 种黄酮醇苷类化合物为自变量,6 个地区绿茶作为因变量,建立判别模型,分析方法采用Fisher 函数和交叉检验。由表4 可知,此模型对绿茶产地的整体判别准确率为100%,6 各地区茶叶的交叉验证结果准确率为100%,其中铜仁绿茶的准确率为75%。说明使用线性判别对不同产地绿茶的判别效果较好。
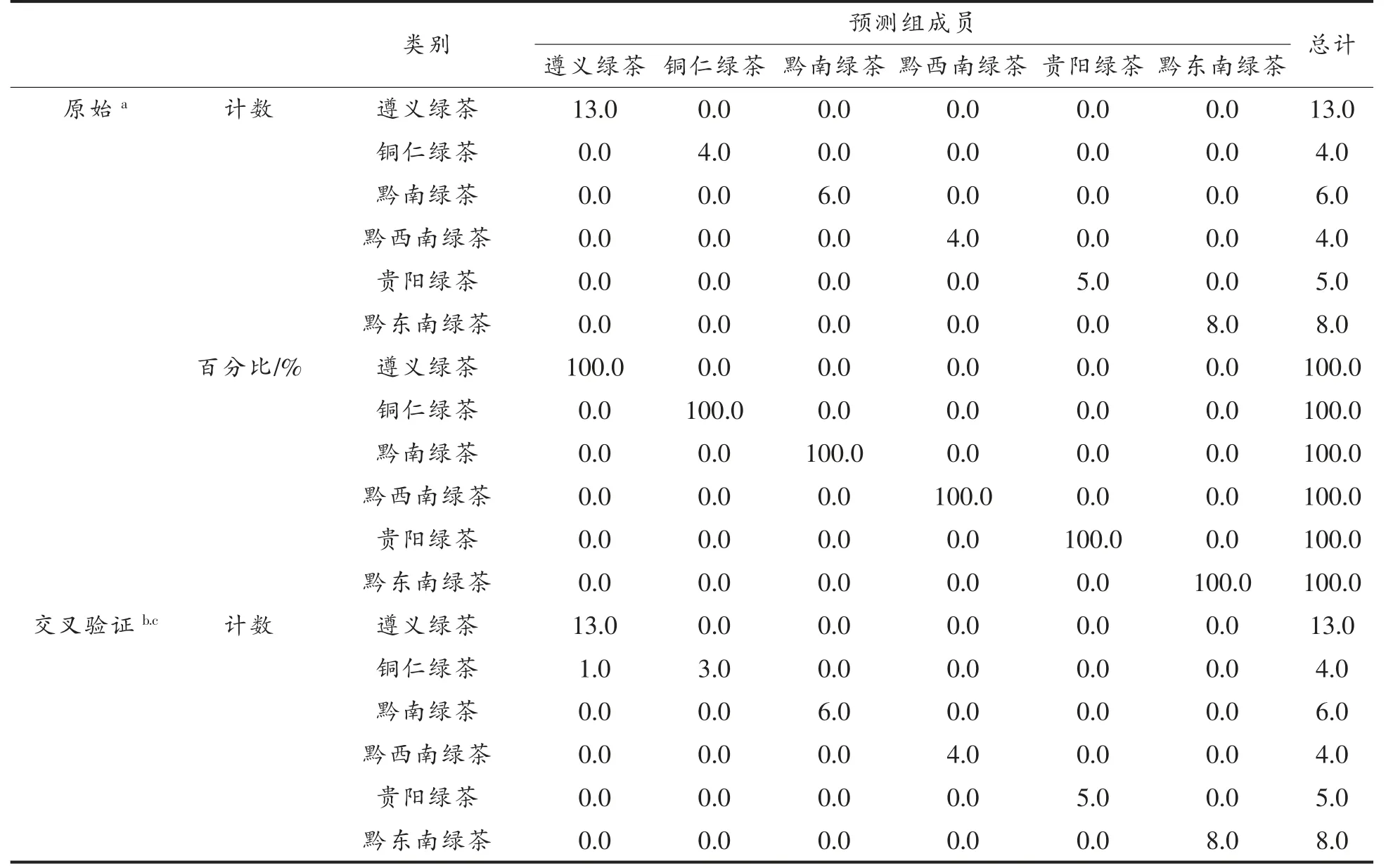
表4 基于黄酮醇苷类化合物含量的茶叶分类判别结果Table 4 The discrimination results of tea based on the content of flavonol glycosides
3 结论
采用高分辨质谱仪结合三重四极杆质谱仪,建立了测定茶叶中黄酮醇糖苷类化合物的分析方法。通过与标准物质比对、分析黄酮醇糖苷类化合物组成及裂解规律,并结合高分辨质谱进行结果解析,共鉴定识别出茶叶中21 种黄酮醇糖苷类化合物,包括5 种杨梅素糖苷(三糖苷2 钟、二糖苷1 种、单糖苷2 种)、8 种槲皮素糖苷(三糖苷4 钟、二糖苷2 种、单糖苷2 种)和8 种山奈素糖苷(三糖苷4 钟、二糖苷2 种、单糖苷2 种)。使用三重四极杆质谱仪对不同产地绿茶中的21 种黄酮醇糖苷类化合物进行测定,以Q-glu-rha 为标准品对其它没有标准物质的黄酮醇糖苷类化合物进行相对定量。
结果表明,不同产地绿茶中黄酮醇糖苷类化合物的含量及分布存在差异,经化学计量学模型分析,采用21 种黄酮醇糖苷类化合物对绿茶地理溯源分析。PCA 显示各地区的茶样有较好的区分度,样品得到有效的聚类。BP-ANN 显示分析模型具有较好的适用性,对6 个地区的绿茶样品识别的准确率均为100.0%,并得到2 种规范化的重要性为100%的黄酮醇苷类化合物标记物(P<0.05)。PLS-DA 显示预测能力为78.2%,预测能力较好,分析结果可靠,判别出重要化学标记成分8 种(VIP>1)。LSD 表明对6 个地区整体判别准确率为100%,交叉验证结果准确率为100%,判别效果较好。综上,采用21 种黄酮醇糖苷类化合物的指纹技术对绿茶地理溯源分析是可行的。
研究开发建立的分析方法适用于分析茶叶中的黄酮醇糖苷类化合物,结合各分析模型成功对不同产地的茶叶进行了地理溯源分析。研究结果为茶叶指纹图谱和化学判别提供参考指标,为茶叶地理溯源提供科学依据,为茶叶产品认证及建立质量追溯体系提供相应技术和理论支撑。在后续研究中应增加有统计意义和代表性的样本量,构建出稳健、有效的产地判别模型,以进一步评价黄酮醇糖苷类化合物在茶叶品质中的适用性。

