蜡梅花发育相关基因CpUFO表达特性与功能分析*
车冰雁 余尚妍 李志能 李先源
(西南大学园艺园林学院 长江上游农业生物安全与绿色生产教育部重点实验室重庆市花卉工程技术研究中心 重庆 400715)
UFO(unusual floral organs)是被子植物中首个被发现的F-box蛋白,主要参与调控花器官决定与发育(Levinet al.,1995; Samachet al.,1999)。F-box家族是植物中的超大家族之一,在拟南芥(Arabidopsis thaliana)中就有超700多个基因编码F-box蛋白(Risseeuwet al.,2003)。F-box蛋白在N端具有40~50个氨基酸的保守基序,是SCF泛素复合体(skp1-cullin-F-box)的重要组分,在植物生长发育过程中起着多重作用,包括植物激素信号转导、自交不亲和、花器官发育以及对生物和非生物胁迫的反应等(Zhanget al.,2019)。在泛素系统中,UFO编码的F-box蛋白负责底物特异性识别,与SKP1(S-phase kinase-associated protein 1)/ASK1(ArabidopsisSkp1-like 1)和Cdc53(cullin)蛋白相互作用,形成泛素连接酶SCF复合体,通过泛素化途径,促进负调控B类MADS-box基因的蛋白的泛素化,激活B类基因的表达(Leeet al.,1997; Takahashiet al.,2004),形成花瓣和雄蕊。在拟南芥中,UFO亦可作为区域特异性共调因子与LFY(LEAFY)相互作用,共同调控B类MADS-box基因的表达(Zhaoet al.,2001;王利琳等,2004),但该调控路径依赖于LFY的活性(Soueret al.,2008)。UFO蛋白能够与LFY蛋白C端结合,直接作用于AP3(apetala 3)启动子,且通过UFO调控蛋白酶体活性是激活AP3转录所必需的(Chaeet al.,2008)。UFO在植物体内外都与LFY相互作用,且这种固定的蛋白互作模式广泛存在,在矮牵牛(Petunia hybrida)中的DOT(double top)和ALF(aberrant leaf and flower)、水稻(Oryza sativa)的APO1(aberrant panicle organization 1)和APO2/RFL(aberrant panicle organization 2/rice floricula)以及番茄(Solanum lycopersicum)的AN(anantha)和FA(falsiflora)中都得到验证(Soueret al.,2008; Ikeda-Kawakatsuet al.,2012;Allenet al,1996)。除此之外,UFO还可参与抑制C类MADS-box基因AG(agamous)负调节拟南芥早期花瓣发育(Durfeeet al.,2003)。
在拟南芥中,UFO在整个发育过程中都在茎尖分生组织中表达(Longet al.,1998),主要参与调控花发育过程中一系列复杂的器官发育,其功能缺失会导致花瓣和雄蕊发育严重受阻,甚至被萼片、心皮和花丝等嵌合器官所代替,同时,AP3和PI(pistillata)的表达量降低(Nget al.,2001)。短日照条件下,ufo突变体表现营养生长向花序特征的紊乱转变(Wilkinsonet al.,1995),而UFO的超量表达则会出现花瓣与雄蕊的缀叠。百脉根(Lotus corniculatus)pfo(proliferating floral organs)突变体及豌豆(Pisum sativum)stp(stamina pistilloida)突变体都存在着花瓣与雄蕊发育受损的现象(Ferrándizet al.,1999; Zhanget al.,2003)。研究发现,矮牵牛UFO的同源基因DOT和番茄中的AN失活后将引发花分生组织特性完全丧失,甚至是花序结构的改变,但DOT在拟南芥中的异位表达并未引发拟南芥花序结构的改变(Kusterset al.,2015; Soueret al.,2008)。除此之外,ufo突变还会引起拟南芥叶片畸形(Leeet al.,1997);异源表达悬铃木(Platanus acerifolia)PaUFO基因,导致拟南芥莲座叶和茎生叶逐渐浅裂(张思思,2016);UFO同源基因STP在豌豆中功能缺失,则会产生简化的叶片(Tayloret al.,2001)。近期研究中还发现过表达蒺藜苜蓿(Medicago truncatula)MtUFO会导致植株小叶片数量增多(石欣玥等,2020)。
蜡梅(Chimonanthus praecox)是我国特有的冬季观花树种,被广泛应用于园林绿化,盆景制作,切花生产等,同时蜡梅花具有较高的药用价值,其花香馥郁,是制作精油、香料的材料(魏玮等,2010),因此对其花发育的研究十分有意义。UFO是被子植物中首个被发现的F-box蛋白(Levinet al.,1995),也是泛素介导蛋白质水解过程中具有底物识别特性的蛋白质(Takahashiet al.,2004),在模式植物拟南芥中,UFO已被证实参与调控花器官决定与发育(Samachet al.,1999)。鉴于此,本试验从蜡梅中克隆CpUFO,构建35S::CpUFO过表达载体并转化拟南芥,进而探究转基因植株的表型变化,以期为阐明蜡梅花发育分子调控机制提供理论参考。
1 材料与方法
1.1 试验材料
试验材料素心蜡梅(C. praecox ‘Concolor’)种植于校内,常规养护管理。拟南芥哥伦比亚野生型(Columbia,Col-0/wild type,WT)种植在(22±2)℃、光周期16 h光/8 h暗、湿度70%的人工气候室。
pMD19-T克隆载体购自于日本TaKaRa公司(大连)。pCAMBIA1300植物表达载体由本实验室保存。大肠杆菌(Escherichia coli)菌株DH5α感受态细胞由本实验室自制,根癌农杆菌(Agrobacterium tumefaciens)菌株GV3101由本实验室自制。
1.2 CpUFO基因克隆及系统进化分析
以成年蜡梅不同花期的花朵为材料,利用EASYspin植物RNA快速提取试剂盒(艾德莱生物)提取蜡梅总RNA,以NanoDrop2000微量核酸测定仪(美国Thermo)和1%琼脂糖凝胶电泳相结合的方法检测RNA浓度及质量。使用PrimeScript®RT-PCR Kit反转录试剂盒(大连宝生物)获得cDNA,根据华中农业大学馈赠的蜡梅基因组、注释信息、CDS(coding sequence)等(Shanget al.,2020),扩增得到CpUFO编码序列全长,连接pMD19-T载体转化大肠杆菌DH5α感受态细胞,经蓝白斑筛选及PCR检测后,将含阳性克隆子菌液送公司测序。所用引物见表1。

表1 本研究所使用引物①Tab. 1 Primers used in this study
利用ProtParam(http://web.expasy.org/protparam/)和SOPMA(https://npsa-prabi.ibcp.fr/)在线工具分别对CpUFO基因编码的蛋白进行分析与二级结构预测,运用Blastp搜索其同源氨基酸序列。多重序列比对及作图分别使用ClustalW和GeneDoc软件。系统发育树构建及美化分别使用MEGA-X软件和iTOL(https://itol.embl.de/)在线工具,采用邻接法(neighbor joining,NJ),泊松模型(Poisson Model),Bootstrap method选择1 000个重复,其他参数默认。
1.3 CpUFO在不同的组织、器官及花发育时期表达特性分析
以成年蜡梅的茎、叶、腋芽、果及初开期的花器官(外花被片、内花被片、雄蕊、雌蕊)为材料,进行CpUFO表达特性分析。从2018年3月8日—12月30日,对蜡梅花芽分化期、露瓣期、始花期至盛开期花芽进行取样(液氮速冻后于-80 ℃冰箱保存,用于总RNA的提取),分析CpUFO在花发育过程中的表达模式。总RNA提取及反转录方法同上。选用蜡梅CpActin与CpTublin基因作为实时荧光定量的双内参基因,反应体系根据SsoFastTMEvaGreen Supermix荧光定量试剂盒(美国Bio-Rad)内说明书配制,利用Bio-Rad CFX96荧光定量PCR仪进行表达分析,试验数据通过Bio-Rad ManagerTMSoftware(Version 1.1)软件进行分析,用2-△△CT法获得目的基因的相对表达量。定量引物见表1。
1.4 转基因拟南芥筛选、表型观察及内源基因表达分析
采用双酶切法构建CpUFO过表达载体,并命名为pCAMBIA1300-CpUFO。利用蘸花法(Cloughet al.,1998)转化拟南芥Col-0,转化后的T0代种子播种在含50 mg L-1潮霉素(hygromycin,Hyg)和125 mg L-1羧苄青霉素(carbenicillin,Cb)的MS固体培养基上进行阳性植株筛选,使用CTAB法提取35S::CpUFO/拟南芥和WT整株基因组DNA,进行PCR阳性检测。采用Trizol法分别提取T2代35S::CpUFO/拟南芥和WT整株总RNA,利用qRT-PCR检测过表达(over expression,OE)株系中CpUFO的表达量,筛选出表达量高、中、低的株系并进行表型观察和内源基因表达量分析,所用引物见表1。
2 结果与分析
2.1 CpUFO目的基因获得与结构域分析
从蜡梅cDNA中克隆得到CpUFO的基因序列,该基因位于第6条染色体上,有2个外显子(图1A、B)。其基因全长cDNA序列为1 665 bp,包含1 212 bp的完整开放阅读框(ORF)和346 bp/107 bp的5'/3'-UTR区(untranslated region)。将CpUFO测序结果在NCBI上Blastx比对发现,该基因属于F-box家族。
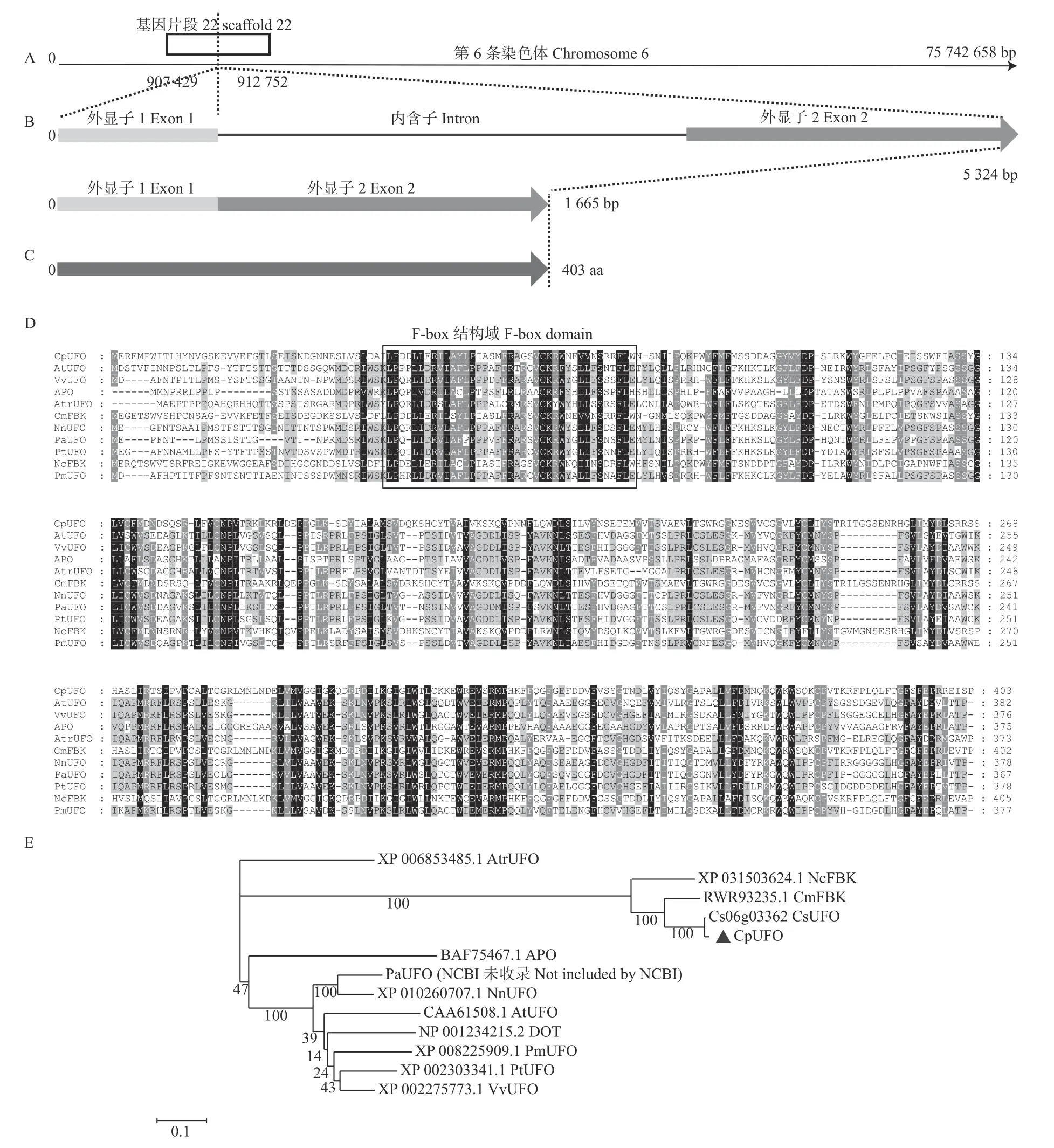
图1 CpUFO序列基本特征(A-C)、CpUFO与其他同源蛋白多序列比对(D)及系统进化分析(E)Fig. 1 Basic characteristics of CpUFO sequence (A-C), multiple alignment (D) and phylogenetic evolution analysis (E) of CpUFO and the other homologous protein
2.2 CpUFO编码蛋白特征及系统进化分析
2.2.1 CpUFO蛋白基本特征分析 利用ProtParam软件在线分析结果表明:CpUFO基因编码蛋白由403个氨基酸组成(图1C),其中包含47个碱性氨基酸[strongly basic(+) amino acids]、43个酸性氨基酸[strongly acidic(-) amino acids]、174个疏水氨基酸(hydrophobic amino acids)和126个极性氨基酸(polar amino acids),所占百分比依次为11.6%、10.7%、43.2%和31.2%;预测分子式为C2071H3183N545O592S24;总原子数为6 415,等电点pI值为6.55;不稳定系数(instability index)为50.69,由此可以推测该蛋白是不稳定的蛋白。脂肪系数为84.81,是亲水蛋白。
利用SOPMA对CpUFO蛋白前体二级结构进行预测结果显示,其主要由12.41%α螺旋(α helix)、29.53%的延伸链(extended strands)、0.00%β转角(β turn)和58.06%的随机卷曲(random coil)组成。
2.2.2 CpUFO蛋白系统进化分析 将CpUFO的最大ORF翻译的蛋白序列在NCBI上进行Blastp比对,从比对结果可以看出CpUFO蛋白与其他物种的UFO蛋白相似性并不高,其中仅与沉水樟(Cinnamomum micranthum)的同源性达80%以上,为82.13%。从CpUFO与拟南芥、葡萄(Vitis vinifera)、水稻等10个物种的UFO同源蛋白多序列比对结果也可以看出,CpUFO蛋白与其他UFO蛋白相似性不高,但其结构域比较保守(图1D)。
从NCBI上下载CpUFO同源蛋白序列以及一些F-box蛋白,构建系统进化树,结果如图1E所示。系统进化分析显示,CpUFO同柳叶蜡梅(Chimonanthus salicifolius)、睡莲(Nymphaea colorata)、沉水樟聚为一支,且与柳叶蜡梅亲缘关系最近。
2.3 CpUFO表达特性分析
2.3.1 不同组织、器官中CpUFO表达特性分析 通过qRT-PCR进行组织特异性分析表明,CpUFO的表达主要集中在花器官中,其中外花被片中表达量最高,内花被片中表达量次之,雌/雄蕊中表达量相当。在腋芽、叶、茎、果中,CpUFO表达量依次降低,在果中表达量仅0.02,不足外花被片中表达量的1/100,表达差异极显著(图2A)。同时,LFY、WOX13(WUSCHEL related homeobox 13)、AP3、SEP1(Sepallata 1)在蜡梅中的同源基因也均显示在外花被片中表达量最高(图2B-E),由此推测CpUFO可能与上述基因存在一定的调控关系,并共同调控外花被片的发育。
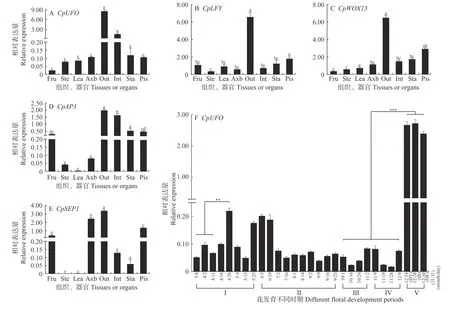
图2 不同基因在蜡梅不同组织、器官中的相对表达量(A-E)及CpUFO在不同花发育时期的相对表达量(F)Fig. 2 Relative expression of different genes in different tissues or organs (A-E) and relative expression of CpUFO at different floral development periods of C. Praecox (F)
2.3.2 自然条件下不同花发育时期CpUFO表达特性分析 利用qRT-PCR对CpUFO在蜡梅不同花发育时期花芽中的表达模式进行分析,结果表明,从蜡梅花原基形成阶段进入休眠阶段,到子房发育成熟,再到开花前的需冷量累积阶段,CpUFO基因表达量均较低,且整体呈先升高后降低的趋势;其中4月28日和5月25日花原基形成期、6月5日—19日休眠起始阶段的表达量相对较高,是其他时期表达量的1.75~9.00倍。CpUFO在花芽打破休眠/花蕾开放阶段的露瓣DT(displayed tepal)、始花IB(initiate blooming)和盛开期OF(open flower stage)花芽中表达水平达到最高,均极显著高于其他时期花芽,分别是子房发育阶段及需冷量累积阶段的38.7倍和38.9倍(图2F)。
2.4 35S::CpUFO/拟南芥表型分析
对CpUFO过表达拟南芥T0代经PCR筛选后(图3A, B),对纯合35S::CpUFO/拟南芥T2代不同株系中CpUFO基因的表达量进行qRT-PCR检测,挑选出CpUFO基因表达量高/中/低的OE6-1/OE16-3/OE1-1株系(图3C),进行表型观察。结果表明,35S::CpUFO株系OE6-1/16-3/1-1均具有明显的早花现象,且与表达量成正相关。对花器官进行解剖观察后发现,在同一个开花生长时期的转基因株系中雌蕊柱要比WT株系的雌蕊柱长,但成熟后的果荚长度无明显差异。过表达株系中莲座叶数目显著减少,抽薹时间、第1个果荚形成时间缩短,且与表达量成负相关。综上所述,推测CpUFO过表达能够缩短拟南芥营养生长时间、促进早花,并对其花器官产生一定影响(表2,图3D-I)。
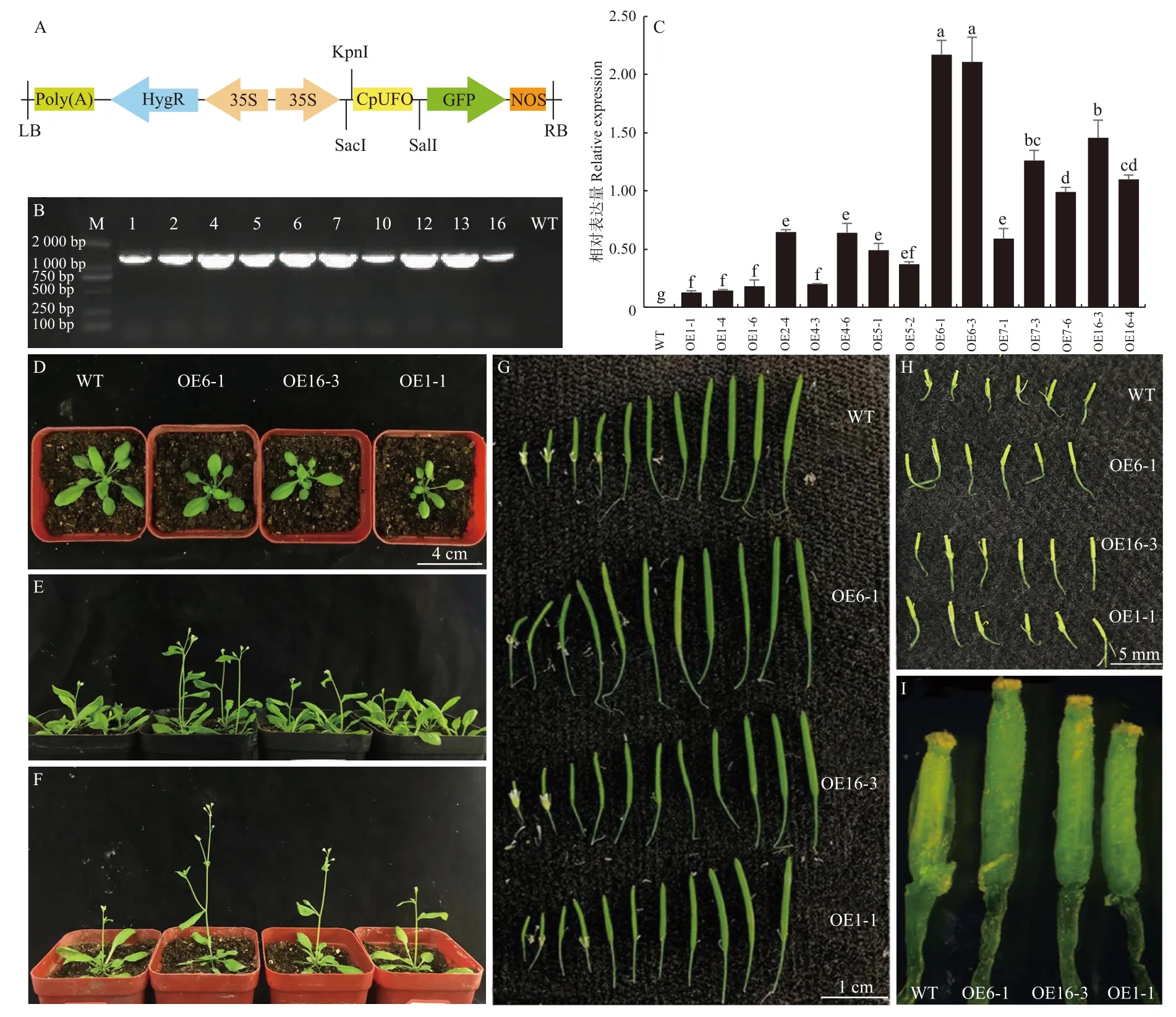
图3 35S::CpUFO/拟南芥株系筛选及T2代株系表型分析Fig. 3 Screening of overexpression and phenotypic analysis of T2 generation of 35S::CpUFO/Col-0 lines and WT in A. thaliana
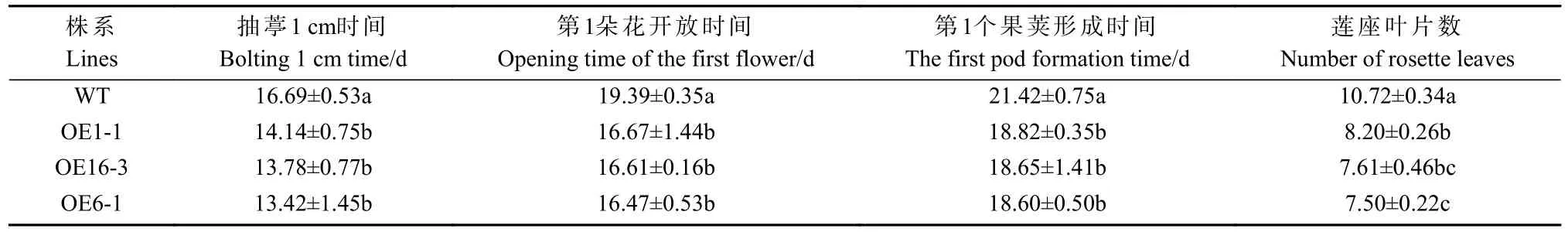
表2 35S::CpUFO/拟南芥T2代株系表型分析①Tab. 2 Phenotypic analysis of T2 generation of 35S::CpUFO/Col-0 lines and WT
2.5 35S::CpUFO/拟南芥内源基因的表达分析
为探究35S::CpUFO/拟南芥表型变化的原因,选取拟南芥中5个花发育相关基因进行qRT-PCR分析。结果表明,拟南芥中的AP1、AP3、FUL(fruitfull)基因均有不同程度的上调,同时OE1-1株系中3个基因的表达量均显著高于WT株系。与野生型相比,35S::CpUFO/拟南芥中作为调控开花的抑制因子TFL1(terminal flower 1)基因显著下调(图4)。可见,蜡梅CpUFO基因过表达具有促进拟南芥早花的功能。
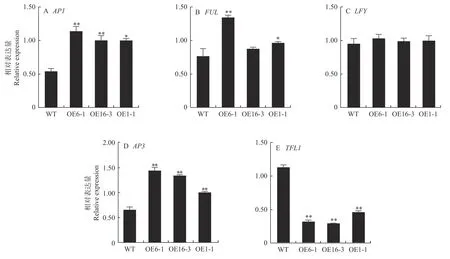
图4 35S::CpUFO/拟南芥T2代株系内源基因的相对表达量Fig. 4 Relative expression of endogenous genes from T2 generation of 35S::CpUFO/Col-0 lines and WT
3 讨论
目前,已经在拟南芥(Levinet al.,1995)、金鱼草(Antirrhinum majus)(Ingramet al.,1997)、玉米(Zea mays)(Chucket al.,2002)、水稻(Ikedaet al.,2007)、波斯菊(Cosmos bipinnatus)(Liet al.,2019)、蒺藜苜蓿(马翠娜等,2020)等多个物种中分离并克隆得到UFO及其同源基因,并在不同物种中对其参与花发育调控机制进行研究。研究表明,UFO基因参与调控花分生组织形成及花器官识别,但其调控网络在不同物种间可能具有一定差异,如拟南芥UFO基因缺失将导致花瓣和雄蕊发育严重受阻(Ingramet al.,1995);UFO同源基因FIM(Fimbriata)在金鱼草中异常表达会导致其无法形成正常的心皮(Ingramet al.,1997)。而在头状花序植物波斯菊中,CbUFO基因的缺陷表达,则会导致难以区分的花序外围和中心(Liet al.,2019)。UFO与LFY同源基因相互作用在多个物种中得到验证,但在悬铃木及樟树(Cinnamomum camphora)开花机制研究中这一互作关系却不明显(张思思,2016; 周琴,2016),初步推测可能是由于UFO与LFY同源基因在木本植物花发育调控过程中产生了功能冗余或是分化,亦或是两者的表达域在空间与时间上无法重叠导致。而在木本植物水杉(Metasequoia glyptostroboides)中,UFO与LFY同源基因仍存在互作关系(王菁菁,2019)。因此,对于CpUFO基因的研究,不仅能够丰富UFO基因参与调控植物开花机制的多样性,也能为蜡梅观赏性状改良提供更多线索。
研究显示,UFO在不同物种组织间广泛表达。在拟南芥、油松(Pinus tabuliformis)以及樟树中,UFO基因在营养组织和生殖组织中均有表达,但其表达量在时空上呈现显著差异,与花发育的表达模式密切相关。如拟南芥UFO表达主要集中在中心区域,且随花发育的进行,在空间上表现出精确的界限,最后仅局限于花瓣原基区域(Ingramet al.,1995);油松UFO同源基因PtUFO2主要在雌雄球花中表达,且表达量均在雌雄球花的花发育初始阶段达到最高(袁露,2015);樟树CcUFO在花苞中表达量最高,作用于花发育早期阶段,促进早花(周琴,2016)。在本研究中,CpUFO同样广泛表达于蜡梅不同组织,在花器官中,尤其是外花被片中表达量达到最高;同时CpLFY表达量也显示在外花被片中达到最高,这可能与花器官形成与正常发育相关,符合UFO基因功能在不同物种间具有保守性这一结论,即UFO激活LFY,UFO与被激活的LFY相互作用进一步激活B类MADS-box基因(Ikedaet al.,2007; Soueret al.,2008)。在全年不同发育阶段花芽中,CpUFO在露瓣、始花和盛开期表达量相对最高,这与樟树花发育表达模式相似(周琴,2016)。由此推测,CpUFO可能参与蜡梅开花调控及花器官发育。
在蜡梅CpUFO过表达拟南芥的表型观察中发现,35S::CpUFO/拟南芥出现莲座叶减少、开花提前的现象,与拟南芥中异位表达樟树CcUFO表型观察结果一致(周琴,2016);在35S::CpUFO/拟南芥株系与WT株系内源基因相对表达量分析中发现,CpUFO的超量表达,引起了拟南芥B类功能基因AP3的表达,同时,拟南芥中成花抑制因子TFL1下调,从而上调其下游基因AP1的表达,进而促进花分生组织的形成、提早开花,同已报道的拟南芥中的研究结果一致(Takahashiet al.,2004; Blumelet al.,2015);UFO蛋白可通过参与修饰LFY蛋白,来增强LFY的转录活性(Chaeet al.,2008);同时,TFL1在拟南芥营养生长向生殖生长转变过程中对LFY具有负调控作用(王利琳等,2004; Zhuet al.,2020),但在本研究中,LFY的表达量并无显著变化。前人的研究发现,UFO同源基因在参与花发育过程中具有保守性(Levinet al.,1995;Ingramet al.,1997; Ikeda et al.,2007),但在本试验中,CpUFO的超量表达除促进转基因株系中雌蕊柱的伸长外,并未见明显的花器官身份改变,推测是CpUFO活性在拟南芥中受限所致(Kusterset al.,2015)。综上所述,35S::CpUFO/拟南芥表型及其内源基因相对表达量分析结果与拟南芥UFO激活花器官决定基因、触发花发育及TFL1参与成花抑制功能研究结果相似(Shannonet al,1991; Ohshimaetal.,1997;Zhaoet al.,2001; Hananoet al,2011; Risseeuwet al.,2013),推测CpUFO基因能够促进蜡梅开花,但其分子作用机制还需深入研究。
4 结论
本研究克隆得到蜡梅CpUFO基因全长cDNA序列为1 665 bp,编码403个氨基酸。系统进化分析发现,CpUFO与无油樟聚为一支,进化地位较低,但结构域比较保守,具有F-box家族典型的F-box基序。35S::CpUFO过表达拟南芥研究结果显示,CpUFO可能促进植物营养生长向生殖生长的转变,形成早花,同时参与调控花器官的发育,这为阐明蜡梅花发育分子调控机制提供一定参考。
——紫 苏

