IGF-1、IGFBP-3在非小细胞肺癌组织中的表达及其临床意义
李冯洋 赵 兵 饶钟鸣
肺癌为常见恶性肿瘤之一,死亡率、发病率均最高。2020年全球范围内大约180万例死亡原因为肺癌[1]。近年来,我国经济不断发展,人们生存环境也在发生变化,环境污染、吸烟等也可引起肺癌疾病发生率增加[2]。依据生物特性、预后等,常将肺癌分为非小细胞肺癌(non-small-cell lung cancer,NSCLC)、小细胞肺癌(small-cell lung cancer,SCLC),NSCLC占比达到80%,包括非鳞癌和鳞癌[3]。因早期症状不明显,大部分患者确诊后便处于中晚期。由此,对于NSCLC,早诊断、早治疗尤为重要。类胰岛素一号生长因子(insulin-like growth factor 1,IGF-1)为IGFS中关键成分之一,研究称,多种肿瘤疾病中IGF-1表达均存在异常上调的现象[4]。本次研究主要探讨IGF-1、胰岛素样生长因子结合蛋白-3(Insulin-like growth factor binding protein-3,IGFBP-3)在非小细胞肺癌患者血清和肺癌组织中的表达及临床意义,内容如下。
1 材料与方法
1.1 一般资料
收集2018年1月至2022年5月在本院就诊的NSCLC患者98例纳入观察组,纳入标准:①均符合NSCLC疾病的诊断标准,且均经过临床、影像学技术及病理学检查;②根据国际肺癌研究协会(international association for the study of lung cancer,IASLC)发布的第8版国际TNM分期标准;④既往均无免疫抑制剂治疗史、放射治疗史及化疗治疗史等;⑤入院资料均完整;⑥预计患者生存时间≥3个月;⑦体力状况ECOG评分<3分者;⑧均已签署知情同意书;⑨转移型肺癌者;⑩合并其他代谢类疾病。同时期收集肺部良性病变患者40例纳入对照组。对照组:男性23例,女性17例,年龄35~77岁,平均(62.6±5.7)岁,体质量指数(body mass index,BMI)18~27 kg/m2,平均(22.6±4.3)kg/m2;观察组:男性53例,女性45例,年龄35~77岁,平均(62.4±5.5)岁,BMI 18~27 kg/m2,平均(22.8±4.1)kg/m2。两组一般资料比较,P>0.05。
1.2 研究方法
(1)资料收集:通过病历系统收集患者临床资料信息,如性别、年龄、病理类型、部位、肿瘤最大径、肿瘤分化程度、淋巴结是否转移等。
(2)采集血清:入院第2天,采集患者空腹状态下静脉血4 ml,静置30 min,离心,获取上层血清,置于-80 ℃保存。
(3)标本采集:观察组均进行肺癌根治术、淋巴结清扫术,手术治疗后,获取肿瘤组织,予以40 g/L甲醛溶液固定,石蜡包埋;对照组距离病变位置至少5 cm处获取正常肺组织,石蜡切片。
(4)血清IGF-1、IGFBP-3水平检测:手术治疗前,均采用化学放光免疫分析法检测。
(5)肺组织内IGF-1、IGFBP-3阳性表达检测:采用免疫组织化学染色法检测,具体操作步骤严格遵循说明书进行。在高温、高压下,予以适量枸橼酸盐溶液进行抗原修复处理,再予以适量DAB溶液显色,NSCLC阳性照片作为对照,将PBS溶液作为阴性对照,观察染色情况,若颜色呈现为深棕色、棕色表示阳性,再随机选取高倍镜下5个视野,每个视野下细胞数目需要达到100个及以上,阳性细胞数≥10%表示阳性,否则为阴性。
1.3 统计学方法

2 结果
2.1 血清IGF-1、IGFBP-3水平
观察组血清IGF-1水平高于对照组,观察组IGFBP-3水平低于对照组,P<0.05。见表1。

表1 两组血清IGF-1、IGFBP-3水平比较
2.2 血清IGF-1、IGFBP-3水平与NSCLC临床病理特征的关系
血清IGF-1、IGFBP-3水平与年龄、性别、部位、病理类型、肿瘤最大径、分化程度无关,P>0.05,血清IGF-1、IGFBP-3水平与TNM分期、淋巴结转移、局部侵犯有关,P<0.05。见表2。

表2 血清IGF-1、IGFBP-3水平与NSCLC临床病理特征的关系
2.3 两组IGF-1、IGFBP-3阳性表达情况
观察组IGF-1阳性表达率高于对照组,观察组IGFBP-3阳性表达率低于对照组,P<0.05,见表3。
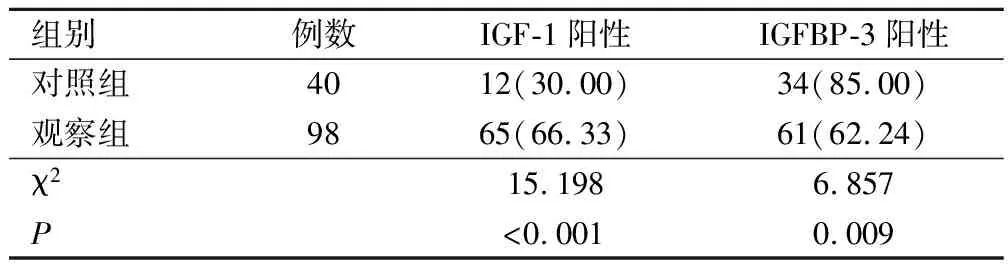
表3 IGF-1、IGFBP-3阳性表达情况(例,%)
2.4 肺癌组织内IGF-1、IGFBP-3阳性表达率与NSCLC临床病理特征的关系
肺癌组织内IGF-1、IGFBP-3阳性表达率与年龄、性别、部位、病理类型、肿瘤最大径、分化程度无关,P>0.05,IGF-1、IGFBP-3阳性表达率与TNM分期、淋巴结转移、局部侵犯有关,P<0.05。见表4。

表4 肺癌组织内IGF-1、IGFBP-3阳性表达与NSCLC临床病理特征的关系/例
2.5 ROC曲线分析血清IGF-1、IGFBP-3水平对NSCLC的诊断效能
血清IGF-1诊断NSCLC曲线下面积(AUC)为0.733,灵敏度为55.5%,特异度为91.2%,最佳截断值150.26 μg/L;血清IGFBP-3诊断NSCLC AUC为0.799,灵敏度为63.6%,特异度为78.6%,最佳截断值1413.54 μg/L。见图1。
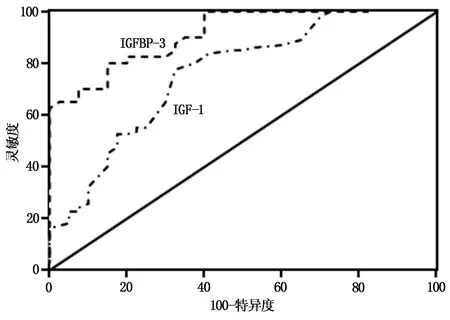
图1 ROC曲线分析血清IGF-1、IGFBP-3水平对NSCLC的诊断效能
3 讨论
肺癌主要特征为清晰、转移,此类患者疗效以及预后均较差[5]。近年来,医疗技术不断更新,各种新型化疗药物不断被合成并应用,但并没有显著提高肺癌患者生存率,且5年生存率仅仅为15%[6]。但大部分人群对肺癌疾病的认知程度较低,且因医疗资源的欠缺,大部分患者无法及时确诊,使得就诊确诊后处于中晚期阶段,从而错失最佳手术治疗时机,但手术疗效欠佳,术后患者5年生存率低于50%[7]。由此,积极改善NSCLC患者预后尤为重要。
本次研究结果发现,IGF-1表达与TNM分期、淋巴结转移、局部侵犯存在关系,且在TNM分期为Ⅲ~Ⅳ期、存在淋巴结转移及局部侵犯为T3~T4患者中表达水平更高,表明IGF-1表达水平可能与NSCLC转移、侵袭存在关系。IGF-1主要来源于肝脏,属于一类内源生长因子,主要作用为修复、保护受损细胞DNA,IGF-1还可通过多种炎性因子,进而促进肿瘤细胞的生长;IGF-1还可促进新生血管生成的作用,提高肿瘤细胞侵袭水平[8]。研究报道[9],IGF-1与多种肿瘤疾病进展存在关系,肿瘤细胞生长的关键与促细胞生长功能紊乱存在关系。又如Ding等的研究称[10],NSCLC患者血清IGF-1水平明显较正常人群高,且局部侵犯、TNM分期及淋巴结转等均可对血清IGF-1水平产生影响,与本次研究结果具有一致性。
本次研究结果发现,IGFBP-3在NSCLC肺癌组织中表现为弱阳性、阴性,但在肺部良性病变组织内表现为阳性,且TNM分期为Ⅲ~Ⅳ期、存在淋巴结转移及局部侵犯为T3~T4患者中表达更高。IGF-1常与IGFBP-3蛋白结合,IGFBP-3蛋白可对胰岛素样生长因子抗凋亡能力发挥抑制作用,还可抑制血管内皮细胞生长[11]。研究称[12],IGFBP-3水平与血管内皮生长因子(vascular endothelial growth factor,VEGF)水平之间呈负相关,VEGF高表达可促进肿瘤进展,此研究表示IGFBP-3可通过VEGF发挥作用,改变血管生长,最终控制肿瘤进展。因此,IGFBP-3在血清及组织内表达均较低。
综上所述,NSCLC患者血清IGF-1、IGFBP-3主要与TNM分期、淋巴结转移及局部侵犯存在关系,且血清IGF-1、IGFBP-3水平可作为NSCLC辅助诊断手段。本次研究结果存在一些不足,因条件受到限制,纳入的样本例数较少,虽采用的统计学方法得到较高的精准性,但是此项研究可靠性有待进一步探讨。另外本研究仅仅纳入本地区人员,无法纳入全国范围内人群,一定程度上限制了本次研究结果在其他人群中的适应性,期待后续研究弥补本研究不足,提高研究结果准确性。

