多模态超声在浅表软组织肿块鉴别诊断中的应用价值
阮丽香,崔嘉倩(通信作者)
厦门大学附属第一医院杏林分院 (福建厦门 361021)
浅表软组织肿块是指发生于皮肤、皮肤附件、皮下组织等肉眼可见或能直接触及的突出性肿块。常见的浅表软组织肿块有脂肪瘤、皮脂腺囊肿、神经纤维瘤等,常见病因包括局部或全身性感染、恶性肿瘤淋巴结转移等。浅表肿物生长位置可遍及全身,其组织分类多样且复杂,临床表现及预后差异显著,因此临床需要确定肿块性质后制定适当的治疗策略[1-2]。有资料显示,浅表软组织肿块触诊检查灵敏度仅45%~78%,难以满足临床诊断需求[3]。随着影像技术的发展,超声检查以高效、快捷、经济等优势成为浅表软组织肿块主要诊断方法[4]。不同超声技术的侧重点不同,彩色多普勒血流显像(color doppler flow imaging,CDFI)可将探查的血流信息经相位检测、彩色灰阶编码等将平均血流速度资料用彩色显示,并显示在B 型灰阶图像上,从而更直观地观察血流性质和流速。超声弹性成像(ultrasound elastography,UE)是通过对受压前后组织变形编码,以图像色彩评估组织特征。本研究旨在探讨多模态超声在浅表软组织肿块鉴别诊断中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2020 年3 月至2021 年3 月我院收治的115 例浅表软组织肿块患者,男65 例,女50 例;年龄28~67 岁,平均(43.5±7.4)岁;肿块直径1.42~11.53 cm,平均(7.13±1.57)cm;病程2~9 年,平均(1.38±0.27)年。
纳入标准:均因局部软组织肿胀、疼痛就诊,且初步诊断为浅表软组织实性、混合性肿块;均行CDFI 及UE 检查,获取的影像学资料清晰且完整;患者及家属知情且签署同意书。排除标准:合并精神疾病、认知功能损伤、交流障碍;伴有凝血功能障碍、免疫系统疾病;合并其他部位恶性肿瘤,且进行放化疗治疗;超声影像图有严重伪影。
1.2 方法
通过问诊了解患者浅表软组织肿块生长情况、相关症状、检查及治疗史等基本信息;触诊了解肿块位置、硬度、活动度及是否有痛感(牵拉痛)。采用HITACHI Preirurs 彩色多普勒超声诊断仪,线阵探头(频率4~12 MHz)进行超声检查。(1)CDFI检查。依据患者肿块位置选择检查体位,先行二维超声检查了解肿块形态、大小、包膜、边界及内部回声情况。再应用CDFI 评估肿块内部/周边血流,用脉冲式多普勒采集血流频率信息,分析肿块血流信号分级及血流信号特征。血流信号分级标准[5]:无血流信号为0 级;点状、闪烁且不稳定血流信号,为Ⅰ级;短棒状且稳定的血流信号为Ⅱ级;条状、树枝状或片状血流信号为Ⅲ级。血流信号特征包括峰值血流速度(Vmax)、血管阻力指数(resistance index,RI)。(2)UE 检查。先行灰阶超声检查,测量肿块内部回声及最大径。UE 检查时检查者手法加压并手持探头与肿块保持垂直,轻微振动压力在3~4 间(持续4 s)。将取样框放在病灶处并大于病灶范围,经双幅实时显示功能观察病灶的二维图、弹性图。弹性图中彩色编码反映不同组织弹性情况(绿色即感兴趣区内组织平均硬度;淡紫色即该部分组织硬度低于平均值;红色即硬度高于平均值)。参照Itoh 法UE 评分标准[6]:病变区及邻近组织均被绿色覆盖,计1 分;病变区以绿色为主且蓝绿混杂计2 分;病变区以蓝色为主且临近组织有绿色,计3 分;病变区均由蓝色覆盖,计4 分;病变区及临近部分组织均由蓝色覆盖,计5 分。1~3 分为良性,4~5 分为恶性。
1.3 观察指标
(1)CDFI 及UE 诊断浅表软组织肿块检出率比较:以病理检查结果为金标准,分析CDFI 及UE的检出率。(2)不同性质肿块CDFI 及UE 参数比较:依据病理检查结果将浅表软组织肿块按照性质分为良性组与恶性组,对比两组CDFI 血流特征及UE 评分差异。(3)多模态超声在浅表软组织肿块的诊断效能。以病理诊断结果为因变量,以CDFI血流特征(Vmax、RI)及UE 评分为自变量,构建多模态超声诊断预测模型,绘制受试者操作特征(receiver operating characteristic,ROC)曲线分析多模态超声在浅表软组织肿块诊断中的效能。
1.4 统计学处理
采用SPSS 25.0 统计学软件处理数据。检出率等计数资料用率表示,组间行χ2检验。计量资料以±s表示,组间行LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 CDFI 及UE 诊断浅表软组织肿块检出率比较
病理诊断显示,115 例患者中良性肿块94 例,恶性肿块21 例。CDFI 检出率为84.35%,UE 检出率为92.17%,见表1。

表1 CDFI 与UE 在浅表软组织肿块检出率比较[例(%)]
2.2 不同性质浅表软组织肿块CDFI 及UE 参数比较
良性组Vmax、RI 及UE 评分低于恶性肿块组,且血流信号分级Ⅱ~Ⅲ级占比高于恶性组,差异有统计学意义(P<0.05),见表2。
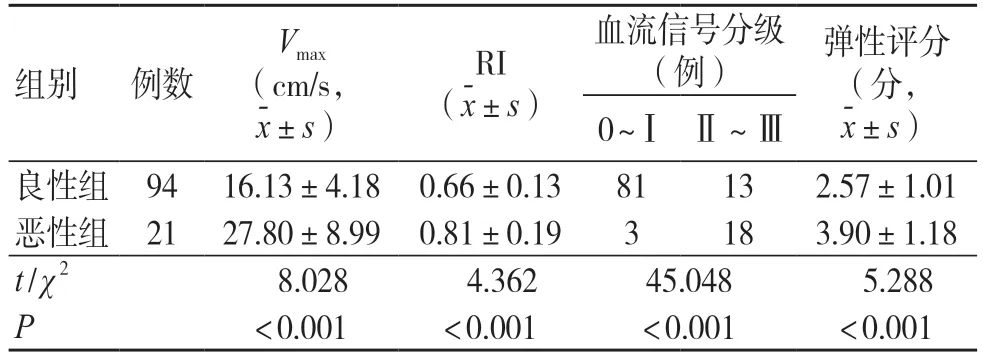
表2 两组浅表软组织肿块CDFI、UE 参数比较
2.3 浅表软组织肿块良恶性的危险因素分析
以病理诊断结果为因变量,以多模态超声参数为因变量进行二元Logisti回归分析。结果显示,Vmax、UE 评分是评估浅表软组织肿块性质的独立影响因素(P<0.05),见表3。
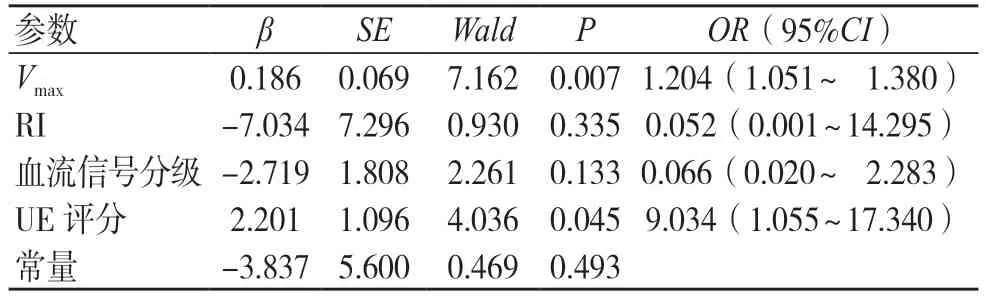
表3 多模态超声定量参数与浅表软组织肿块性质的Logistic 回归分析
2.4 构建联合预测模型
基于Logistic回归分析结果构建联合诊断方程:Log(P)=0.186×Vmax+2.201×UE 评分。以病理诊断结果为因变量,以Vmax、UE 评分及联合预测因子为自变量绘制ROC 曲线。结果显示,联合诊断曲线下面积(area under the curve,AUC)为0.977(0.950~1.000),高于Vmax、UE 评分等单一指标,见图1。多模态超声定量参数联合诊断的灵敏度高于UE 评分;联合诊断特异度高于Vmax,表4。

图1 多模态超声在浅表软组织肿块良恶性诊断的ROC 曲线

表4 多模态超声诊断浅表软组织肿块的效能
3 讨论
浅表软组织肿块起源于肌肉、脂肪及神经组织,良性肿块可通过抑制肿瘤细胞活性使其自然消失,或经手术切除灶体均可取得理想的预后质量[7];恶性肿块普遍预后较差,且可能影响其他组织及器官功能,需结合放化疗、手术等综合疗法,增加了并发症的发生风险。浅表软组织肿块定性诊断是临床制定治疗策略的关键,病理活检是目前浅表软组织肿块诊断的金标准,但在实际诊疗过程中并不适合所有患者,尤其是位置深、体积小且靠近血管的病灶,操作风险极大[8]。超声是目前应用最为广泛的影像学检查手段,可通过观察肿块回声信号结合病史进行临床诊断,但浅表软组织肿块类型多、分布广、病因杂,且超声信号存在重叠交叉,导致良恶性鉴别灵敏度较低[9]。CDFI 可通过血流信号分析肿块内部及周围血供情况[10],UE 则通过评估组织硬度反映组织生物学特性[11]。
本研究结果显示,115 例患者中良性肿块94 例、恶性肿块21 例。CDFI 诊断检出率为84.35%,UE 诊断检出率为92.17%。对比显示良性肿块组CDFI 参数(Vmax、RI)及UE 评分均低于恶性肿块组,血流信号Ⅱ~Ⅲ级占比显著高于恶性肿块组(P<0.05),与既往研究结果基本一致[12-13]。提示CDFI 及UE定量或半定量参数能够区分浅表软组织肿块的性质。Logistic分析显示,Vmax与UE 评分均为浅表软组织肿块良恶性的独立影响因素(P<0.05)。基于该两项参数构建联合诊断模型并绘制ROC 曲线,结果显示,多模态超声参数联合诊断的AUC为0.977(0.950~1.000),灵敏度高于UE 评分单一诊断,而特异度高于Vmax单一诊断。因此,针对浅表软组织肿块患者可采用多模态超声检查,充分发挥不同超声技术的优势,提升诊断效能。
本研究的不足之处包括:(1)样本量小,可能影响结果准确性;(2)浅表软组织肿块的种类较多,未针对不同类型的肿块进行针对性分析,因此无法判断多模态超声在不同种类良恶性肿块鉴别的价值。鉴于此,未来可开展大样本、多中心试验对本研究结果进行验证。
综上所述,多模态联合超声诊断浅表软组织肿块能够充分发挥不同超声检查的优势,提升患者良恶性鉴别诊断效能。

