基于代谢组学研究肝复乐胶囊抑制LX-2 细胞激活机制
柯 畅,刘艳菊,2,涂济源,张方蕾,高建龙,周仲实∗
(1.湖北中医药大学药学院,湖北 武汉 430065; 2.湖北省中药炮制工程技术研究中心,湖北 武汉 430065; 3.湖北省肿瘤医院,湖北 武汉 430074)
肝纤维化是一种肝脏损伤病理进程,常由饮酒、血吸虫、肝炎等致病因素引起。肝脏受损自我修复过程中,细胞外基质增生与胶原沉积引发纤维化进展[1]。肝纤维化伴随着多种肝脏疾病的发生,严重的肝纤维化会发展为肝硬化,甚至导致肝癌[2]。而肝星状细胞(HSCs) 激活后转化为成纤维细胞是肝纤维化发生发展的关键[3]。肝星状细胞代谢紊乱与肝纤维化进展关系密切,当肝脏受损时,肝实质细胞与肝星状细胞会发生相互作用,导致线粒体功能紊乱,肝实质细胞脂质堆积[4]。
肝复乐是潘敏求教授经多年临床观察与研究发明的国家级抗癌三类新药,由党参、白术、鳖甲等21 味中药组成,具有健脾理气、化瘀软坚、清热解毒等功效。动物药理实验表明,肝复乐除对原发性肝癌疗效卓著外,对实验性肝纤维化大鼠也具有明显保护作用[5]。但其发挥抗肝纤维化作用的机制尚未被阐明。基于此,本研究构建人肝星状细胞LX-2 体外纤维化模型[6],采用分子生物学方法检测肝星状细胞活化标志物,分析肝复乐对肝星状细胞激活是否有抑制作用,再以GC-MS 法和代谢组学研究分析肝复乐对内源代谢物质的影响,探讨其发挥抑制作用的可能代谢通路。
1 材料
1.1 细胞 人肝星状细胞LX-2 (武汉普诺赛生命科技有限公司,货号CL-0560)。
1.2 药物与试剂 肝复乐胶囊(康普药业股份有限公司,批号20201128)。LX-2 细胞专用培养基(武汉普诺赛生命科技有限公司,批号WH01112103SP); TGF-β1 蛋白(上海近岸科技有限公司,批号0520611); 0.25%胰酶消化液、MTT (北京索莱宝科技有限公司,批号 20200930、20210112); SYBR green qPCR 混合染料、逆转录试剂盒(南京诺唯赞生物科技股份有限公司,批号7E452K0、1D352FE); 甲醇、吡啶、methoxyamine hydrochloride (色谱纯,美 国 Sigma-Aldrich 公 司,批 号 10765821435、STBK5658、BCCG1261); BSTFA (美国Cerilliant 公司,批号FN05241802); GAPDH 小鼠单克隆抗体、α-SMA 兔多克隆抗体、COL1A1 小鼠单克隆抗体(武汉三鹰生物技术有限公司,批号10013030、00082687、71010160)。
1.3 仪器 免疫印迹电泳系统(上海天能生命科学有限公司); qTOWER3 G 荧光定量PCR 仪(德国Analytik Jena AG公司); 225SM-DR 十万分之一分析天平(瑞士Precisa 公司); 多功能酶标仪(美国Agilent 公司); 1730R 微量高速冷冻离心机[基因科技(上海) 股份有限公司]; SW-CJ-2FD 洁净工作台(苏州安泰空气技术有限公司); CKX53倒置光学显微镜(日本奥林巴斯公司); CO2恒温培养箱(美国赛默飞公司)。
2 方法
2.1 肝复乐溶液制备 取肝复乐内容物10 g,用90 mL 80%乙醇回流提取,过滤,滤渣再次回流提取,合并2 次滤液,冻干,得到冻干粉3.47 g,PBS 定容至10 mL,按原胶囊质量记,得到1 g/mL 混悬液。用含10% 胎牛血清、1%青链霉素的DMEM 高糖培养基稀释至10 mg/mL,37 ℃超声溶解30 min,0.22 μm 微孔滤膜过滤除菌除杂,得到10 mg/mL 母液。
2.2 细胞培养 LX-2 细胞使用专用培养基培养,每瓶DMEM 高糖培养基中含有10%胎牛血清、1%青链霉素。待细胞生长传代至第三代时,取部分细胞加入细胞冻存液进行冷冻保存。LX-2 细胞接种于96 孔板中,细胞密度为2×103/孔,过夜贴壁后,弃上清,加入含0、125、250、500、1 000、2 000 μg/mL 肝复乐的培养基培养24 h,MTT 法检测细胞活力。取细胞接种于60 mm 中皿或6 孔板中,培养24 h,模型组LX-2 细胞给予5 ng/mL TGF-β1,肝复乐125、250、500 μg/mL 组在给予5 ng/mL TGF-β1 和相应剂量肝复乐共同孵育24 h 后,中皿细胞用RIPA 法提取蛋白进行免疫印记检测。6 孔板细胞用TRIzol 法提取RNA 进行实时荧光定量PCR 检测。对照组、模型组、肝复乐组 (500 μg/mL) 细胞使用6 孔板培养,进行后续代谢组学研究。
2.3 MTT 法检测LX-2 细胞活力 设置肝复乐给药质量浓度为0、125、250、500、1 000、2 000 μg/mL,以未给药细胞活力为100%,MTT 法检测各给药组对人肝星状细胞LX-2 的增殖毒性,每组重复6 次。
2.4 Western blot 法检测细胞α-SMA、COL1A1 蛋白表达 收集中皿培养细胞,RIPA 裂解液裂解细胞后提取蛋白,并进行蛋白浓度检测,加入loading buffer 后金属浴煮沸,于-80 ℃冰箱保存备用。蛋白样本进行SDS-PAGE 电泳,转膜,封闭,加入GAPDH (1 ∶ 20 000)、α-SMA (1 ∶1 000)、COL1A1 (1 ∶5 000) 一抗4 ℃下孵育12 h,加入HRP 标记二抗(1 ∶5 000) 孵育1 h,ECL 显影后用Image J 软件统计条带灰度值,计算相对表达。
2.5 RT-qPCR 法检测细胞α-SMA、COL1A1、COL4A2、MMP9、TIMP1 mRNA 表达 收集各组细胞,TRIzol 法提取总RNA,检测RNA 浓度,使用试剂盒将所得RNA 逆转录为cDNA,加入基于SYBR Green 染料的扩增试剂盒及引物进行多聚酶链式反应。反应条件为95 ℃1 min,95 ℃20 min,60 ℃45 s,共40 次循环,95 ℃1 min,通过2-ΔΔCT法处理数据。引物序列见表1。

表1 引物序列
2.6 GC-MS 样品前处理 参考文献[7] 报道,收集各组细胞,用37 ℃预热的0.9%生理盐水冲洗,加入4 ℃预冷的纯水冲洗,将细胞转移至冰上,加入-80 ℃预冷甲醇250 μL 淬灭,刮刀刮取细胞于EP 管中,再加入-80 ℃预冷甲醇250 μL 冲洗6 孔板,合并溶液。样本保存于-80 ℃。EP管反复冻融3 次以裂解细胞(液氮冷冻10 min,室温解冻5 min)。4 ℃下12 000 r/min 离心10 min,吸取上清400 μL至新的EP 管,氮吹仪吹干。提前配制好20 mg/mL甲氧基-吡啶,向干燥后的EP 管中加入80 μL,混匀,37 ℃烘箱孵育2 h,加入80 μL BSTFA,混匀,80 ℃水浴加热1 h。室温静置5 min 后,涡旋混匀,4 ℃下12 000 r/min离心10 min,取100 μL 上清,于内衬管中准备进样。
2.7 GC-MS 分析条件 参考文献[8] 报道,DB-5MS 毛细管柱(30 mm×0.25 mm×0.25 μm); 程序升温(起始温度80 ℃,保持3 min,以5 ℃/min 升温至280 ℃,保持5 min); 进样量1.0 μL; 进口温度280 ℃; 分流进样,分流比10 ∶1; 载气高纯氦气,体积流量1.0 mL/min; 离子源温度200 ℃; 接口温度280 ℃; 碰撞能量70 eV; 全扫描模式; 扫描范围m/z50~650; 溶剂切除时间5 min。
2.8 数据处理与分析 参考文献 [9] 报道,通过Proteowizard、指纹图谱相似性评价软件(2004) 对所有样本谱图进行共有峰提取[10]。SIMCA 14.1 软件对所有峰进行归一化处理后进行多变量分析[主成分分析(PCA) 和正交-偏最小二乘判别分析(OPLS-DA) ]。统计多变量分析模型VIP>1 的样本为差异代谢物,对各组差异代谢物进行单因素方差分析,确定潜在生物标志物(VIP >1 且P<0.05)。根据潜在生物标志物保留时间、质荷比、二级裂解质谱图等数据,检索GC-MS 数据库、HMDB 数据库后对生物标志物进行鉴定。通过MetaboAnalyst 5.0 (https: //www.metaboanalyst.ca) 网站对生物标志物进行通路富集。
2.9 统计学分析 通过SPSS 23.0 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,组间两两比较采用t检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 肝复乐对LX-2 细胞活力的影响 如图1 所示,500 μg/mL 剂量以下肝复乐对LX-2 细胞活力无明显影响(P>0.05),1 000、2 000 μg/mL 肝复乐抑制人肝星状细胞LX-2 活性(P<0.01)。因此选择125、250、500 μg/mL 进行后续实验。

图1 肝复乐对LX-2 细胞活力的影响(±s,n=6)
3.2 肝复乐对LX-2 细胞α-SMA、COL1A1、COL4A2、TIMP1、MMP9 mRNA 表达的影响 如图2 所示,与对照组比较,模型组 LX-2 细胞α-SMA、COL1A1、COL4A2、TIMP1 mRNA 表达升高(P<0.01),MMP9 mRNA 表达降低(P<0.01); 与模型组比较,肝复乐250、500 μg/mL 组LX-2 细胞α-SMA、COL1A1、COL4A2、TIMP1 mRNA 表达降低(P<0.01),MMP9 mRNA 表达升高(P<0.01)。

图2 肝复乐对LX-2 细胞α-SMA、COL1A1、COL4A2、TIMP1、MMP9 mRNA 表达的影响(±s,n=3)
3.3 肝复乐对LX-2 细胞α-SMA、COL1A1 蛋白表达的影响 如图3 所示,与对照组比较,模型组LX-2 细胞α-SMA、COL1A1 蛋白表达升高(P<0.01); 与模型组比较,肝复乐250、500 μg/mL 组LX-2 细胞α-SMA、COL1A1 蛋白表达降低(P<0.01),表明肝复乐能抑制TGF-β1 刺激引起的LX-2 细胞细胞外基质发生及胶原蛋白沉积。如图4 所示,肝复乐并非直接结合TGF-β1 使其失活发挥抑制肝星状细胞激活作用。对照组细胞用完全培养基培养24 h,模型组细胞用TGF-β1 刺激12 h 后用完全培养基培养12 h,肝复乐组细胞用TGF-β1 刺激12 h 后加入含500 μg/mL 肝复乐的完全培养基培养12 h。在肝复乐与TGF-β1 未同时存在时,肝复乐依旧能抑制肝星状细胞活化标志α-SMA表达。
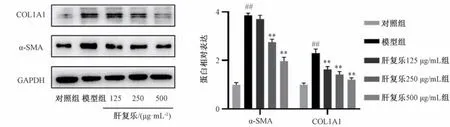
图3 肝复乐对LX-2 细胞α-SMA、COL1A1 蛋白表达的影响(±s,n=3)

图4 肝复乐与TGF-β1 未同时存在时对α-SMA 蛋白表达的影响(±s,n=3)
3.4 GC-MS 分析结果 对照组、模型组和肝复乐组(500 μg/mL) 细胞衍生化后TIC 色谱图见图5,每组8 个样本。

图5 代谢组学样本TIC 色谱图
3.5 PCA、OPLS-DA 分析 PCA 评分见图6A,由此可知,对照组样本与模型组样本之间分离明显,肝复乐组样本介于对照组与模型组之间,表明肝复乐组有向对照组转变的趋势。PCA 分析模型R2X为0.783,表示该模型拟合度较好;Q2为0.429,表示该模型预测能力一般。因此进一步使用OPLS-DA 分析,见图6B,由此可知,模型组代谢物与对照组相比具有显著差别,而肝复乐组能明显回调LX-2 细胞代谢紊乱。OPLS-DA 模型R2X为0.664,R2Y为0.908,Q2为0.841; 对OPLS-DA 模型进行200 次置换检验,结果见图6C,R2Y轴截距为0.336,Q2Y轴截距为-0.426,表明该模型质量良好,预测准确,且没有过拟合现象。根据以上分析结果,以VIP>1 筛选OPLS-DA 模型中的化合物为潜在差异代谢物。

图6 PCA、OPLS-DA 分析
3.6 肝复乐对LX-2 细胞激活后代谢产物的影响 基于OPLS-DA 模型筛选的潜在差异代谢物,进一步使用单因素方差分析(P<0.05) 进行筛选。对于TGF-β1 造成的LX-2细胞代谢异常,肝复乐对其中9 种代谢物有回调效果,分别为丙酸、丁酸、苯丙氨酸、L-苏氨酸、D-半乳糖、肌醇、甘油、油酸、D-甘油酯。其中,丙酸、丁酸、苯丙氨酸、L-苏氨酸、肌醇在造模后含量降低,D-半乳糖、甘油、油酸、D-甘油酯在造模后含量升高。统计对照组、模型组和肝复乐组中上述9 种不同差异代谢物的峰面积,每个差异代谢物的相对浓度的比较结果见图7,提示这9 种代谢物为肝复乐调节LX-2 代谢异常的潜在生物标志物。

图7 肝复乐对代谢物相对峰面积的影响
3.7 肝复乐对LX-2 细胞激活后代谢通路的影响 使用MetaboAnalyst 6.0 对以上生物标志物进行分析,并构建LX-2 的代谢通路富集图。如图8 所示,其中4 条途径符合Pathway impact>0 且-log (P) >1 条件,分别为半乳糖代谢,半乳糖代谢,甘油酯代谢,苯丙氨酸、酪氨酸和色氨酸的生物合成,苯丙氨酸代谢。

图8 MetaboAnalyst 分析的主要通路图
3.8 肝复乐主要作用代谢通路分析 建立生物标志物与代谢通路代谢示意(图9),这可能是肝复乐抑制肝星状细胞激活可能机制。

图9 肝复乐通过多重代谢途径抑制LX-2 激活路径
4 讨论
肝纤维化是指各种慢性肝病进展中肝内纤维生成与降解失衡,致使过多胶原在肝内沉积,诱因包括饮酒、非酒精性脂肪性肝、病毒性肝炎、胆汁淤积性肝病等[11]。肝星状细胞在肝纤维化中起核心作用,在多种肝损伤刺激下,由静息状态激活,促进肝纤维化形成[12]。本研究采用TGFβ1 诱导肝星状细胞系LX-2 细胞,激活标志物α-SMA mRNA 和蛋白表达,并促进胶原及关键酶COL1A1、COL4A2、TIMP1 mRNA 表达,而降低MMP9 mRNA 表达,表明LX-2 细胞纤维化模型成功[13]。α-SMA 同时也是ECM发生的标志物,在各种损伤刺激下,肝星状细胞过度激活会导致ECM 大量沉积,最终导致肝组织结构破坏和功能障碍,导致肝纤维化发生[14]。而肝复乐给药后能够明显阻止TGF-β1 诱导的LX-2 细胞的活化。
肝复乐包含党参、白术、鳖甲、沉香等21 味中药,具有清热解毒、健脾理气、活血化瘀等多方面作用[15]。为进一步研究肝复乐对肝星状细胞代谢调控作用。本研究采用GC-MS 进行代谢组学分析,筛选得到丙酸、丁酸、苯丙氨酸、L-苏氨酸、D-半乳糖、肌醇、甘油、油酸、D-甘油酯9个潜在生物标志物,主要涉及半乳糖代谢、甘油酯代谢、苯丙氨酸、酪氨酸和色氨酸的生物合成、苯丙氨酸代谢4条代谢通路。半乳糖代谢异常可能影响正常渗透压,导致细胞肿胀、功能障碍、代谢紊乱[16],并通过氧化反应生成醛糖和过氧化氢,并生成氧自由基,导致细胞氧化损伤[17]。与模型组比较,肝复乐组D-半乳糖含量降低,肌醇含量升高,起到保护细胞的作用。苯丙氨酸与能量代谢关系密切,可以转化为延胡索酸,异亮氨酸进一步可以转化为琥珀酰辅酶,从而参与三羧酸循环[18]。本研究发现,苏氨酸、苯丙氨酸在模型组中含量均降低,给药后得到明显回调,表明肝复乐能有效干预TGF-β1 导致的LX-2 细胞氨基酸代谢紊乱,提高细胞对氨基酸的摄入和利用。脂质代谢紊乱与肝星状细胞激活密切相关,异常增加的脂质通过影响脂质代谢平衡和增强脂质过氧化反应促进肝纤维化发生[19]。与模型组比较,肝复乐给药可以有效降低甘油、油酸、D-甘油酯含量。
综上所述,肝复乐可抑制TGF-β1 诱导的肝星状细胞活化和纤维化,其机制可能与调节半乳糖代谢、甘油酯代谢、苯丙氨酸、酪氨酸和色氨酸的生物合成、苯丙氨酸代谢多条代谢通路有关。本研究进一步阐明了肝复乐胶囊在肝纤维化中的保护作用,为其在预防或逆转肝纤维化应用中奠定坚实基础。

