鸡血藤总黄酮对大鼠肾缺血再灌注损伤氧化应激及炎症反应的影响
赖 雯,范路梅,徐祖清,于 晴,靳文鹏,丁兆义
(深圳市龙华区中心医院重症医学科,广东 深圳 518110)
肾缺血再灌注损伤(ischemia reperfusion injury,IRI)是指肾组织缺血并重新获取血流灌注后使原有损伤进一步加重的现象,在肾移植排斥与急性肾衰竭的发病中具有重要意义,并与多种慢性肾脏疾病的进展关系密切,但目前临床尚缺少有效缓解肾IRI 的策略[1-2]。鸡血藤具有保护肝脏损伤、降血糖、抗病毒、抗肿瘤、促进造血功能等多种药理作用,黄酮类化合物是鸡血藤的重要功效成分之一[3-4]。研究发现,鸡血藤总黄酮能减轻脑缺血模型大鼠脑水肿,降低缺血区面积及丙二醛(malonaldehyde,MDA)水平,并提高超氧化物歧化酶 (superoxide dismutase,SOD) 等抗氧化物酶活性[5],但其对肾缺血或肾IRI 模型是否具有保护作用未见报道。在乙醇所致的小鼠肝损伤模型中,鸡血藤总黄酮可以通过降低氧化应激水平发挥抗肝损伤作用[6]; 在大鼠慢性不可预知应激诱导的抑郁模型中,鸡血藤总黄酮能通过抑制炎症反应减轻抑郁症状[7]。由此推测鸡血藤总黄酮对肾IRI 具有潜在的防治效果[8]。本研究通过建立大鼠肾IRI 模型,探讨鸡血藤总黄酮保护大鼠肾IRI 的作用及其与氧化应激、炎症反应的关联性,为其用于肾IRI 的防治提供实验依据。
1 材料
1.1 药物与试剂 鸡血藤(产地云南) 购自药材市场,经深圳市龙华区中心医院药学部张志威副主任药师鉴定为豆科植物密花豆SatholobussuberectusDunn 的藤茎,经50%乙醇提取、分离,通过聚酰胺树脂精制,最终获得鸡血藤总黄酮 (质量分数≥85.0%)。血尿素氮 (blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr) 检测试剂盒(批号ml076479、ml059735,上海酶联生物科技有限公司); MDA、过氧化氢酶(catalase,CAT)、SOD 检测试剂盒(批号TW30294、TW30805、TW30284,上海通蔚实业有限公司); 肿瘤坏死因子-α (tumor necrosis factor α,TNF-α)、白细胞介素-6 (interleukin 6,IL-6)、IL-10 检测试剂盒(批号20210726、20211103、20211024,武汉博士德生物工程有限公司); 细胞核/细胞浆蛋白抽提试剂盒(批号20196ES60,上海翊圣生物技术有限公司); 兔抗鼠核因子E2 相关因子2 (nuclear factor E2 related factor 2,Nrf2)、血红素加氧酶-1 (heme oxygenase 1,HO-1)、核因子κB p65 (nuclear factor κB p65,NF-κB p65)、β-肌动蛋白(β-actin)、组蛋白H3 (Histone H3) 抗体 (批号sc-722、sc-390991、sc-8008、sc-8432、sc-517385,美国Santa Cruz 公司); 辣根酶标记的羊抗兔IgG 抗体(批号211217,北京索莱宝科技有限公司)。
1.2 动物 SPF 级雄性SD 大鼠50 只,体质量200~220 g,购自上海南方模式生物科技股份有限公司[实验动物生产许可证号SCXK (沪) 2019-0002],饲养于广州吉妮欧生物科技有限公司[实验动物使用许可证号SYXK (粤) 2022-0298],自由饮水与摄食,模拟昼夜环境,每12 h 更换1次光照条件,保持室温25 ℃。动物处死后各项指标检测工作在本院中心实验室进行。本研究严格按照3R 原则给予实验动物人道关怀,研究方案经本院实验动物伦理委员会审批通过(伦理号GDY2102490)。
1.3 仪器 RM2016 型切片机(德国Leica 公司); DYS40型显微镜(上海点应光学仪器有限公司); MR-96A 型酶标仪(南京贝登医疗股份有限公司); XCell SureLock Mini-Cell 型蛋白电泳系统(美国Thermo Fisher Scientific 公司)。
2 方法
2.1 分组及给药 SD 大鼠适应性饲养3 d,根据体质量分为假手术组、模型组及鸡血藤总黄酮低、中、高剂量组(40、80、160 mg/kg),每组10 只,鸡血藤总黄酮给药剂量参考文献[5] 报道并结合预实验结果; 假手术组及模型组大鼠灌胃给予蒸馏水,每天1 次,灌胃体积为20 mL/kg,共给药7 d。
2.2 肾IRI 模型复制 通过无创动脉夹夹闭双侧肾蒂法复制肾IRI 模型[9]。末次给药1 h 后,各组大鼠腹腔注射10%水合氯醛(3 mL/kg) 麻醉,用手术剪刀在大鼠腹正中处剪2 cm 左右切口,暴露双侧肾蒂后,利用无创动脉夹夹闭阻断血流供应0.5 h,松开动脉夹使血流供应恢复,完成血流的再灌注,并将切口缝合; 假手术组无动脉夹夹闭操作,其余操作相同。
2.3 BUN 及Scr 水平检测 术后24 h,腹主动脉采血,离心分离血清,在-80 ℃冰箱中保存备用。分别采用尿素酶-谷氨酸脱氢酶法、肌氨酸氧化酶法检测大鼠血清BUN 及Scr 水平。
2.4 肾组织病理变化观察 取各组大鼠部分肾组织,依次经固定、包埋、切片及苏木精伊红 (hematoxylin eosin,HE) 染色后,观察肾组织病理变化。
2.5 氧化应激及炎症反应指标检测 取于-80 ℃冰箱中冻存的血清及肾组织(肾组织需进行匀浆后分离取上清液),按照试剂盒说明书,采用酶联免疫吸附法检测各组大鼠血清及肾组织MDA 水平、CAT、SOD 活性等氧化应激指标和TNF-α、IL-6、IL-10 水平等炎症反应指标。
2.6 Western blot 法检测肾组织Nrf2、HO-1、NF-κB p65 蛋白表达 各组大鼠肾组织在冰上用高速匀浆器进行匀浆,按照试剂盒说明书分别提取总蛋白、核蛋白及浆蛋白,取等量蛋白与上样缓冲液混合后,煮沸变性,进行聚丙烯酰胺凝胶电泳,然后转移至硝酸纤维素膜,用脱脂牛奶封闭2 h,TBST 缓冲液漂洗,分别与Nrf2 (1 ∶500)、HO-1(1 ∶500)、NF-κB p65 (1 ∶500)、β-actin (1 ∶1 000)、Histone H3 (1 ∶1 000) 抗体在4 ℃下孵育过夜,TBST 缓冲液漂洗,加入IgG 二抗(1 ∶2 000) 在室温下继续孵育2 h,TBST 缓冲液漂洗,在暗室中用化学发光法显影,拍照后用Image J 软件分析条带灰度值。
2.7 统计学分析 通过SPSS 22.0 软件进行处理,数据以(±s) 表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 鸡血藤总黄酮对肾IRI 大鼠血清BUN 及Scr 水平的影响 如表1 所示,与假手术组比较,模型组大鼠血清BUN及Scr 水平升高(P<0.01); 与模型组比较,鸡血藤总黄酮各剂量组大鼠血清BUN 及Scr 水平降低(P<0.05,P<0.01),表明鸡血藤总黄酮可以改善肾IRI 大鼠的肾脏功能。
表1 鸡血藤总黄酮对肾IRI 大鼠血清BUN 及Scr 水平的影响(±s,n=10)

表1 鸡血藤总黄酮对肾IRI 大鼠血清BUN 及Scr 水平的影响(±s,n=10)
注: 与假手术组比较,∗∗P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别剂量/(mg·kg-1)BUN/(μmol·L-1)Scr/(μmol·L-1)假手术组—15.44±2.3692.05±12.74模型组—69.52±8.80∗∗316.29±57.21∗∗鸡血藤总黄酮低剂量组4051.30±6.25##265.42±34.38#鸡血藤总黄酮中剂量组8038.83±5.49##228.61±29.33##鸡血藤总黄酮高剂量组16030.97±4.02##173.18±25.47##
3.2 鸡血藤总黄酮对肾IRI 大鼠肾组织病理变化的影响 假手术组大鼠肾组织形态正常,无变性及坏死情况,肾小管上皮细胞形态饱满,肾小管管腔无扩张; 模型组大鼠肾组织出现严重损伤,肾小管上皮细胞空泡变性、肿胀及脱落,肾小管管腔扩张,炎症细胞浸润明显,肾间质充血、水肿; 鸡血藤总黄酮各剂量组大鼠肾组织损伤程度减轻,肾小管上皮细胞空泡变性、肿胀缓解,肾小管管腔扩张情况有所改善,炎症细胞浸润及肾间质充血、水肿情况减少,其中鸡血藤总黄酮高剂量组作用最为显著,见图1。
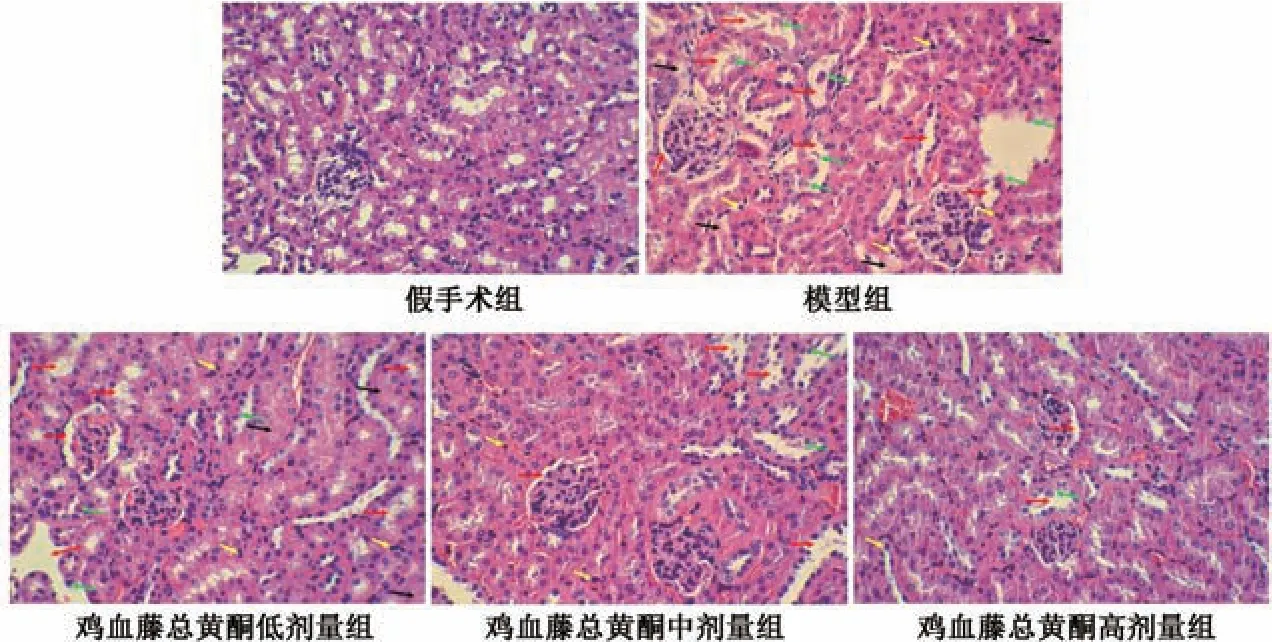
图1 各组大鼠肾组织病理变化(HE 染色,×200)
3.3 鸡血藤总黄酮对肾IRI 大鼠血清MDA 水平及CAT、SOD 活性的影响 如表2 所示,与假手术组比较,模型组大鼠血清MDA 水平升高(P<0.01),CAT、SOD 活性降低(P<0.01); 与模型组比较,鸡血藤总黄酮各剂量组大鼠血清MDA 水平降低(P<0.05,P<0.01),CAT、SOD 活性升高(P<0.01)。
表2 鸡血藤总黄酮对肾IRI 大鼠血清MDA 水平及CAT、SOD 活性的影响(±s,n=10)

表2 鸡血藤总黄酮对肾IRI 大鼠血清MDA 水平及CAT、SOD 活性的影响(±s,n=10)
注: 与假手术组比较,∗∗P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别剂量/(mg·kg-1)MDA/(nmol·mL-1)CAT/(U·mL-1)SOD/(U·mL-1)假手术组—3.61±0.5896.37±14.82184.09±23.95模型组—6.52±0.84∗∗39.80±5.77∗∗97.85±11.06∗∗鸡血藤总黄酮低剂量组405.69±0.71#55.65±7.36##114.32±14.47##鸡血藤总黄酮中剂量组804.76±0.57##76.11±9.23##156.13±19.82##鸡血藤总黄酮高剂量组1604.20±0.69##88.46±10.31##168.72±17.54##
3.4 鸡血藤总黄酮对肾IRI 大鼠肾组织MDA 水平及CAT、SOD 活性的影响 如表3 所示,与假手术组比较,模型组大鼠肾组织MDA 水平升高(P<0.01),CAT、SOD 活性降低(P<0.01); 与模型组比较,鸡血藤总黄酮各剂量组大鼠肾组织MDA 水平降低(P<0.01),CAT、SOD 活性升高(P<0.01)。
表3 鸡血藤总黄酮对肾IRI 大鼠肾组织MDA 水平及CAT、SOD 活性的影响(±s,n=10)

表3 鸡血藤总黄酮对肾IRI 大鼠肾组织MDA 水平及CAT、SOD 活性的影响(±s,n=10)
注: 与假手术组比较,∗∗P<0.01; 与模型组比较,##P<0.01。
组别剂量/(mg·kg-1)MDA/(nmol·mg-1)CAT/(U·mg-1)SOD/(U·mg-1)假手术组—4.80±0.63187.75±23.95343.51±45.69模型组—9.69±1.26∗∗87.23±10.53∗∗156.60±19.05∗∗鸡血藤总黄酮低剂量组407.02±0.95##128.42±15.40##180.12±21.81##鸡血藤总黄酮中剂量组806.15±0.82##159.33±18.79##221.29±25.37##鸡血藤总黄酮高剂量组1604.72±0.54##170.98±21.76##269.38±30.23##
3.5 鸡血藤总黄酮对肾IRI 大鼠血清TNF-α、IL-6 及IL-10水平的影响 如表4 所示,与假手术组比较,模型组大鼠血清TNF-α、IL-6 水平升高(P<0.01),IL-10 水平降低(P<0.01); 与模型组比较,鸡血藤总黄酮各剂量组大鼠血清TNF-α、IL-6 水平降低(P<0.05,P<0.01),IL-10 水平升高(P<0.05,P<0.01)。
表4 鸡血藤总黄酮对肾IRI 大鼠血清TNF-α、IL-6 及IL-10 水平的影响(±s,n=10)

表4 鸡血藤总黄酮对肾IRI 大鼠血清TNF-α、IL-6 及IL-10 水平的影响(±s,n=10)
注: 与假手术组比较,∗∗P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别剂量/(mg·kg-1)TNF-α/(pg·mL-1)IL-6/(pg·mL-1)IL-10/(pg·mL-1)假手术组—142.08±17.8172.36±9.78103.78±12.71模型组—395.60±44.24∗∗203.21±25.29∗∗61.51±8.28∗∗鸡血藤总黄酮低剂量组40276.45±30.15##170.12±22.26#69.11±9.20#鸡血藤总黄酮中剂量组80243.26±28.46##137.29±15.87##88.29±12.64##鸡血藤总黄酮高剂量组160189.73±21.69##114.77±13.12##95.84±10.37##
3.6 鸡血藤总黄酮对肾IRI 大鼠肾组织TNF-α、IL-6 及IL-10 水平的影响 如表5 所示,与假手术组比较,模型组大鼠肾组织TNF-α、IL-6 水平升高(P<0.01),IL-10 水平降低(P<0.01); 与模型组比较,鸡血藤总黄酮各剂量组大鼠肾组织TNF-α、IL-6 水平降低(P<0.01),IL-10 水平升高(P<0.05,P<0.01)。
表5 鸡血藤总黄酮对肾IRI 大鼠肾组织TNF-α、IL-6 及IL-10 水平的影响(±s,n=10)

表5 鸡血藤总黄酮对肾IRI 大鼠肾组织TNF-α、IL-6 及IL-10 水平的影响(±s,n=10)
注: 与假手术组比较,∗∗P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别剂量/(mg·kg-1)TNF-α/(pg·g-1)IL-6/(pg·g-1)IL-10/(pg·g-1)假手术组—1674.01±195.17561.46±65.43868.61±109.36模型组—3785.40±424.95∗∗1627.58±188.26∗∗543.09±62.40∗∗鸡血藤总黄酮低剂量组402911.29±314.53##1383.84±152.76##612.47±71.74#鸡血藤总黄酮中剂量组802489.27±307.66##1142.11±148.08##649.85±86.84##鸡血藤总黄酮高剂量组1602056.45±226.32##950.23±123.41##727.93±75.09##
3.7 鸡血藤总黄酮对肾IRI 大鼠肾组织Nrf2 及HO-1 蛋白表达的影响 与假手术组比较,模型组大鼠肾组织Nrf2 及HO-1 蛋白表达降低(P<0.01); 与模型组比较,鸡血藤总黄酮各剂量组大鼠肾组织Nrf2 蛋白表达升高(P<0.05,P<0.01),中、高剂量组HO-1 蛋白表达升高(P<0.05,P<0.01),低剂量组HO-1 蛋白表达无明显变化(P>0.05),见图2、表6。
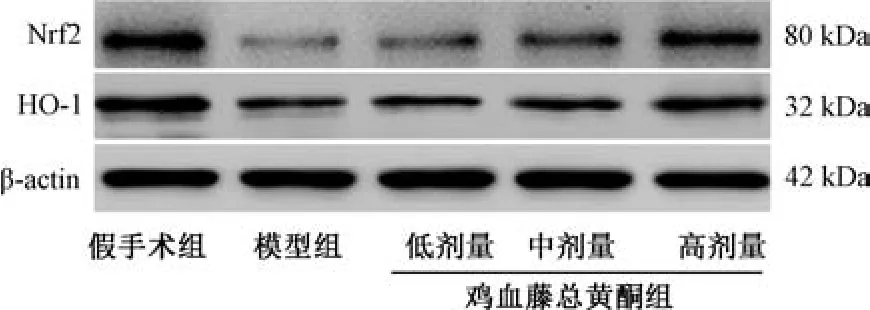
图2 各组大鼠肾组织Nrf2 及HO-1 蛋白条带图
表6 鸡血藤总黄酮对肾IRI 大鼠肾组织Nrf2 及HO-1 蛋白表达的影响(±s,n=3)

表6 鸡血藤总黄酮对肾IRI 大鼠肾组织Nrf2 及HO-1 蛋白表达的影响(±s,n=3)
注: 与假手术组比较,∗∗P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别剂量/(mg·kg-1)Nrf2/β-actinHO-1/β-actin假手术组—0.73±0.100.94±0.12模型组—0.11±0.02∗∗0.26±0.04∗∗鸡血藤总黄酮低剂量组400.20±0.04#0.28±0.03鸡血藤总黄酮中剂量组800.37±0.05##0.39±0.06#鸡血藤总黄酮高剂量组1600.52±0.07##0.67±0.08##
3.8 鸡血藤总黄酮对肾IRI 大鼠肾组织细胞核与细胞浆中NF-κB p65 蛋白表达的影响 与假手术组比较,模型组大鼠肾组织细胞核NF-κB p65 蛋白表达升高(P<0.01),细胞浆NF-κB p65 蛋白表达降低(P<0.01); 与模型组比较,鸡血藤总黄酮各剂量组大鼠肾组织细胞核NF-κB p65 蛋白表达降低(P<0.01),细胞浆NF-κB p65 蛋白表达升高(P<0.05,P<0.01),见图3、表7。

图3 各组大鼠肾组织NF-κB p65 蛋白条带图
表7 鸡血藤总黄酮对肾IRI 大鼠肾组织细胞核与细胞浆中NF-κB p65 蛋白表达的影响(±s,n=3)

表7 鸡血藤总黄酮对肾IRI 大鼠肾组织细胞核与细胞浆中NF-κB p65 蛋白表达的影响(±s,n=3)
注: 与假手术组比较,∗∗P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别剂量/(mg·kg-1)细胞核NF-κB p65/Histone H3细胞浆NF-κB p65/β-actin假手术组—0.32±0.040.89±0.11模型组—0.93±0.10∗∗0.15±0.02∗∗鸡血藤总黄酮低剂量组400.48±0.06##0.23±0.03#鸡血藤总黄酮中剂量组800.35±0.05##0.31±0.04##鸡血藤总黄酮高剂量组1600.26±0.03##0.38±0.04##
4 讨论
氧化应激被认为是导致肾IRI 的主要发病机制之一。缺血再灌注损伤后,肾组织产生大量氧自由基,使氧化应激水平升高,引起肾组织功能障碍、炎性反应、细胞萎缩甚至凋亡[10]。在肾IRI 发生过程中,MDA 水平增加,CAT、SOD 活性降低,氧化应激水平升高; 三七茎叶皂苷、罗格列酮等药物对大鼠肾IRI 的保护作用均与降低MDA 水平,增加CAT、SOD 活性,进而抑制氧化应激反应有关[11-12]。鸡血藤总黄酮也可以抑制心肌组织MDA 水平的升高和SOD活性的降低,在大鼠心肌缺血模型中同样表现出了抗氧化活性[13]。Nrf2/HO-1 信号通路在机体调控氧化应激反应中占据关键位置,对于保护肾IRI 具有重要意义[14]。Nrf2 是作用最强的抗氧化应激调控因子,能够促进抗氧化酶HO-1的转录和表达,减轻氧化应激水平,改善肾IRI[15]。研究发现,刺五加注射液能够激活肾IRI 大鼠Nrf2/HO-1 信号通路,降低氧化应激水平,减轻肾脏功能损伤[16]。积雪草苷同样具有保护肾IRI 作用,其机制与激活Nrf2/HO-1 信号通路、增加SOD 活性、降低MDA 水平等有关[17]。本研究同样发现,鸡血藤总黄酮可以降低模型大鼠血清及肾组织MDA 水平,增加CAT、SOD 活性,同时也可以升高模型大鼠肾组织Nrf2 及HO-1 蛋白表达,表明其可以通过活化Nrf2/HO-1 信号通路发挥抗氧化应激作用。
炎症反应是肾IRI 发生的重要因素,可以引起一系列的病理级联反应,抑制炎症反应是避免或减轻肾IRI 的关键[18]。地奥司明可减少肾IRI 病理过程中促炎因子TNF-α、IL-6 的释放,增加抗炎因子IL-10 的释放,抑制炎症反应,减轻肾IRI,发挥保护肾脏功能的作用[19]。姜黄素预处理也能减轻肾IRI 大鼠肾组织损伤,并改善肾脏功能,该作用与提高肾组织中IL-10 水平及降低TNF-α、IL-6 水平有关[20]。当肾IRI 发生时,肾组织氧化应激水平升高,NFκB 被活化发生核转位,使下游的TNF-α、IL-6 等促炎因子表达增加,进一步加重肾缺血再灌注部位的损伤[21]。研究发现,抑制NF-κB 活化,阻止NF-κB p65 的核转位,有助于维持肾组织正常形态,减轻肾IRI 的炎症反应,进而发挥肾脏保护作用[22]。既往研究证实,鸡血藤总黄酮在体内外均具有较好的抗炎作用[23]。本研究同样发现,鸡血藤总黄酮可以降低模型大鼠血清及肾组织中TNF-α、IL-6 水平,升高IL-10 水平,具有抗炎作用; 进一步研究发现,鸡血藤总黄酮预处理后,肾组织细胞核NF-κB p65 蛋白表达降低,细胞浆NF-κB p65 蛋白表达增加,鸡血藤总黄酮具有阻止NF-κB p65 核转位的作用。
综上所述,鸡血藤总黄酮可以改善肾缺血再灌注损伤大鼠的肾脏功能,减轻肾组织病理变化,具有保护大鼠肾缺血再灌注损伤作用,该作用与活化Nrf2/HO-1 信号通路,阻止NF-κB p65 核转位,进而降低氧化应激水平及抑制炎症反应有关。

