日常饮食中添加摄食甜菜碱对APP/PS1 转基因小鼠的影响
张丽阳,孙 军,陈 笛,张在行
(南阳市中心医院神经内科,河南 南阳 473000)
甜菜碱是一种吡啶衍生物类含氮色素,广泛存在于多种石竹目科植物的花和果实中,目前已实现人工化学合成[1]。甜菜碱主要被用为食品添加剂、清洁类护肤品、药品和保健品[2]。人体内甜菜碱的主要来源为胆碱前体代谢和饮食[3]。在哺乳动物中,甜菜碱可作为甲基供体将同型半胱氨酸(Hcy) 转化为蛋氨酸[4]。Hcy 是一种神经毒性氨基酸,是多种神经退行性疾病的独立危险因素。已有研究表明,血清中高浓度Hcy 可加速β-淀粉样蛋白(Aβ)沉积并增加阿尔茨海默病(AD) 的发病率[5]。此前已有研究显示,甜菜碱可减轻Hcy 引起的大鼠AD 样病理改变和记忆功能障碍[6]。在3×Tg AD 模型小鼠中,同样发现持续摄入甜菜碱可改善认知功能障碍[7]。最近也有一项研究表明,摄食甜菜碱可改善AD 患者的认知功能障碍[8]。而摄食甜菜碱在AD 的海马神经发生和突触功能中的作用并不清楚,因此,本研究利用APP/PS1 (APPswe和PSEN1dE9) 双转基因AD 模型小鼠研究甜菜碱对记忆障碍、AD 病理症状、海马神经元再生和突触可塑性的影响。
1 材料
1.1 动物 30 只6 月龄SPF 级雄性APP/PS1 双转基因小鼠、15 只6 月龄SPF 级雄性野生型C57BL/6J 小鼠购自苏州赛业模式生物研究中心有限公司,实验动物生产许可证号SCXK (苏) 2020-0006。饲养于南阳理工学院SPF 级动物饲养平台,实验动物使用许可证号SYXK (豫) 2020-0013,12 h/12 h 光暗循环,温度(24±1)℃,相对湿度(55±5)%,小鼠自由进食饮水,适应性饲养1 周。本研究获得南阳市中心医院伦理委员会审批(伦理号20200434)。
1.2 试剂 甜菜碱(纯度>98%,货号B802317)、曲拉通(Triton) X-100 (货号 T6328)、RIPA 裂解液 (货号R874809)、4%多聚甲醛固定液(货号P885233) 购自上海麦克林生化科技有限公司; OCT 冷冻切片包埋剂(货号4583) 购自上海索宝生物科技有限公司; EdU 试剂(货号E6032)、WonderOrangeTM蛋白定量试剂盒(货号W6006)、超敏化学发光检测试剂盒(货号S6009)、YF ® 488 羊抗小鼠IgG (H+L) (货号Y6104)、YF ®647 羊抗小鼠或兔IgG (H+L) (货号Y6108、Y6109)、抗荧光淬灭固化剂(货号A4083) 购自苏州宇恒生物科技有限公司; AAV-GFP(货号V1-001) 购自广州派洛摩尔生物技术有限公司; Aβ抗体(货号sc-28365)、双皮质素(DCX) 抗体(货号sc-271390)、巢蛋白(Nestin) 抗体(货号sc-23927) 购自美国Santa Cruz 公司; 神经元核抗原(NeuN) 抗体(货号BS6808)、蛋白突触后致密蛋白-95 (PSD-95) 抗体(货号BS2978)、突触小泡蛋白(SYN) 抗体(货号BS1345)、神经元结构相关蛋白微管相关蛋白(MAP-2) 抗体(货号MB0078) 购自南京巴傲得生物科技有限公司; 兔源β-actin抗体(货号WL01372)、HRP 标记山羊抗兔IgG (H +L)(货号WLA023) 购自沈阳万类生物科技有限公司。
1.3 仪器 YH-WM-M/R 型Morris 水迷宫仪(武汉一鸿科技有限公司); EthoVision XT 型小动物运动轨迹跟踪监测系统(荷兰Noldus Information Technology 公司); VT1200S型全自动振动切片机(德国Leica 公司); Axio Scope A1 型荧光显微镜(德国Carl Zeiss 公司); PT-3502G 型多功能酶标仪(北京普天新桥技术有限公司); Tanon V8 型Western blot 转印系统、Tanon 1600 型全自动凝胶成像系统(上海天能科技有限公司); SZ810 型体视显微镜(重庆奥特光学仪器有限责任公司); Axon 膜片钳系统(美国Molecular Devices 公司)。
2 方法
2.1 分组与干预 30 只APP/PS1 小鼠随机分为正常饮食组和甜菜碱补充饮食组,每组15 只,其中正常饮食组APP/PS1 小鼠给予正常饮食(标准动物颗粒饲料),甜菜碱补充饮食组APP/PS1 小鼠给予甜菜碱补充饮食(标准动物颗粒饲料中添加5 g/kg 甜菜碱)。同时纳入15 只野生型C57BL/6J 小鼠给予正常饮食,作为空白对照组。上述3 组小鼠均经上述方案饲养3 个月。
2.2 Morris 水迷宫实验 泳池随机分为4 个象限,水温25 ℃,站台随机置于一个象限中,并低于水面1 cm。实验开始前2 d,每天训练小鼠在随机不同的象限入水至爬上站台,以适应实验环境; 随后5 d,将小鼠放置在站台以外的一个象限入水,用小动物运动轨迹跟踪监测系统记录小鼠找到站台所用时间(逃避潜伏期) 和计算平均游泳速度。第6 天,将站台下沉至泳池底部,从站台以外的一个象限的同一个入水点入水,小动物运动轨迹跟踪监测系统记录小鼠穿过原站台位置的次数和寻找原站台位置的时间。
2.3 脑立体定位注射AAV-GFP 并于荧光显微镜下观察棘突形态 每组选取5 只小鼠,麻醉后,置于小鼠脑立体定位注射仪上,并将100 nL AAV-GFP 注入小鼠CA1 区。4 d后,深度麻醉小鼠,断颈后快速取出完整脑组织,用体式显微镜在冰上快速分离出海马,4%多聚甲醛固定过夜,第2 天在4 ℃下分别用20%、30% 蔗糖依次脱水过夜,OCT包埋,并用全自动振动切片机连续切成6 μm 厚切片,在荧光显微镜下观察CA1 区GFP 标记神经元的棘突,通过Image J 软件测量棘突的密度。
2.4 免疫荧光法检测Aβ、DCX、Nestin 阳性表达 选取5只小鼠,麻醉后按“2.3” 项下方法分离出海马和皮质,并制作6 μm 厚冰冻脑片。分别将海马或皮质切片室温风干,PBS 浸泡10 min,风干,用0.3% Trition X-100 处理3 min,PBS 冲洗2 次,10%山羊血清在37 ℃下封闭1 h。分别加入Aβ (1 ∶1 000)、DCX (1 ∶1 000)、Nestin (1 ∶500) 一抗室温孵育1 h 后4 ℃过夜,第2 天洗涤后,加入YF®488 羊抗小鼠IgG (H+L)、YF ® 647 羊抗小鼠IgG(H+L) 荧光二抗(1 ∶500),室温孵育1 h,PBS 洗涤后,DAPI 染色5 min,抗荧光淬灭固化剂封片,荧光显微镜下随机选取3 个视野,通过Image J 软件分析阳性信号。
2.5 电生理记录长时程增强(LTP) 效应 取400 μm 厚的海马区脑组织切片,用人工脑脊液灌流,并在显微镜下将刺激电极置于CA3 区锥体层Schaffer 侧枝,记录电极置于CA1 区放射层。用单个电脉冲(100 Hz) 刺激1 s,共3次,每次间隔5 min,观察兴奋性突触后电位(fEPSP),待fEPSP 稳定后,取50%最大fEPSP 的刺激作为高频条件刺激20 min,诱导出LTP。用Clampex 9.0 采集数据,数据以fEPSP 的斜率表示,并对数据进行分析。
2.6 NeuN 和EdU 双标荧光染色法检测NeuN 阳性表达 取5 只小鼠给予腹腔注射50 mg/kg EdU,继续饲养4 d。按“2.3” 项下方法制作海马切片并进行NeuN (1 ∶1 000) 免疫荧光染色。切片分别加入YF ® 647 羊抗兔IgG (H+L)荧光二抗(1 ∶500) 和YF ® 488 标记的EdU 检测工作液并室温孵育1 h,PBS 洗涤后,抗荧光淬灭固化剂封片,荧光显微镜下随机选取3 个视野,通过Image J 软件分析阳性信号。
2.7 Western blot 法检测海马组织PSD-95、SYN、MAP-2蛋白表达 用RIPA 裂解液裂解海马组织,取蛋白并定量。取等量蛋白电泳、转膜。封闭膜上非特异性抗原后加入PSD-95 (1 ∶ 1 000)、SYN (1 ∶ 1 500)、MAP-2 (1 ∶3 000)、β-actin (1 ∶6 000) 一抗37 ℃下孵育1.5 h,洗膜后,室温加入HRP 标记山羊抗兔IgG (H+L) 二抗37 ℃下孵育45 min,洗膜后,通过Tanon 1600 型全自动凝胶成像系统用超敏化学发光检测试剂盒成像,以β-actin 为内参,用自带软件分析目的蛋白相对表达。
2.8 统计学分析 通过SPSS 22.0 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,组间两两比较采用事后多重分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 甜菜碱对APP/PS1 小鼠记忆行为的影响 与空白对照组比较,正常饮食组APP/PS1 小鼠逃避潜伏期延长(P<0.01); 与正常饮食组比较,甜菜碱补充饮食组APP/PS1小鼠避潜伏期缩短(P<0.01),平均游泳速率无明显变化(P>0.05)。站台移除后,与空白对照组比较,正常饮食组APP/PS1 小鼠探索隐藏站台时间缩短(P<0.01),穿越站台次数减少(P<0.01); 与正常饮食组比较,甜菜碱补充饮食组APP/PS1 小鼠探索隐藏站台时间延长(P<0.01),穿越站台次数增加(P<0.01),见图1。

图1 甜菜碱对APP/PS1 小鼠记忆行为的影响(±s,n=15)
3.2 甜菜碱对APP/PS1 小鼠海马和皮质中Aβ 斑块沉积的影响 与空白对照组比较,正常饮食组APP/PS1 小鼠海马和皮质中Aβ 斑块沉积均增多(P<0.01); 与正常饮食组比较,甜菜碱补充饮食组APP/PS1 小鼠海马和皮质中Aβ斑块沉积均减少(P<0.01),见图2。
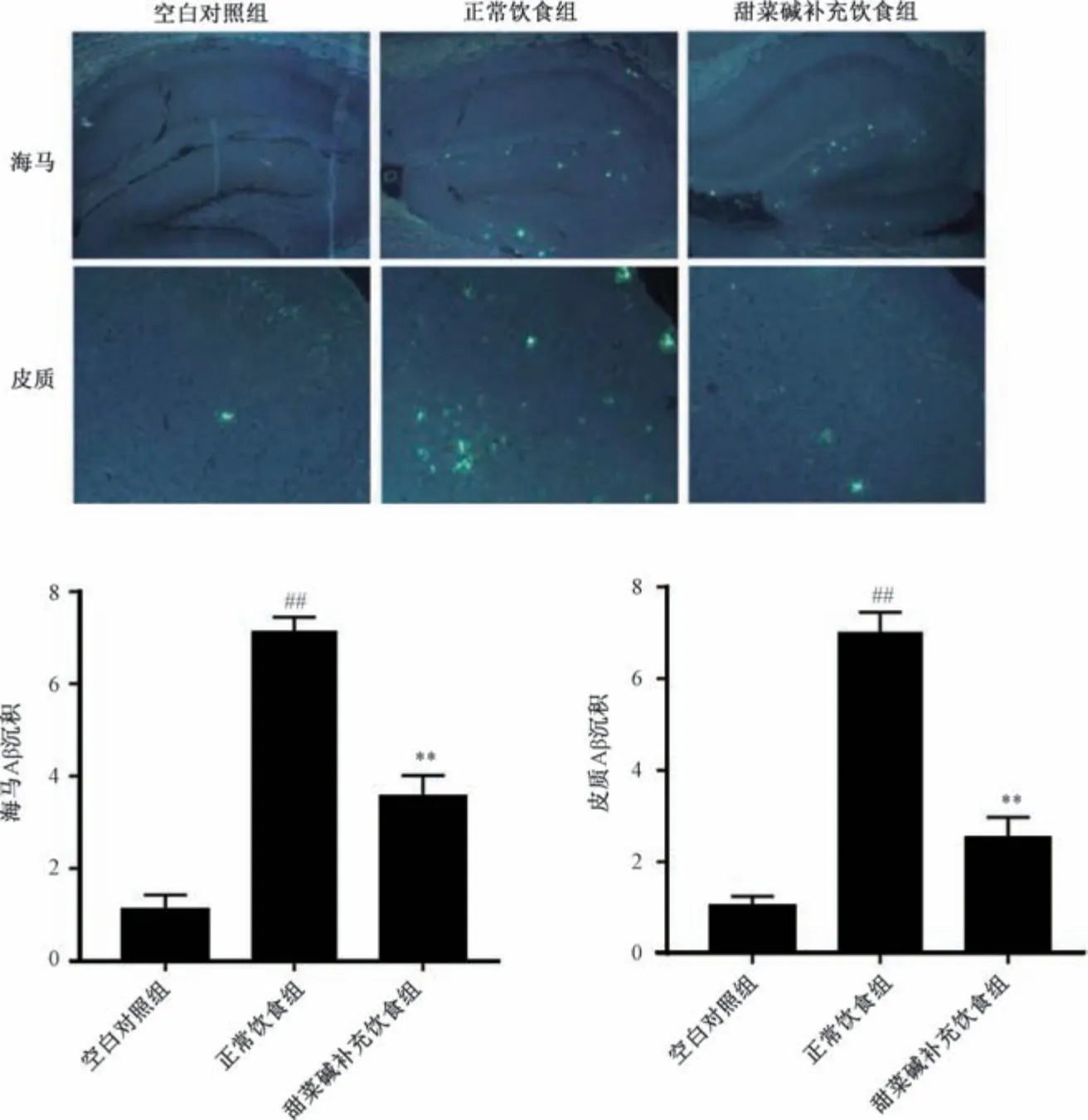
图2 甜菜碱对APP/PS1 小鼠海马和皮质中Aβ 斑块沉积的影响(免疫荧光,×200,±s,n=5)
3.3 甜菜碱对APP/PS1 小鼠海马神经再生的影响 与空白对照组比较,正常饮食组APP/PS1 小鼠海马齿状回(DG)、海马齿状回颗粒下区(SGZ) 中Nestin 阳性细胞数、DCX 阳性细胞数以及海马中EdU 阳性神经元的数量降低 (P<0.01); 与正常饮食组比较,甜菜碱补充饮食组APP/PS1小鼠DG 和SGZ 中Nestin 阳性细胞数、DCX 阳性细胞数以及海马中EdU 阳性神经元的数量增加(P<0.01),见图3。

图3 甜菜碱对APP/PS1 小鼠海马神经再生的影响(±s,n=5)
3.4 甜菜碱对APP/PS1 小鼠海马神经元突触可塑性的影响 与空白对照组比较,正常饮食组APP/PS1 小鼠海马CA1 区神经元的棘突密度降低(P<0.01),突触后诱发fEPSP 幅值减小,斜率降低 (P<0.01),海马PSD-95、SYN、MAP-2 蛋白表达降低(P<0.01); 与正常饮食组比较,甜菜碱补充饮食组APP/PS1 小鼠海马CA1 区神经元的棘突密度升高(P<0.01),突触后诱发fEPSP 幅值增大,斜率增高(P<0.01),海马PSD-95、SYN、MAP-2 蛋白表达升高(P<0.01),见图4。
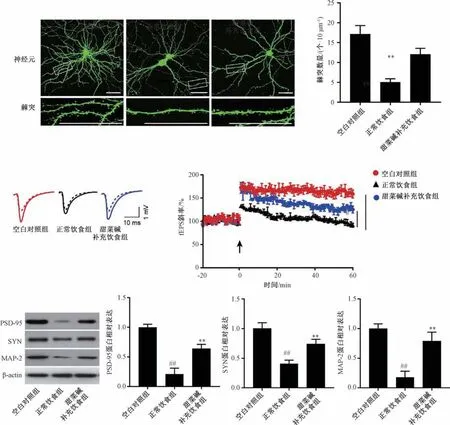
图4 甜菜碱对APP/PS1 小鼠海马神经元突触可塑性的影响(±s,n=5)
4 讨论
AD 是发生于老年群体的原发性神经退行性疾病。我国有超1 000 万例AD 患者,且随着老龄化加剧,AD 的发病率不断上升,预计到2050 年可达到2 800 万[9]。AD 的病理机制非常复杂,迄今仍不清楚,还未找到有效的治疗方案。研究表明饮食因素与AD 的发生有关[10],例如地中海饮食可降低54%的AD 发生率并降低Aβ 沉积[11]。这些结果突出了饮食干预可能是降低AD 发病率和减缓AD 进展的途径之一。甜菜碱一直被作为食品添加剂或增色剂使用,无毒副作用,且已有研究报道富含牛磺酸、半胱氨酸、叶酸、甜菜碱的饮食能降低AD 的潜在发病风险[12]。APP/PS1 小鼠是目前国内外较公认且研究最深入的AD 转基因模型鼠之一[13]。本研究结果显示,甜菜碱补充饮食可改善APP/PS1 小鼠的记忆功能障碍,此与前人的研究一致。AD 的主要病理特征为多个脑区出现过度沉积的Aβ 斑块[14],APP/PS1 小鼠APP基因突变导致Aβ 过度沉积[13]。本研究用免疫荧光实验证明了甜菜碱补充饮食可降低APP/PS1 小鼠海马和皮质中Aβ 沉积。以上结果表明,甜菜碱补充饮食是潜在的减缓AD 进展的治疗策略。
AD 患者海马区是脑内神经元易受损伤和突触可塑性影响的主要脑区之一。成年海马DG 区存在神经干细胞,其位于海马门区与颗粒细胞层间的下颗粒带,并且终生保持着增殖分化的能力[15]。DG 的神经发生在AD 疾病中有着重要作用,AD 患者脑内新生神经元明显减少[15]。本研究结果显示甜菜碱补充饮食可明显增加APP/PS1 小鼠海马中神经发生和增殖。另外,突触功能障碍和缺失与AD 中海马神经功能发生缺陷以及Aβ 进行性堆积有关[16]。棘突是与另外一个神经元突起的终末支和树突形成突触的接触点。本研究显示,甜菜碱补充饮食可明显增加APP/PS1 小鼠海马神经中棘突密度。LTP 被认为是在大脑中储存记忆的一种突触机制[17]。因此,甜菜碱补充饮食增强LTP 可以解释APP/PS1 小鼠的突触恢复和行为改善的结果。海马内的突触结构或/和功能障碍是AD 认知功能严重受损的原因之一,而增强海马神经元突触可塑性可改善神经元传导功能和认知功能[18-20]。本研究显示,摄食甜菜碱后,APP/PS1小鼠海马中突触可塑性相关的重要蛋白标记物PSD-95、SYN 和MAP-2 也呈现出增加的趋势,这些结果表明甜菜碱补充饮食可以挽救突触损伤。
另外,本研究采用的甜菜碱剂量设定参考文献[6-7]报道剂量范围的IC50值,而在进行本实验时候未设置剂量梯度,这使得本研究具有一定的缺陷。因此,今后仍需通过不同的AD 模型并选择多种剂量梯度来考察甜菜碱补充饮食对AD 的影响。
综上所述,尽管本研究还存在一定的局限性,但目前结果显示甜菜碱补充饮食可改善APP/PS1 小鼠记忆功能受损,并减少海马和皮质中淀粉样斑块沉积,增加海马神经发生和突触可塑性,提示了甜菜碱补充饮食将可能是具有前景的AD 饮食方案。

