半硫丸调控AMPK/PPARγ/GPAT3 信号通路对甲减模型大鼠脂质代谢异常的保护作用
曾明星,陈继东,向 楠,邹小娟
[1.湖北中医药大学基础医学院,湖北 武汉 430065; 2.湖北中医药大学第一临床学院,湖北 武汉 430061; 3.湖北省中医院(湖北中医药大学附属医院) 内分泌病科,湖北 武汉 430070]
甲减是临床上常见的内分泌疾病。在我国,甲减的患病率已高达17.8%,甲减可引起低代谢症群,进而引起多脏器和组织损伤,严重威胁身体健康[1]。其中,血脂异常是甲减的常见并发症之一,由此带来的动脉粥样硬化性心血管疾病备受关注[2]; 同时,甲减引起的高胆固醇血症还会增加胆结石形成,引起肝脏脂肪变性,使得ALT/GGT 轻度异常,非酒精性脂肪性肝病风险增加[3]; 甲减还可改变卵巢脂质的含量和相关信号通路,进而影响卵泡的成熟,引起女性不孕的发生[4]。可见,甲减引起的血脂代谢障碍可引起心血管、肝脏、胆囊、生殖等多系统功能障碍,危害性大,需要展开深入研究。
Ma 等[5]研究发现,TSH 可通过与TSHR 结合,抑制AMPKThr172磷酸化,激活PPARγ 转录,进而促进成熟脂肪细胞GPAT3表达,AMPK/PPARγ/GPAT3信号通路可能是甲减合并血脂异常的重要机制之一。甲减合并血脂异常属于中医“瘿劳” “血浊” 病范畴,其中以脾肾阳虚证最为多见[6]。本研究选取具有温肾健脾、化痰通浊功效的经典方剂半硫丸,探讨其对甲减合并血脂异常的作用及其效应机制,以期为临床提供新的治疗方法和思路。
1 材料
1.1 动物 5 周龄SPF 级SD 雄性大鼠,体质量(200±20) g,由三峡大学提供,实验动物生产许可证号SCXK(鄂) 2017-0012,自由饮食,温度20 ~22 ℃,相对湿度50% ~60%,适应性饲养1 周,饲养于湖北中医药大学实验动物中心。本研究经湖北中医药大学实验动物中心动物伦理委员会批准(伦理号HUCMS202009007)。
1.2 药物 半硫丸胶囊,0.5 g/粒,由湖北省中医院药剂科提供,用生理盐水配成3% 混悬液备用; 丙硫氧嘧啶片(规格100 mg,批号31180401,精华制药集团股份有限公司); 左甲状腺素钠片(规格50 μg,批号241246,德国Merck 公司)。
1.3 试剂 苏木素(美国Sigma 公司,货号H9627); 伊红Y (水溶性,国药集团化学试剂有限公司,货号71014544); 大鼠促甲状腺素 (TSH)、游离甲状腺素(FT4)、游离三碘甲状腺原氨酸(FT3) 酶联免疫吸附测定试剂盒(武汉伊莱瑞特生物科技股份有限公司,货号EEL-R0976c、E-EL-0122c、E-EL-0079c); 兔多抗GAPDH(杭州贤至生物科技有限公司,货号AB-P-R001); 兔多抗GPAT3、PPARγ、p-AMPK (美国Affinity Biosciences 公司,货号Af0485、Af6284、Af3422); 兔多抗AMPK (英国Abcam 公司,货号Ab131512); HRP 标记羊抗兔二抗、兔多抗TSHR (武汉博士德生物工程有限公司,货号BA1054、A00576-1)。
1.4 仪器 全自动生化分析仪(美国Rayto 公司,型号Chemray); 病理切片机(德国Leica 公司,型号RM 2016);组织摊烤片机(武汉俊杰实业集团有限公司,型号JK-6);显微镜(日本Olympus 公司,型号BX53); 微型高速离心机(美国Labnet 公司,型号C2500-R-230V); 电热恒温培养箱(日本ASONE 公司,型号ICV-450); 多功能酶标仪(美国Molecular Devices 公司,型号Flex Station 3); 垂直电泳槽、电转仪 (北京六一仪器有限公司,型号DYCZ-24DN、DYCZ-40); 实时荧光定量PCR 仪(美国ABI 公司,型号QuantStudio 6); 水平电泳仪、紫外分析仪(北京君意东方电泳设备有限公司,型号JY300、JY02S)。
2 方法
2.1 造模与分组 将60 只SD 大鼠随机分为正常组(10只),灌胃给予等体积生理盐水; 造模组(50 只),灌胃给予含10 mg/kg 丙硫氧嘧啶片的生理盐水,连续28 d。造模成功后,将模型大鼠随机分为模型组、优甲乐组、半硫丸低剂量组、半硫丸高剂量组和联合用药组(优甲乐联合半硫丸),每组10 只。药物剂量按实验动物与人体表面积比换算,即200 g 大鼠所需剂量相当于成人量×0.018。
2.2 给药 优甲乐组大鼠每天灌胃给予0.04%优甲乐混悬液1.8 mL,半硫丸低、高剂量组大鼠每天分别灌胃给予3%半硫丸混悬液0.9、1.8 mL,联合用药组大鼠每天灌胃给予0.04% 优甲乐混悬液0.9 mL 和3% 半硫丸混悬液0.9 mL,正常组、模型组大鼠灌胃给予等体积生理盐水,持续6 周。
2.3 标本制备 麻醉各组大鼠,经心脏采血,分离血清用于甲状腺功能和血脂检测,每组8 只大鼠断头处死,分别取甲状腺、肾周脂肪,置于-70 ℃保存,用于形态学检查、相关蛋白和mRNA 表达检测。
2.4 ELISA 法检测大鼠甲状腺功能、血脂水平 按照相关试剂盒说明书操作,检测各组大鼠的甲状腺功能相关指标(FT3、FT4、TSH) 和血脂水平(TC、TG、LDL、HDL)。
2.5 HE 染色观察肾周脂肪组织 取相应组织,固定、脱水、包埋、切片、脱蜡、染色,显微镜下观察并拍照。
2.6 RT-qPCR 法检测肾周脂肪组织PPARγ、GPAT3mRNA表达 通过Primer Premier 5.0 软件设计引物,由武汉擎科生物技术有限公司合成,引物序列为PPARγ正向5′-GACATCCCGTTCACAAGAGC-3′,反向 5′-GCTCTTCATGT GGCCTGTTG-3′,产物长度151 bp;GPAT3正向5′-CATCA GTCCAAAGCTCACCA-3′,反向5′-ACAGGGAGCGAACACA GATC-3′,产物长度212 bp。扩增反应条件为50 ℃2 min,95 ℃10 min; 95 ℃30 s,60 ℃30 s,共40 个循环。绘制熔解曲线,数据以2-ΔΔCT法进行分析,计算目的基因的mRNA 相对表达量。
2.7 Western blot 法检测肾周脂肪组织TSHR、p-AMPK、PPARγ、GPAT3蛋白表达 提取大鼠肾周脂肪组织总蛋白,检测蛋白浓度,蛋白通过SDS-PAGE 凝胶电泳分离并转移至PVDF 膜。5%脱脂奶粉溶液封闭2 h,4 ℃下分别加入兔多抗TSHR (1 ∶500)、GPAT3(1 ∶1 000)、PPARγ(1 ∶1 000)、p-AMPK (1 ∶1 000)、AMPK (1 ∶500)、GAPDH (1 ∶1 000) 抗体孵育24 h。用TBST 稀释相应的HRP 标记二抗(1 ∶50 000),使PVDF 膜浸泡于二抗孵育液中,室温摇床孵育2 h,显影、曝光,采用IPP 6.0 分析软件对各组条带进行分析,得到蛋白相对表达量。
2.8 统计学分析 通过SPSS 24.0 软件进行处理,计量资料均符合正态分布且方差齐,数据以(±s) 表示,多组间比较采用单因素方差分析,组间两两比较采用LSD 法。P<0.05 表示差异具有统计学意义。
3 结果
3.1 半硫丸对甲减大鼠肾周脂肪组织病理形态的影响 与正常组比较,模型组大鼠脂肪滴明显聚集增多; 与模型组比较,各给药组脂肪滴聚集改善; 与优甲乐组比较,半硫丸各剂量组与联合用药组改善更为明显; 与半硫丸低剂量组比较,半硫丸高剂量组效果更好,见图1。
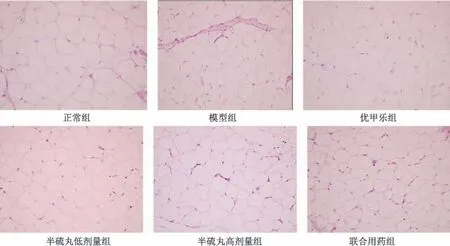
图1 各组大鼠肾周脂肪组织HE 染色(×200)
3.2 半硫丸对甲减大鼠血清FT3、FT4、TSH 水平的影响 与正常组比较,模型组大鼠血清FT3、FT4水平降低(P<0.01),TSH 水平升高(P<0.01); 与模型组比较,优甲乐组和联合用药组大鼠血清FT3、FT4水平升高(P<0.01),TSH 水平降低(P<0.01),而半硫丸高、低剂量组改变不明显,没有统计学差异(P>0.05),见表1。
表1 半硫丸对甲减大鼠血清FT3、FT4、TSH 水平的影响(±s,n=8)

表1 半硫丸对甲减大鼠血清FT3、FT4、TSH 水平的影响(±s,n=8)
注: 与正常组比较,∗∗P<0.01; 与模型组比较,##P<0.01。
组别FT3/(pg·mL-1) FT4/(pg·mL-1) TSH/(ng·mL-1)正常组39.94±2.5238.16±2.9419.70±5.70模型组20.78±2.66∗∗ 15.26±2.24∗∗ 44.33±10.05∗优甲乐组36.07±1.58##31.75±2.31##24.88±3.86##半硫丸低剂量组 22.41±3.7516.18±3.0040.00±8.72半硫丸高剂量组 25.00±4.3717.14±2.2834.38±9.41联合用药组30.23±3.97##25.77±2.97##29.89±2.34##
3.3 半硫丸对甲减大鼠血清TC、TG、LDL、HDL 水平的影响 与正常组比较,模型组大鼠血清TC、TG、LDL-C 水平升高(P<0.01),HDL-C 水平无明显变化(P>0.05);与模型组比较,各给药组大鼠血清TC、LDL-C 水平降低(P<0.01),优甲乐组和联合用药组大鼠血清TG 水平降低(P<0.01),见表2。
表2 半硫丸对甲减大鼠血清TC、TG、LDL、HDL 水平的影响(mmol/L,±s,n=8)

表2 半硫丸对甲减大鼠血清TC、TG、LDL、HDL 水平的影响(mmol/L,±s,n=8)
注: 与正常组比较,∗∗P<0.01; 与模型组比较,##P<0.01。
组别TCTGLDL-CHDL-C正常组3.07±0.141.80±0.171.10±0.161.57±0.23模型组4.64±0.16∗∗2.25±0.20∗∗2.87±0.08∗∗1.28±0.24优甲乐组3.14±0.17##1.84±0.10##1.24±0.18##1.42±0.28半硫丸低剂量组3.70±0.40##1.99±0.102.07±0.20##1.30±0.14半硫丸高剂量组3.52±0.33##1.86±0.151.90±0.20##1.54±0.32联合用药组3.25±0.11##1.85±0.40##1.55±0.11##1.40±0.12
3.4 半硫丸对甲减大鼠肾周脂肪组织PPARγ、GPAT3mRNA 表达的影响 与正常组比较,模型组大鼠肾周脂肪组织PPARγ、GPAT3mRNA 表达升高(P<0.01); 与模型组比较,半硫丸各剂量组和联合用药组大鼠肾周脂肪组织PPARγmRNA 表达降低(P<0.01),各给药组大鼠肾周脂肪组织GPAT3mRNA 表达降低(P<0.01),见表3。
表3 半硫丸对甲减大鼠肾周脂肪组织PPARγ、GPAT3 mRNA 表达的影响(±s,n=8)

表3 半硫丸对甲减大鼠肾周脂肪组织PPARγ、GPAT3 mRNA 表达的影响(±s,n=8)
注: 与正常组比较,∗∗P<0.01; 与模型组比较,##P<0.01。
组别PPARγGPAT3正常组0.98±0.111.01±0.14模型组2.68±0.26∗∗1.84±0.19∗∗优甲乐组2.51±0.131.11±0.11##半硫丸低剂量组2.18±0.18##1.15±0.12##半硫丸高剂量组1.74±0.21##1.15±0.26##联合用药组1.65±0.16##1.16±0.19##
3.5 半硫丸对甲减大鼠肾周脂肪组织TSHR、p-AMPK、PPARγ、GPAT3蛋白表达的影响 与正常组比较,半模型组大鼠肾周脂肪组织TSHR、PPARγ、GPAT3蛋白表达升高(P<0.01),p-AMPK 蛋白表达降低(P<0.01); 与模型组比较,半硫丸各剂量组和联合用药组大鼠肾周脂肪组织TSHR、PPARγ、GPAT3蛋白表达降低 (P<0.01),p-AMPK 蛋白表达升高(P<0.01),优甲乐组大鼠肾周脂肪组织GPAT3蛋白表达降低(P<0.01),见表4、图2。
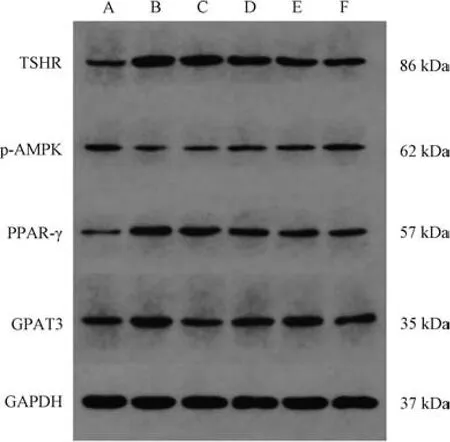
图2 肾周脂肪组织TSHR、p-AMPK、PPARγ、GPAT3 蛋白条带图
表4 半硫丸对甲减大鼠肾周脂肪组织TSHR、p-AMPK、PPARγ、GPAT3 蛋白表达的影响(±s,n=8)
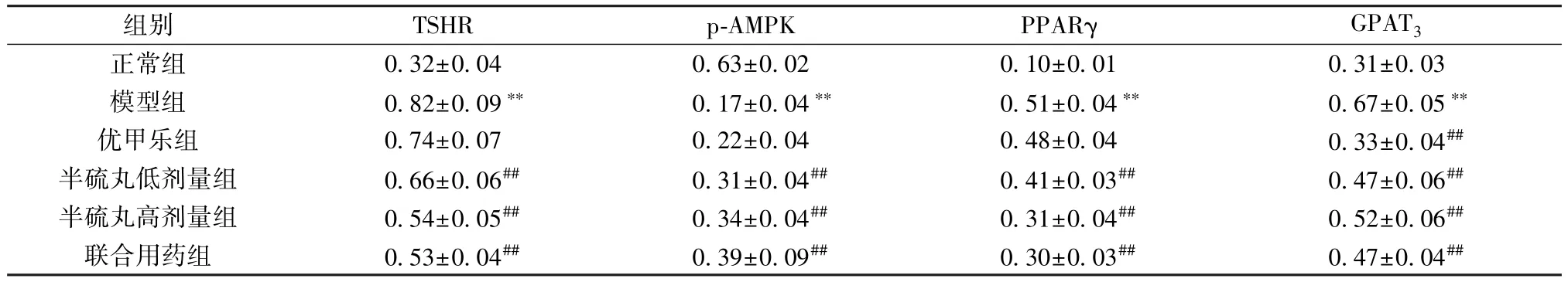
表4 半硫丸对甲减大鼠肾周脂肪组织TSHR、p-AMPK、PPARγ、GPAT3 蛋白表达的影响(±s,n=8)
注: 与正常组比较,∗∗P<0.01; 与模型组比较,##P<0.01。
组别TSHRp-AMPKPPARγGPAT3正常组0.32±0.040.63±0.020.10±0.010.31±0.03模型组0.82±0.09∗∗0.17±0.04∗∗0.51±0.04∗∗0.67±0.05∗∗优甲乐组0.74±0.070.22±0.040.48±0.040.33±0.04##半硫丸低剂量组0.66±0.06##0.31±0.04##0.41±0.03##0.47±0.06##半硫丸高剂量组0.54±0.05##0.34±0.04##0.31±0.04##0.52±0.06##联合用药组0.53±0.04##0.39±0.09##0.30±0.03##0.47±0.04##
4 讨论
甲减是继发性血脂异常的常见病因[7]。升高的血脂可以影响内膜厚度,促进高血压发展[8],严重者可出现心衰[9]。甲状腺激素治疗虽能改善脂代谢状态,但需终生服药,同时也增加了心血管疾病的风险[10],而中医药在防治甲减及合并症方面具有一定的优势和特色[11]。
甲减属于中医“瘿劳” 病范畴,以脾肾阳虚为主,可夹杂痰湿、瘀血、郁热等变证[12-14]。半硫丸出自《太平惠民和剂局方》,可用于甲减的治疗,疗效颇佳,半硫丸能降低Thc 水平[15],但具体机制不清。研究发现,敲除TSHR可增加脂肪细胞的大小,减少TSH 诱导的脂解[16]。Ma等[5]研究发现,TSH 与TSHR 结合后,可抑制AMPKThr172磷酸化,激活PPARγ 转录,增加GPAT3表达,增加TG 的生成。本研究发现甲减大鼠血清TG、TC、LDL-C 水平升高,提示甲减合并血脂紊乱[17]。还发现,肾周脂肪组织PPARγ、GPAT3mRNA 基因表达升高,TSHR、PPARγ、GPAT3蛋白表达升高,p-AMPK 蛋白表达降低,提示其存在AMPK/PPARγ/GPAT3信号通路异常表达[5]。
AMPK 激活后通过下调脂肪生成酶,抑制脂肪酸合成,促进游离脂肪酸氧化,减少脂质合成[18]。本研究中甲减大鼠p-AMPK 蛋白表达较正常组降低,AMPK 信号通路被抑制,脂肪酸合成增加,PPARγ 表达上调,进而导致血脂升高。PPARγ 活化后通过参与脂代谢相关基因的调控,抑制脂质代谢。PPARγ 表达升高可能是模型组脂滴过度积聚的原因,半硫丸能抑制PPARγ 的表达,抑制脂滴的积累。综合半硫丸能升高p-AMPK 蛋白表达,降低PPARγ 蛋白表达,推测半硫丸可能是通过激活AMPK 信号通路,下调PPARγ 表达,进而限制脂肪生成,减少脂质合成,起到改善脂质代谢的作用[19]。
特定的GPAT 亚型在不同的细胞中启动甘油三脂的合成[20],GPAT3主要位于内质网[21],是一种参与TG 合成的限速酶[22]。在本研究中,模型组脂滴增大,GPAT3表达升高; 经半硫丸给药后,脂滴的数量减少和大小变小,同时GPAT3mRNA 和蛋白表达降低,这可能与半硫丸降低GPAT3表达,减少TG 合成有关。综合半硫丸能升高p-AMPK 蛋白表达,降低PPARγ 的表达,推测随着TSH 水平和TSHR 蛋白表达降低,AMPK/PPARγ/GPAT3通路被抑制,血脂水平随之下降。
综上所述,各药物干预均能有效降低血脂水平,优甲乐和半硫丸均能下调GPAT3mRNA 表达,半硫丸还能下调PPARγmRNA 表达,降低TSHR、PPARγ、GPAT3蛋白表达,升高p-AMPK 蛋白表达; 联合用药组降低TG 的效果与优甲乐组相当,联合用药后还可降低TSHR、PPARγ 蛋白表达,提示半硫丸的加入起到了减量增效作用。因此,半硫丸可能通过多靶点调控AMPK/PPARγ/GPAT3信号通路,在改善甲减合并脂质代谢紊乱中发挥重要作用。

