浙贝母提取液在大鼠尿液、粪便中的原型成分及代谢产物分析
宗 政,胡 扬,王 昊,王金宏,杨 波,胡玲玲,程 斌,周爱珍,李文兰∗
(1.哈尔滨商业大学药学院,黑龙江 哈尔滨 150076; 2.浙江药科职业大学中药学院,浙江 宁波 315100)
浙贝母为百合科浙贝母FritillariathunbergiiMiq.的干燥鳞茎,名列“浙八味” 之首,是我国传统的道地药材之一,常用于治疗风热咳嗽、肺痈、乳痈、瘰疬、疮毒,肿瘤等疾病[1-3]。迄今为止,从浙贝母中已经鉴定出数百种化学成分[4]。研究表明,浙贝母生物碱类成分为其抗炎、抗氧化及抗肿瘤的潜在活性成分[5-7],贝母素甲和贝母素乙为浙贝母中的主要活性成分[6-8]。程斌等[9-10]通过谱-效相关性研究初步筛选出浙贝母9 种与抗炎作用相关的质量标志物,6 种与化痰作用相关的质量标志物。
近年来,鉴定药物在体内化学成分的方法和技术不断发展,最常用的为超高效液相色谱-四极杆-飞行时间串联质谱(UPLC-Q-TOF-MS) 技术[11-12]。李荣荣等[13]对浙贝母主要成分在大鼠血中的代谢产物进行研究,而目前尚未有对浙贝母在大鼠尿液、粪便中化学成分的相关研究。因此,本实验对灌胃浙贝母后大鼠的尿液和粪便样品进行UPLC-Q-TOF-MS 分析,初步明确其在尿液、粪便中的化学成分,并追寻主要活性成分贝母素甲、贝母素乙的代谢途径,以期为后期其药效物质基础研究提供参考。
1 材料
1.1 动物 雄性Wistar 大鼠,体质量(230±20) g,购自长春市亿斯实验动物技术有限责任公司,实验动物生产许可证号SCXK (吉) 2018-0007。单次实验所用大鼠均为同一批次,自由进食饮水,饲养于哈尔滨商业大学实验室,适应性饲养1 周,设定温度为(22±1)℃,相对湿度为45% ~60%。所有实验操作均符合哈尔滨商业大学动物伦理委员会要求(审查号HSDYXY-2020080)。
1.2 试剂与药物 浙贝母(产地浙江章水) 购自哈尔滨三棵树药材市场,经哈尔滨商业大学张德连教授鉴定为正品。贝母素甲(批号B20080)、贝母素乙(批号B20081)、西贝素(批号B21331)、贝母辛(批号B20082) 对照品均购自上海源叶生物科技有限公司,纯度均>99.0%。乙腈(质谱纯)、甲醇(质谱纯)、甲酸(质谱纯) 均购自美国Thermo Fisher Scientific 公司; 甲醇(色谱级)、氨水(分析纯) 均购自天津市天力化学试剂有限公司; 三氯甲烷(分析纯) 购自天津市科密欧化学试剂有限公司; 水为蒸馏水,购自广州屈臣氏食品有限公司。
1.3 仪器 Xevo G2 Q TOF 质谱、Acquity UPLC 色谱仪(美国Waters 公司); 电子分析天平(瑞士梅特勒-托利多公司); 干式氮吹仪(北京成萌伟业科技有限公司); 快速混匀器(常州国华电器有限公司); 台式离心机(上海安亭科学仪器有限公司); 超声清洗器(深圳洁盟清洗设备有限公司)。
2 方法
2.1 提取物制备 称取已过4 号筛的浙贝母粉末13 g,加入26 mL 浓氨水浸润1 h,再加入260 mL 三氯甲烷-甲醇混合液(4 ∶1),称定质量后混匀,在80 ℃水浴中加热回流2 h,自然放冷,滤纸过滤后浓缩成浸膏,即得,置于-20 ℃冰箱保存。
2.2 分组与给药 将大鼠随机分为空白组、浙贝母组,每组6 只。在前期实验基础上,确定浙贝母灌胃给药剂量为0.9 g/kg (以生药计),空白组大鼠灌胃给予等体积生理盐水,每天1 次,连续7 d。
2.3 尿液、粪便收集及预处理
2.3.1 尿液 给药7 d 后,将浙贝母组大鼠置于代谢笼中,禁食不禁水12 h,收集0~12 h 含药尿液,3 500 r/min离心15 min,取上清液2 mL,加入4 倍量乙腈涡旋混匀2 min,13 000 r/min 离心10 min,取上清液,N2吹干,加入2 倍量乙腈涡旋混匀2 min,13 000 r/min 离心10 min,取上清液,N2吹干,0.4 mL 甲醇复溶,0.22 μm 微孔滤膜过滤,同法制备空白尿液供试品溶液,4 ℃保存。
2.3.2 粪便 给药7 d 后,将浙贝母给药组大鼠置于代谢笼中,禁食不禁水12 h,收集0~12 h 含药粪便,研钵捣碎研磨后称取0.5 g,加入4 倍量乙腈超声提取30 min,13 000 r/min 离心10 min,取上清液,N2吹干,加入2 倍量乙腈,涡旋混匀2 min,13 000 r/min 离心5 min,取上清液,N2吹干,0.4 mL 甲醇复溶,0.22 μm 微孔滤膜过滤,同法制备空白粪便供试品溶液,在4 ℃下保存。
2.4 UPLC-Q-TOF-MS 分析条件
2.4.1 色谱 Waters ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm); 流动相乙腈 (A) -0.1% 甲酸(B),梯度洗脱 (0 ~5 min,2% ~25% A; 5 ~12 min,25% ~45% A; 12 ~15 min,45% ~80% A; 15 ~18 min,80% ~86%A; 18 ~25 min,86% ~94% A); 体积流量0.4 mL/min; 柱温30 ℃; 进样量2 μL。
2.4.2 质谱 电喷雾离子源(ESI),正负离子扫描; 质量扫描范围m/z50 ~1 200; 喷雾电压3.0 kV; 离子源温度100 ℃; 去溶剂气温度400 ℃,体积流量800 L/h; 锥孔气体积流量50 L/h; 碰撞能量20~45 mV。
2.5 数据处理 通过PubMed、CNKI、Chemspider、中药系统药理数据库和分析平台(TCMSP) 等数据库,收集整理关于浙贝母化学成分及其代谢物的信息,采用Waters Masslynx 4.1 软件进行数据分析,根据分子量、分子式、碎片离子质谱图、同类化合物的质谱裂解规律和相关文献对化合物结构进行鉴定。
3 结果
3.1 成分鉴定及分析 尿液、粪便在正负离子模式下的基峰色谱图分别见图1~2。
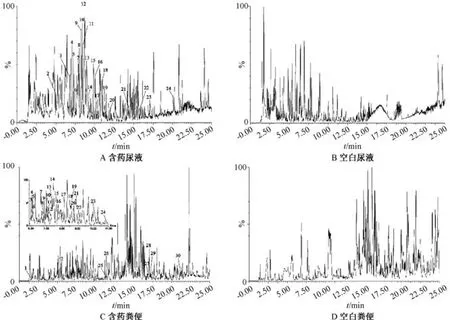
图1 大鼠粪便、尿液正离子模式基峰色谱图
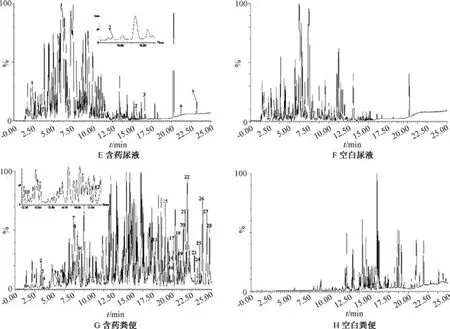
图2 大鼠粪便、尿液负离子模式基峰色谱图
正离子模式下,尿液中共检测到15 种原型成分、9 种代谢产物; 而负离子模式下共检测到5 种原型成分,去除重复后共检测到28 种,包括19 种原型成分、9 种代谢产物。正离子模式下,粪便中共检测到16 种原型成分、14 种代谢产物; 而负离子模式下共检测到23 种原型成分、5 种代谢产物,去除重复后共检测到53 种化学成分,包括37种原型成分、16 种代谢产物。除去不同生物样品中的重复成分后,共检测出66 种化学成分,包括45 种原型成分、21 种代谢产物,其中共有原型成分24 种,粪便中独有成分15 种,尿液中独有成分6 种; 共有代谢成分有6 种,粪便中独有成分11 种,尿液中独有成分4 种,具体见表1~2。
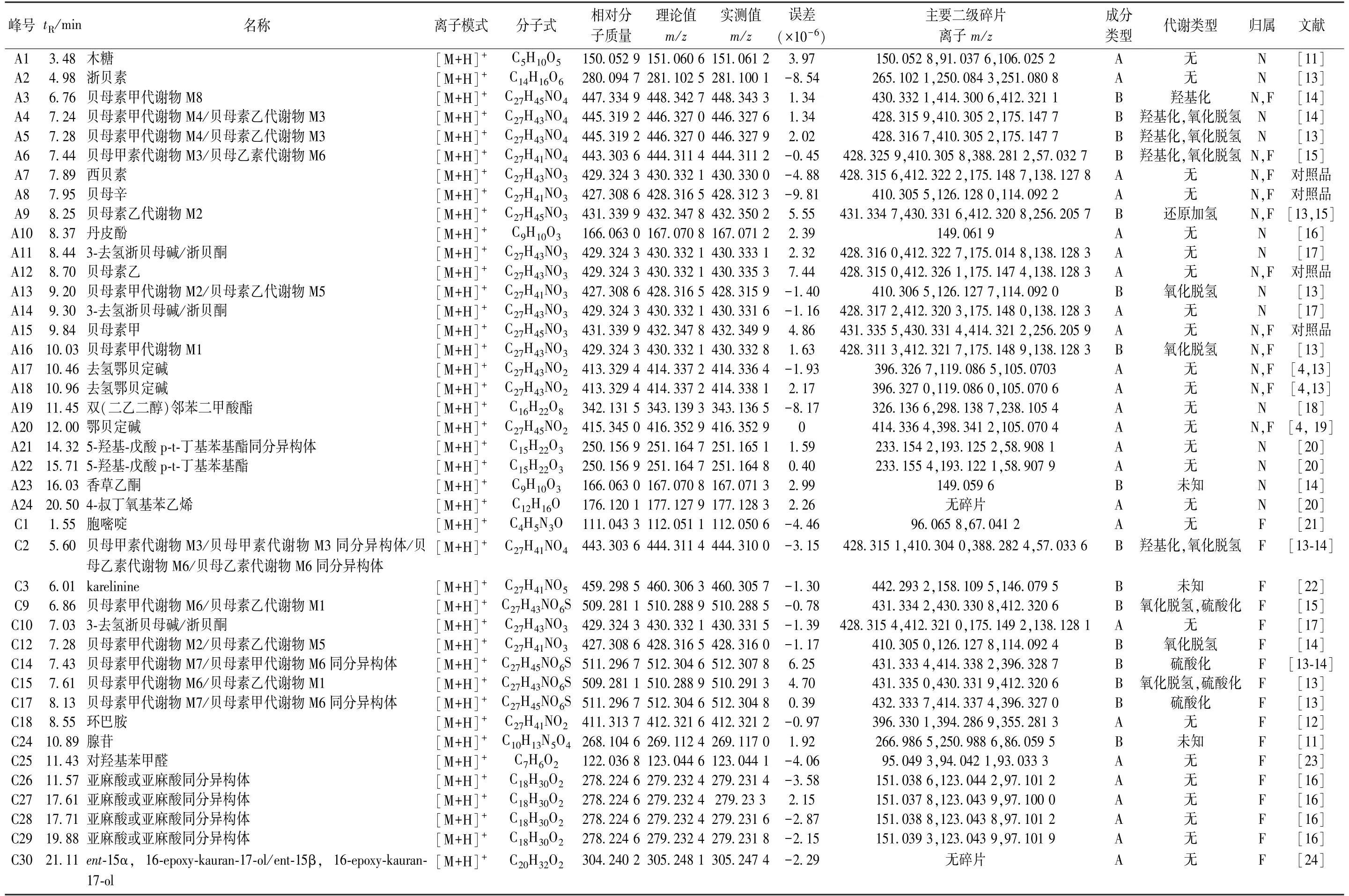
表1 正离子模式下大鼠尿液、粪便中浙贝母原型成分及代谢产物

表2 负离子模式下大鼠尿液、粪便中浙贝母原型成分及代谢产物
3.2 原型成分代谢途径分析
3.2.1 贝母素甲 该成分可能会发生I 相代谢反应,即羟基化反应、氧化脱氢反应,以及Ⅱ相代谢反应,即硫酸化反应,其代谢途径见图3A。
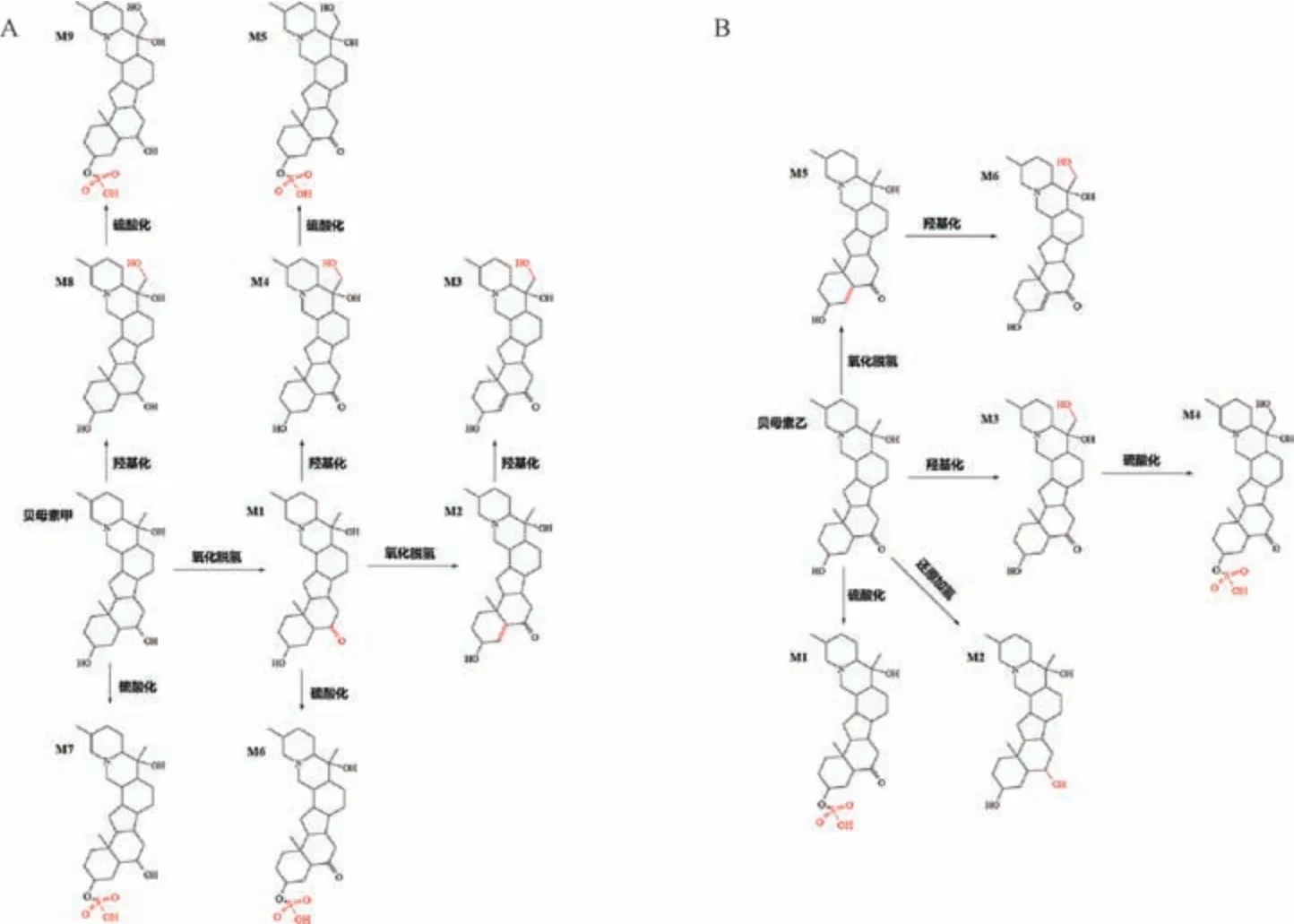
图3 贝母素甲(A)、贝母素乙(B) 代谢途径
A15 号峰保留时间9.84 min,分子量431.339 9,m/z432.349 9 [M +H]+,失去一分子水形成m/z414.321 2[M+H-H2O]+,碎片离子m/z431.335 5、430.331 4 与对照品碎片离子一致,推测为贝母素甲。
A16 号峰保留时间10.03 min,分子量429.324 3,m/z430.332 8 [M+H]+,与贝母素甲准分子离子峰相差2,可能为贝母素甲氧化脱氢产物,二级碎片离子m/z428.311 3[M+H-H2]+,m/z412.321 7 [M+H-H2O]+,与文献[15]报道一致,推测为贝母素甲代谢物M1。
C12 号峰保留时间7.28 min,分子量427.308 6,m/z428.316 0 [M+H]+,与贝母素甲代谢物M1 准分子离子峰相差2,可能为贝母素甲代谢物M1 进一步氧化脱氢产物,二级碎片m/z410.305 [M+H-H2O]+为失去一分子水形成,m/z256.206 9、148.111 8 碎片离子与文献[16] 报道一致,推测为贝母素甲代谢物M2。
C2 号峰保留时间7.44 min,分子量443.303 6,m/z444.311 4 [M+H]+,与贝母素甲代谢物M2 准分子离子峰相差16,可能为贝母素甲代谢物M2 进一步羟基化产物,脱氧形成二级碎片离子m/z428.315 9 [M+H-O]+,进一步失去一分子水形成m/z410.305 8 [M+H-O-H2O]+碎片离子与文献[15-16] 报道一致,推测为贝母素甲代谢物M3。
A4 号峰保留时间7.24 min,分子量445.319 2,m/z446.327 6 [M+H]+,与贝母素甲代谢物M1 准分子离子峰相差16,可能为贝母素甲代谢物M1 进一步羟基化产物,失去一分子水形成m/z428.315 9 [M+H-H2O]+碎片离子,进一步失去一分子水产生m/z410.305 2 [M+H-H2O-H2O]+碎片离子,此过程与文献[16] 报道一致,推测为贝母甲素代谢物M4。
G6 号峰保留时间5.96 min,分子量525.276,m/z524.268 8 [M-H]-,与贝母素甲代谢物M4 准分子离子峰相差80,可能为贝母素甲代谢物M4 进一步硫酸化产物,失去一分子水形成m/z506.257 3 [M-H-H2O]-的碎片离子,与文献[15] 报道一致,推测为贝母甲素代谢物M5。
C15 号峰保留时间6.86 min,分子量509.281 1,m/z510.288 5 [M+H]+,与贝母素甲代谢物M1 准分子离子峰相差80,可能为贝母素甲代谢物M1 进一步硫酸化产物,碎片离子m/z430.330 8 为贝母素甲特征峰,它和m/z412.320 6 [M+H-H2O-SO3]+与文献[15] 报道一致,推测为贝母素甲代谢物M6。
C14 号峰保留时间7.43 min,分子量511.296 7,m/z512.304 6 [M+H]+,与贝母素甲准分子离子峰相差80,可能为贝母素甲硫酸化产物,二级碎片离子m/z414.337 4[M+H-H2O-SO3]+、m/z396.328 7 [M+H-2H2O-SO3]+与文献[15-16] 报道一致,推测为贝母素甲代谢物M7。
A3 号峰保留时间9.20 min,分子量447.334 9,m/z448.342 3 [M+H]+,与贝母素甲准分子离子峰相差16,可能为贝母素甲羟基化产物,失去一分子水形成m/z410.036 5[M+H-H2O]+碎片离子,与文献[16] 报道一致,推测为贝母素甲代谢物M8。
G5 号峰保留时间5.66 min,分子量527.291 7,m/z526.284 [M-H]-,与贝母素甲代谢物M3 准分子离子峰相差80,可能为贝母素甲代谢物M3 进一步硫酸化产物,失去一分子水形成m/z508.276 2 [M-H-H2O]-的碎片离子,与文献[15] 报道一致,推测为贝母素甲代谢物M9。
3.2.2 贝母素乙 该成分可能发生Ι 相代谢反应,即羟基化反应、还原加氢反应、氧化脱氢反应,以及Ⅱ相代谢反应,即硫酸化反应,其代谢途径见图3B。
A12 号峰保留时间8.70 min,分子量429.324 3,m/z430.337 3 [M +H]+,失去一分子水形成m/z412.326 1[M+H-H2O]+碎片离子,与对照品二级碎片信息一致,推测为贝母素乙。
C9 号峰保留时间6.86 min,分子量509.281 1,m/z510.291 3 [M+H]+,与贝母素乙准分子离子峰相差80,可能为贝母素甲硫酸化产物,碎片离子m/z412.320 6 [M+HH2O-SO3]+、m/z430.331 9 [M+H-SO3]+与贝母素乙碎片离子及文献[17] 报道一致,推测为贝母素乙代谢物M1。
A9 号峰保留时间8.25 min,分子量431.339 9,m/z432.350 2 [M+H]+,与贝母素乙准分子离子峰相差2,可能为贝母素乙还原加氢产物,其加氢得到m/z430.331 6[M+H-H2]+碎片离子,失去一分子水形成m/z412.320 8[M+H-H2O]+碎片离子,与文献[15,17] 报道一致,推测为贝母素乙代谢物M2。
A5 号峰保留时间7.28 min,分子量445.319 2,m/z446.327 9 [M+H]+,与贝母素乙准分子离子峰相差16,可能为贝母素乙羟基化产物,失去一分子水形成m/z428.325 9 [M+H-H2O]+碎片离子,进一步失去一分子水形成m/z410.305 8 [M +H-H2O-H2O]+碎片离子,与文献[15] 报道一致,推测为贝母素乙代谢物M3。
G6 号峰保留时间5.96 min,分子量525.276,m/z524.268 8 [M-H]-,与贝母素乙代谢物M3 准分子离子峰相差80,可能为贝母素乙代谢物M3 进一步硫酸化产物,失去一水分子形成m/z506.257 3 [M-H-H2O]-碎片离子,与文献[15-17] 报道一致,推测为贝母素乙代谢物M4。
A13 号峰保留时间9.20 min,分子量427.308 6,m/z428.316 [M+H]+,与贝母素乙准分子离子峰相差2,可能为氧化脱氢产物,失去一分子水形成m/z410.036 5 碎片离子,与文献[15] 报道一致,推测为贝母素乙代谢物M5。
A6 号峰保留时间7.44 min,分子量443.303 6,m/z444.311 4 [M+H]+,与贝母素乙代谢物M2 准分子离子峰相差16,可能为贝母素乙代谢物M2 进一步羟基化产物,脱去一个氧形成m/z428.315 9 [M+H-O]+碎片离子,进一步失去一分子水形成m/z410.305 8 [M+H-O-H2O]+碎片离子,与文献[17] 报道一致,推测为贝母素乙代谢物M6。
4 讨论
中药及其复方的有效组分研究和体内代谢产物、代谢过程的研究为中药药效物质基础研究提供强有力的支撑,推动中药及其复方的现代化。由于中药化学成分多而复杂,在体内代谢产物、代谢路径存在不可预知性,如何在数量庞大的生物样本信息中辨识目标组分,是目前对中药体内代谢研究的重点和难点,故本实验采用UPLC/Q-TOF-MS 技术对灌胃浙贝母提取物后大鼠的尿液与粪便进行定性分析。结果发现,在大鼠尿液中共检测出化学成分28 种,其中原型成分19 种,代谢产物9 种; 在大鼠粪便中共检测出化学成分53 种,其中原型成分37 种,代谢产物16 种,去除重复后,共检测出化学成分66 种,其中原型成分45 种,代谢产物21 种; 粪便、尿液中共有原型成分24 种,粪便中独有成分15 种,尿液中独有成分6 种; 粪便、尿液中共有代谢成分6 种,粪便中独有成分11 种,尿液中独有成分4 种。
浙贝母中的有效活性成分主要是异甾型生物碱,其极性较小,多以原型被吸收[32]。本实验在尿液和粪便中共计检测出47 种原型成分,这些原型成分排泄途径大多不一致,一些原型药物代谢后主要通过肾脏,由尿液排泄; 一些原型药物可能未被吸收,或吸收经胆汁分泌进入肠道,最后通过粪便排泄[33]。而贝母素甲、贝母素乙、去氢鄂贝定碱、紫鄂贝碱、鄂贝定碱、coriolic acid 等原型药物存在尿液、粪便共有现象,推测这些成分可能经胃肠道吸收后,一部分进入体循环后随尿液排出,一部分经胆汁分泌进入小肠随粪便排出。本实验通过对尿液、粪便的成分研究发现,主要发生生物转化的活性成分是生物碱类成分,本实验在推测灌胃浙贝母后尿液、粪便化学成分的基础上,分析了其主要生物碱活性成分贝母素甲、贝母素乙的代谢途径,结果表明其主要通过Ι 相代谢(羟基化、氧化脱氢、还原加氢)、Ⅱ相代谢(硫酸化) 等,可为后期进一步研究浙贝母的体内代谢过程和作用机制奠定基础。

