逍遥散及其活性成分抗阿尔茨海默病作用的研究进展
朱美薇,杨芳芳,聂泽卉,周小影,刘宇萌,代晓芳,管庆霞
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
阿尔茨海默病是一种与年龄高度相关的退行性神经系统疾病[1],可引发患者记忆定向能力减退、精神行为异常、生活自理能力丧失等变化,晚期患者因全身系统功能退化,多器官并发症死亡。截至2020 年,我国阿尔茨海默病患者数量高达983 万例,已经成为我国城乡居民死亡的第五大原因[2],预计2030 年,我国阿尔茨海默病患者年治疗总费用将高达5 074.9 亿美元[3],给患者家庭和社会带来沉重负担。
目前,对于阿尔茨海默病发病机制的阐释主要集中于β淀粉样蛋白级联、Tau 蛋白过度磷酸化、氧化应激、胆碱能损伤[4]。近年来,越来越多的研究证实阿尔茨海默病是一种系统性疾病,其疾病起源受多因素、多层面影响,如慢性应激[5]、肝脏疾病[6-7]、外周炎症、外周代谢系统异常[8-9]等均是引起阿尔茨海默病病理形态改变的重要驱动因素。
目前,临床上主要使用乙酰胆碱酯酶(AChE) 抑制剂和N-甲基-D-天冬氨酸受体(NMDAR) 阻断剂[10],其靶点单一,无法改善阿尔茨海默病发病的系统性诱因,不足以逆转病程。中医药现代化的发展为抗阿尔茨海默病药物的开发提供了潜在方向,越来越多的经典名方被用于治疗阿尔茨海默病。逍遥散为治疗抑郁症的经方,其对中枢系统的阿尔茨海默病致病因子及通路的表达具有多重调控作用,可改善阿尔茨海默病的多种病理形态,且临床研究证明其疗效切实有效[11-14]。本文对逍遥散及其主要活性成分防治阿尔茨海默病的药理作用进行综述,以期为其深入发展提供理论依据。
1 逍遥散全方的抗阿尔茨海默病作用
逍遥散源于《太平惠民和剂局方》,以柴胡为君药,白芍、当归为臣药,白术、茯苓、甘草、薄荷为使药,生姜为佐药配伍成方[15]。功效为疏肝解郁、养血健脾、调和肝脾。
中医理论认为,肝乃阿尔茨海默病发病的先天之因,脾胃为后天之本[16]。肝主疏泄,并藏血藏魂。肝血失养,肝力匮乏,则气血郁滞,难养脏腑神魄。脾健运,消化水谷精微。水湿停骤,则继生痰湿,上蒙清窍; 精微不化,气血化原不足,则不济脑髓,神明失养。此外,脾土与肝木密切相关,肝之藏血,与脾之运化相属; 脾之运化,赖肝之疏泄,肝郁、脾虚常常并发并存。《金匮要略·脏腑经络先后病篇》云: “见肝之病,知肝传脾,当先实脾”,故“肝血瘀滞、脾虚痰湿” 为阿尔茨海默病的主要病机,“疏肝健脾、气血双补、肝脾同调” 为其主要治则。逍遥散全方八味药配伍,柴胡、白芍、当归滋养先天,茯苓、白术益补后天,气血同调、行瘀化痰,去浊开窍,濡养大脑,消阿尔茨海默病邪滞标实之症[17]。
目前,逍遥散通过“疏肝、健脾、养血” 三者结合协同起效的抗阿尔茨海默病作用已在现代药理学研究中得到验证,王虎平等[18]以腹腔注射D-半乳糖制备阿尔茨海默病小鼠模型,评价逍遥散全方及疏肝、健脾、养血拆方配对组的抗阿尔茨海默病作用,研究显示,各给药组阿尔茨海默病小鼠血清中丙二醛(MDA)、AchE 活性降低,同时胆碱乙酰转移酶(ChAT)、超氧化物歧化酶(SOD) 活性升高,阿尔茨海默病小鼠的学习记忆能力均有提升,且逍遥散全方组防治效果最好。下丘脑-垂体-肾上腺轴(HPA 轴)紊乱为肝郁的现代病理表现,其负反馈所引起的糖皮质激素水平升高会导致海马区结构和功能异变,从而损害认知功能并最终致使阿尔茨海默病的发生。范耀耀等[19]研究发现,逍遥散可通过抑制阿尔茨海默病大鼠海马组织内的糖皮质激素受体(GR) 抑制性蛋白FKBP51 表达增强GR、脑源性神经营养因子(BDNF) 的激活与表达,从而维持HPA 轴的稳态,缓解慢性应激反应下的海马组织损伤,同时逍遥散还可降低阿尔茨海默病标志物淀粉样蛋白前体(APP) 的表达,减少病理产物Aβ 淀粉样沉积。陈美秀等[20]对逍遥散起效的物质基础进行了初步研究,发现逍遥散石油醚部位组对慢性应激复合阿尔茨海默病体外模型的细胞损伤缓解效果最佳,且逍遥散对该细胞模型动态表达的影响与阳性对照药物GR 受体拮抗剂米非司酮类似,进一步巩固证实了FKBPs/GR/BDNF 通路介导的HPA 轴调节功能为逍遥散抗阿尔茨海默病的重要作用途径。
综上所述,逍遥散全方可调节多种与阿尔茨海默病相关的酶、递质及蛋白表达,但目前已探明的全方作用机制和靶点十分单一,对于起效内涵仍然解释不足。因此,衡量逍遥散主要活性成分与疾病靶点间的关联度,整合分析活性成分在全方抗阿尔茨海默病作用中的调控程度,并对逍遥散整体作用的潜在靶点进行预测,是深入揭示逍遥散对于阿尔茨海默病系统性治疗机制的关键。
2 逍遥散单味药及其活性成分的抗阿尔茨海默病作用
2.1 白芍 白芍也称白花芍药,是毛茛科植物芍药PaeonialactifloraPall.的干燥根,味苦酸,性微寒,归肝、脾经,具有养血补肝之功效[21]。现代药理学研究表明,白芍中关键活性成分芍药苷、齐墩果酸、丹皮酚均对阿尔茨海默病具有药效作用。
芍药苷是白芍中主要的萜类糖苷化合物,可穿透血脑屏障且副作用少[22]。Kong 等[23]发现,芍药苷可降低5XFAD转基因小鼠海马体的Aβ 斑块沉积,并通过抑制星状胶质细胞活化,降低相关炎症因子水平而改善神经炎症,该作用可被选择性腺苷A1 受体拮抗剂DPCPX 逆转,提示芍药苷可能通过激活腺苷A1 受体而作为阿尔茨海默病的潜在治疗剂。丹皮酚是白芍中主要的酚酸类有效成分,可改善多种阿尔茨海默病动物模型的认知记忆能力,其血脑屏障穿透性好,可有效识别亲脂性胺从而结合新型有机阳离子转运蛋白逆向转运穿透血脑屏障[24],以上特性使丹皮酚成为一种颇具前景的神经系统疾病治疗剂。Meng 等[25]每天灌胃给予APP/PS1 转基因小鼠丹皮酚20 mg/kg,连续3 周,小鼠皮层与海马体内Aβ42、Aβ40水平降低,Aβ 斑块沉积减少,其学习能力和行为表现提升; 免疫学荧光染色结果显示,丹皮酚还可抑制小胶质细胞过度活化而改善神经炎症。齐墩果酸是白芍中主要的三萜类化合物,Wang等[26]研究发现,齐墩果酸可通过调节钙信号通路来降低突触神经元Ca2+浓度,从而维持神经元超微结构稳定性和神经元突触的可塑性,改善Aβ25-35诱导的阿尔茨海默病大鼠模型记忆丧失。Castellano 等[27]研究发现,齐墩果酸可降低脂多糖(LPS) 诱导的BV2 小胶质细胞中TNF-α、IL-1β、IL-6 等炎症相关因子水平并减少一氧化氮(NO) 释放,从而抑制该体外模型过度活化引起的氧化应激和炎症反应,其作用机制与编码炎症因子和一氧化氮合酶(iNOS) 基因表达的降低有关。
2.2 白术 白术为菊科植物白术AtractylodesmacrocephalaKoidz.的干燥根茎,具有健脾益气、燥湿利水的功效,被称为“补气健脾第一要药”[28]。《神农本草经》 中记载:“术,味微温……做煎饵,久服轻身延年,不饥”。白术质多脂液,味甘可滋脾气亏虚,性温能燥脾健运,以祛痰湿聪神窍为标,利髓海生化之源为本,体现了逍遥散标本兼顾治疗阿尔茨海默病的原则,现代药理学研究表明,白术中的活性成分白术内酯I、双白术内酯、白术内酯Ⅲ、绿原酸具有抗阿尔茨海默病的药效作用。
中医理论认为自噬功能受阻是脾虚的表现,且Aβ 淀粉样蛋白的异常聚集与体内津液运化失常引起的痰邪沉积具有关联性[29],多项研究表明白术可通过调控多种途径而增强Aβ 淀粉的自噬与降解。初双等[30]研究发现,白术乙醇提取物可通过激活PPAR-γ 通路促进其核移位,并提高其下游靶基因的表达,从而促进Aβ 淀粉的自噬过程,减少Aβ 淀粉样沉积。吴丽敏等[31]首先在细胞趋化实验中初步确定了白术提取物可促进阿尔茨海默病转基因秀丽隐杆线虫APP 蛋白的降解,减少Aβ 淀粉样沉积从而改善学习记忆能力; 通过进一步的细胞模型实验发现其作用机制与上调转录因子EB-肝脏激酶B1-单磷酸腺苷活化蛋白激酶(TFEB-LKB1-AMPK) 通路,增强溶酶体自噬过程有关。胆碱能神经递质对于学习记忆功能具有重要调节作用,是抗阿尔茨海默病药物的主要靶区。已有现代证候研究表明,脾虚与脑组织内AchE 含量异常引发的神经损伤密切相关[32],因此从中药当中发现的中枢AchE 抑制剂成为阿尔茨海默病药物开发的重要来源。杨郴[33]通过分子对接技术初步发现双白术内酯与AchE 蛋白具有稳定的结合性,进一步的细胞模型实验结果表明,双白术内酯对于AchE 过表达的MEF 细胞和293T 细胞具有负调节作用,其作用机制可能与抑制糖原合成酶激酶3β (GSK-3β) 的活性有关。毒蕈碱型乙酰胆碱受体M2 (CHRM2) 对突触前乙酰胆碱释放具有负反馈调节作用,可延长海马长时程增强效应(LTP),缓解认知功能损伤[34]。胡倩等[35]基于网络药理学对白术的有效成分、关键靶标及相关通路进行筛选与分析,结果显示,胆碱能神经是白术抗阿尔茨海默病作用的关键通路,CHRM2 为该通路的关键作用靶标,提示白术对于胆碱能神经具有直接影响作用。此外,白术中的酚酸类化合物绿原酸可通过抑制炎症小体NOD 样受体蛋白3(NLRP3) 活化,缓解Aβ 诱导的阿尔茨海默病小鼠神经炎症,发挥神经保护作用[36-37]。
综上所述,白术以补脾健气法论治阿尔茨海默病的传统医学和现代证候学均有较为有力的理论支撑,是逍遥散治疗阿尔茨海默病作用中的关键组成部分,但目前对白术抗阿尔茨海默病作用的研究多为体外细胞实验,且研究重点局限于较为单一的靶点和药效评估标准,缺乏广泛的机制研究和现代药理学验证,因此需要开展多靶点、多通路、多种生物标志物的动物实验研究以进行系统性的探索。
2.3 柴胡 柴胡为伞形科植物柴胡BupleurumchineseDC.及狭叶柴胡BupleurumscorzonerifoliumWilld.的干燥根,味辛、苦,性微寒,归肝、胆、肺经,具有疏散退热、疏肝解郁的功效[28]。
柴胡皂苷是柴胡中主要的活性成分,Li 等[38]研究发现,柴胡皂苷可通过激活细胞核Nrf2 通路负性调节β-淀粉样前体蛋白裂解酶1 (BACE1) 与核因子-κB (NF-κB) 的转录和表达,减少APP/PS1 转基因小鼠海马体中Aβ 淀粉样斑块的产生与沉积,从而改善神经系统的氧化应激和炎症反应。此外,有研究表明柴胡与炙甘草配伍可增加柴胡皂苷的吸收,对柴胡药效发挥具有积极作用,体现了逍遥散遵循“君臣佐使” 的整体观思想协同治疗阿尔茨海默病的辨证内涵[39]。
槲皮素是存在于柴胡中的黄酮醇类化合物,具有广泛的生物活性,可通过诱导自噬、抑制Aβ 淀粉样沉积、增强脑源性神经营养因子、抗神经炎症等多种途径发挥抗阿尔茨海默病的作用[40-41]。作为一种潜在的治疗阿尔茨海默病的天然小分子活性物质,槲皮素对不同类型的阿尔茨海默病模型均有治疗作用[42]。Jain 等[43]发现槲皮素可逆转鱼藤酮诱导的小鼠记忆认知功能受损,并且可通过抑制小胶质细胞过度活化引起的神经炎症从而缓解小鼠的黑质、海马区域的神经病变。Olayinka 等[44]发现槲皮素对东莨菪碱诱导的阿尔茨海默病小鼠模型的记忆功能障碍具有较好的改善作用,可通过降低炎症因子TNF-α、IL-6 水平延缓神经炎症引起的海马亚区和前额叶皮层神经元细胞凋亡过程。载脂蛋白4 (ApoE4) 作为当前阿尔茨海默病发病机制的研究热点,其主要在肝脏和中枢系统生成,最新研究发现,肝脏途径生成的ApoE4 还可通过破坏脑血管功能及加速Aβ淀粉样沉积从而损害神经突触的可塑性[45]; 神经系统星状胶质细胞衍生的ApoE4 可加速血脑屏障的破坏[46],抑制海马神经元树突和突触形成所需的胆固醇生成[47],加剧认知功能的凋败。Mountaki 等[48]研究表明,槲皮素可通过降低ApoE4 基因表达,抑制神经元细胞对Aβ42的摄取和氧化应激反应,但该研究仅进行了初步探讨,目前以肝脏和神经系统双途径生成的ApoE4 为靶点发挥抗阿尔茨海默病作用天然活性药物的研究极少,因此相关药物和具体的作用机制仍需要深入的筛选和发掘。
2.4 当归 当归是伞形科草本植物当归Angelicasinensis(Oliv.) Diels 的干燥根[28],性温润燥,味辛散上扬,归肝、心、脾经,既可行血通滞,又可补血濡虚,为“血中之气药”,其气血同调之功效可对应治疗阿尔茨海默病病机“瘀阻脑络症”[49]。
现代药理学研究表明,当归所富含的功效成分当归多糖、阿魏酸、藁本内酯均对阿尔茨海默病有较好的药效作用。王虎平[50]研究发现,当归挥发油可剂量依赖性地提高阿尔茨海默病大鼠血清中乙酰胆碱(Ach) 水平,并降低海马组织MDA、APP、Aβ1-42水平,缩短阿尔茨海默病大鼠在水迷宫内的逃避潜伏期和首次达到原平台的潜伏期,提升其学习记忆能力。Kudoh 等[51]的一项多中心、随机、双盲临床实验结果表明,含有阿魏酸和当归提取物的膳食补充剂对于轻度认知障碍(MCI) 具有明显的治疗作用。Du等[52]发现当归多糖可通过激活脑源性神经营养因子-原肌球蛋白相关受体kinase B-环磷腺苷效应元件结合蛋白(BDNF/TrKB/CREB) 途径降低神经炎症相关因子的参数,从而缓解氧化应激反应,减少神经元细胞凋亡数量。阿魏酸是当归的特征性酚酸类有效成分,具有抗神经炎症和抗氧化应激作用,被广泛应用于啮齿类动物的阿尔茨海默病实验中,目前已有大量研究结果表明阿魏酸对阿尔茨海默病具有显著的治疗作用[53]。Wang 等[54]研究发现,阿魏酸可结合内皮素受体-A (ETRA) 以抵消内皮素-1 (ET-1)介导的脑毛细血管收缩,改善小鼠海马毛细血管密度和直径的降低,从而显著缓解海马组织内的Aβ 斑块沉积。许英等[55]在稳定表达人APP 蛋白的体外模型SH-APP 细胞中初步考察了阿魏酸的抗阿尔茨海默病作用,研究证实阿魏酸能够抑制Aβ 分泌,并通过调节磷酸化GSK-3β 蛋白及抑制促凋亡蛋白caspase-9 表达从而提高细胞活力发挥神经保护作用。藁本内酯是当归中含量较高的挥发油成分之一,具有抗炎、抗氧化应激、抗凋亡、改善神经元功能及血脑屏障通透性等作用,其分子量小,分子极性表面积小,对血脑屏障穿透力强,口服利用度较高,是改善中枢神经损伤疾病极具潜力的天然活性成分[56]。Zhao 等[57]研究发现,藁本内酯可通过上调肝脏激酶B1-腺苷酸活化蛋白激酶-哺乳动物雷帕霉素靶蛋白(LKB1-AMPK-mTOR) 通路增强细胞自噬功能及线粒体活性,从而抑制具有神经元细胞特征的氧葡萄糖剥夺/再灌注PC12 细胞的凋亡。藁本内酯的抗阿尔茨海默病作用在动物实验中也有验证,快速老化痴呆模型小鼠(SAMP8) 与人类阿尔茨海默病的病理特征和行为症状具有很高的一致性。Zhu 等[58]研究发现,藁本内酯可通过调节线粒体融合与分裂蛋白 (Mfn1、Mfn2、PDrp1) 动态平衡,从而预防SAMP8 小鼠海马神经元细胞的线粒体损伤,缓解氧化应激反应引起的细胞凋亡。
综上所述,逍遥散全方及其主要活性成分对阿尔茨海默病具有多方位的药理作用,此外,方中甘草及其活性成分也对阿尔茨海默病具有较为明显的防治作用,逍遥散抗阿尔茨海默病的具体机制见图1 所示[59-81]。
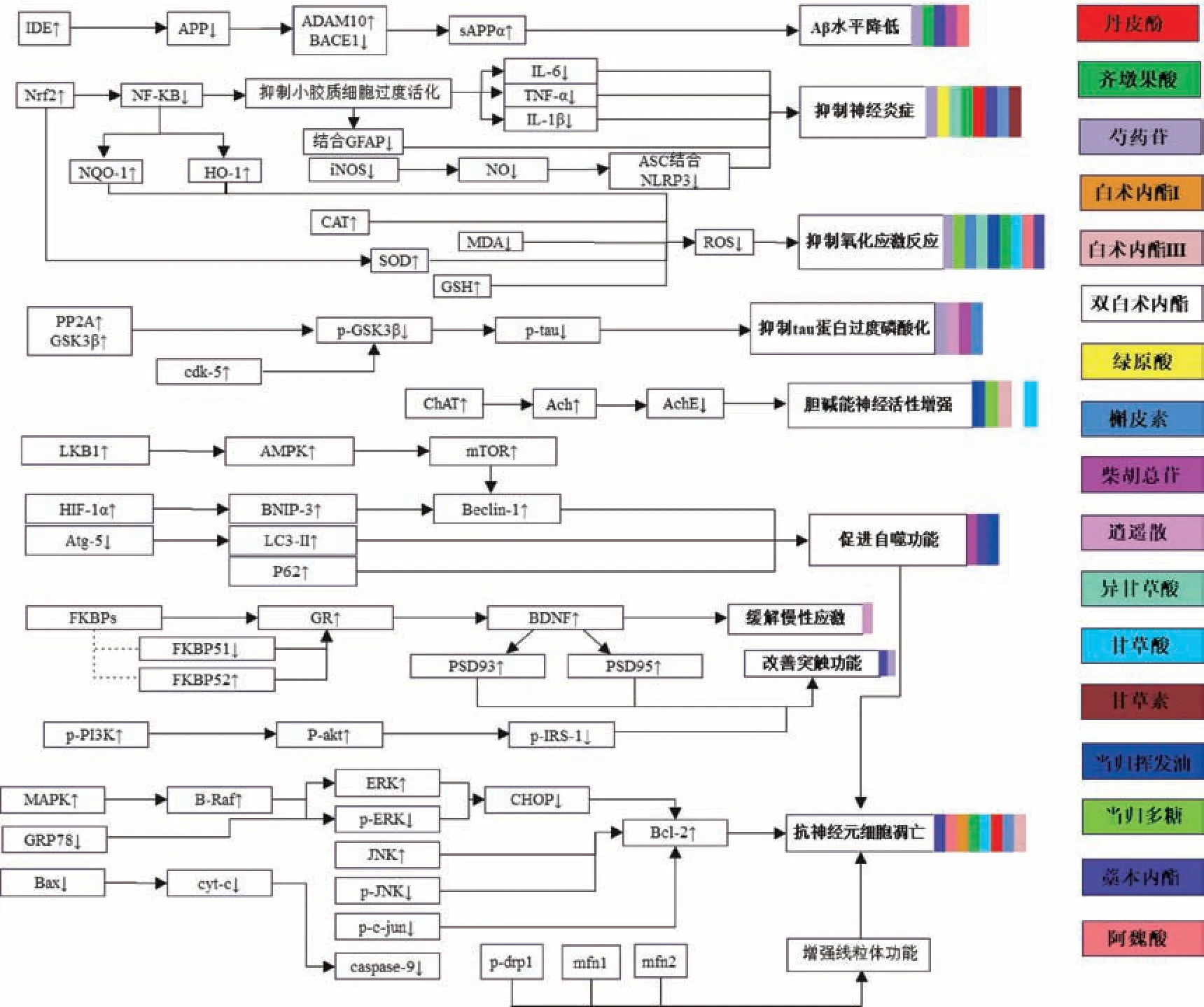
图1 逍遥散及其主要活性成分抗阿尔茨海默病作用机制
3 结语与展望
逍遥散及其活性成分可通过减少Aβ 沉积、抑制Tau 蛋白过度磷酸化、抑制神经元细胞凋亡、改善神经炎症、调节自噬、减轻氧化应激等多种途径协同发挥抗阿尔茨海默病作用,具有广阔的开发及应用前景。然而,现阶段的研究仍显不足。
中药药理成分的杂泛性赋予了中药复方多靶点协同起效的优势,但也造成了具有针对性的天然药物活性成分难以筛选的难题。逍遥散治疗阿尔茨海默病的起效形式及各成分之间的相互影响尚不明晰,其作用机制与量效关系仍然难以完全阐明,缺乏定量指标和给药依据,现阶段在关于逍遥散治疗阿尔茨海默病的临床研究中,用法用量仍非常具有主观性,使其治疗应用受到限制。
肝性脑病及肝脑轴的病理学联系为探究疏肝解郁类中药以系统生物学角度论治阿尔茨海默病提供了启示,逍遥散对阿尔茨海默病及其相关诱因性疾病如抑郁症、非酒精性脂肪肝、2 型糖尿病等均有较好的治疗作用,可有效降低外周及中枢系统阿尔茨海默病致病因子及通路的表达,从而发挥对阿尔茨海默病疾病过程的整体调控作用。但目前其大部分研究重点仅指向神经系统,未能揭示其对阿尔茨海默病系统性的疾病起源以及广泛的共病基础的影响,中药及逍遥散对阿尔茨海默病的调控机制仍有待挖掘。因此,如果能将阿尔茨海默病的中医分证病理与现代病理学相联系统一,将进一步拓宽中药对于阿尔茨海默病临床治疗的应用思维,同时也将为中医药疏肝健脾法防治阿尔茨海默病提供更广阔的可能途径。
经典名方凝聚着祖国中医药文化传承数千年以来的智慧结晶,随着中医药现代化进程的不断推进,生物组学、指纹图谱、网络药理学、分子印迹技术、分子对接技术等现代技术及研究方法与传统中医药研究日益融合,必将推动中药复方抗阿尔茨海默病作用的研究与传统制剂的二次开发,加快中医药现代化的脚步,传扬中医药的文化精髓。

