海藻酸钠/粉煤灰沸石复合微球的制备及其吸附性能
康 华, 徐佳辉
(黑龙江科技大学 矿业工程学院, 哈尔滨 150022)
0 引 言
粉煤灰(FA)是磨成一定细度的粉煤在粉煤炉中经过高温燃烧,由烟道气带出并经除尘器收集的粉尘。我国发电厂的燃料以煤炭为主,1 t原煤的燃烧会产生250~300 kg的粉煤灰,截至2021年,我国粉煤灰累计堆积量已达31亿t。随着近年来“绿色”观念、“双碳”目标的影响愈加广泛,加大粉煤灰的利用力度,迫在眉睫。目前,粉煤灰的综合利用包括农田坑洼低地、煤矿塌陷区及矿井的回填低技术利用;分选微珠,漂珠用作保温材料、耐火材料、橡胶填料的中端技术利用;以及制备分子筛、催化剂、高温耐火陶瓷等高附加值利用[1]。
沸石(Zeolite)作为分子筛的典型代表,是一种具有空旷骨架和较规则孔笼结构的含碱金属或碱土金属氧化物的硅铝酸盐材料,具有吸附、催化、离子交换、框架支撑等功能,并广泛应用于负载催化剂及水体污染物吸附等方面[2-3]。利用粉煤灰作为硅铝源合成沸石分子筛,不仅降低了分子筛合成的成本,而且能够实现工业废物的高值利用。
海藻酸钠(SA)是海带、马尾藻和海藻等褐藻经微生物发酵提取出的一种天然多糖,其分子由 β-D-甘露当醛酸(M)和 α-L-古罗糖醛酸(G)残基组成通过 1, 4-糖苷键连接[4]而成。海藻酸钠可以与多价金属阳离子螯合交联形成凝胶状、膜状或纤维状的材料,但由于其为线性分子链,链间不能有效缠结,使得海藻酸盐纤维材料结构疏松、溶胀易破裂而缺乏强度和弹性,难以实现复杂的三维结构和较高的力学强度,在很大程度上影响其更广泛的应用[5]。因此,使用沸石与海藻酸钠共混制备吸附剂,既可以解决海藻酸钠制备微球的结构疏松,溶胀易破裂等缺点[2],又解决了粉煤灰沸石单独使用后难以回收的缺点,极大地减少水处理成本。笔者拟使用海藻酸钠与粉煤灰制备的沸石共混,制备出一种具有吸附能力的二元微球,利用SEM、FTIR和XRD等对其进行结构表征,并使用亚甲基蓝(MB)模拟染料废水研究并分析其吸附性能。
1 实 验
1.1 仪器与材料
BT224S电子分析天平;SHZ-DIII循环水式真空泵; DF-101S集热式恒温加热磁力搅拌器;DHG-9070A 电热鼓风干燥箱;Bruker D8 Advance X射线衍射仪;760CRT紫外可见光谱仪;ABB MD104 傅里叶变换红外光谱仪;泰思肯离子双束电镜 (SEM) ;KL05A离心机;反应釜。
粉煤灰(河南巩义大唐火电厂),盐酸(分析纯);氢氧化钠(分析纯);海藻酸钠(分析纯);氯化钙(分析纯);亚甲基蓝(分析纯);无水乙醇(分析纯);去离子水。
1.2 样品制备与吸附设置
1.2.1 粉煤灰基沸石的制备
取一定质量的FA置于500 mL的烧杯中,以10∶1的液固比加入3 mol/L的HCl溶液,用保鲜膜加以密封,置在磁力搅拌器上恒温搅拌1 h,用去离子水冲洗,在95 ℃下烘干,过200目筛,保存备用。酸洗后的FA与粉末状固体氢氧化钠以1.2∶1的灰碱比在密封袋内混匀,在马弗炉内650 ℃下焙烧2 h,待冷却后,将熔融物研磨备用。在100 mL烧杯中依次放入熔融物和去离子水,调节NaOH浓度为2 mol/L,室温下搅拌陈化3 h,然后整体移入反应釜中,在烘箱内90 ℃反应9 h,反应釜完全冷却后取出。使用去离子水冲洗至中性,放入烘箱干燥后研磨,得到粉煤灰制备的沸石(ZFA)。
1.2.2 海藻酸钠/粉煤灰沸石复合微球的制备
首先,将1 g海藻酸钠加入50 mL去离子水中,放置在搅拌器上80 ℃下恒温搅拌2 h,形成SA溶液,待其冷却至60 ℃时加入1~4 g ZFA,充分搅拌形成均匀悬浮液。在保证悬浮液不连成串的滴速下,用5 mL注射器吸取悬浮液并滴入20 g/L的CaCl2溶液中钙化1 h,将钙化后的水凝胶微珠多次冲洗,洗去表面的CaCl2,在60 ℃恒温烘干至恒重,制得海藻酸钠/粉煤灰沸石复合微球。根据使用ZFA的质量为1~4 g,将复合微球标记为xZFA-SA(x=1、2、3、4)。同时制取不含ZFA的单一海藻酸钠一元微球,标记为SA微球。复合微球吸附剂的制备过程如图1所示。吸附剂外观如图2所示。
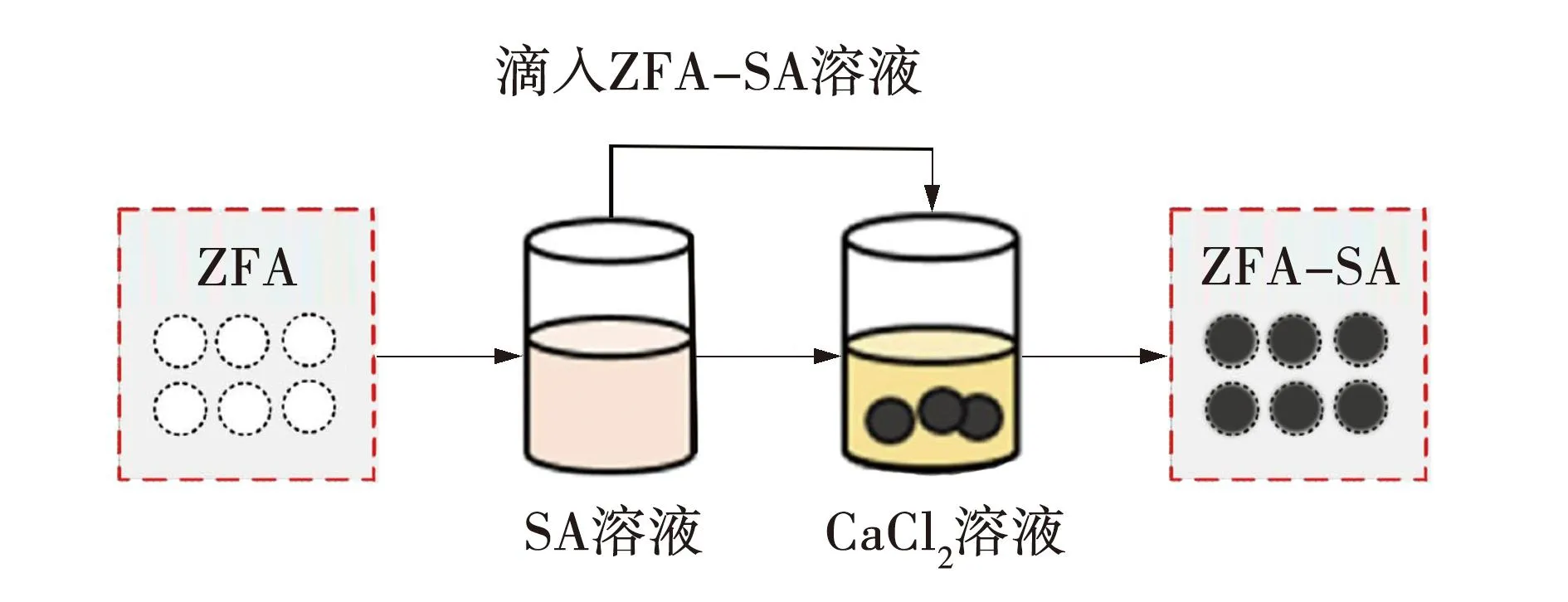
图1 复合微球吸附剂的制备Fig. 1 Preparation of composite microsphere adsorbent

图2 吸附剂外观Fig. 2 Adsorbent appearance
1.2.3xZFA-SA吸附测试
根据实验条件,将不同质量浓度(20~300 mg/L)的待吸附亚甲基蓝(MB)溶液与不同质量(1~6 g/L)吸附剂投加到烧杯中,置于恒温磁力搅拌器上不同温度(25~45 ℃)下搅拌不同时间(10~120 min),离心分离后,用装有22 μm水系滤膜的注射器吸取清液,装入5 mL的离心管。使用可见光分光光度计在λmax=664 nm处测定的吸光度,计算吸附后清液中的MB浓度。染料的去除率R和吸附量Q[6-7]分别为
其中:ρ0——溶液的初始质量浓度,mg/L;
ρt——溶液在t时刻的质量浓度,mg/L;
V——溶液的体积,L;
m——吸附剂的质量,g。
2 结果与分析
2.1 复合微珠的结构表征
2.1.1 XRD分析
实验原样FA、制备样品ZFA和3ZFA-SA复合微球的XRD图,如图3所示。图3中2θ为6.12°、15.62°、23.38°、26.5°、30.92°、40°、60°处有明显的尖峰,其中2θ为26.5°处为石英的衍射峰,2θ为40°、60°处为莫来石的衍射峰,2θ为6.12°、15.62°、23.38°和30.92°处为沸石的衍射峰。FA经碱熔融水热合成ZFA,FA中石英、莫来石的衍射峰不断减弱,甚至消失,沸石的衍射峰逐渐增加。这是因为FA在熔融阶段,高温使得结晶的石英与莫来石活化,与NaOH发生反应,生成硅铝酸盐等化合物。相比于ZFA,3ZFA-SA复合微球中沸石的衍射峰不变,强度略有下降,没有新的衍射峰出现,表明在复合过程中,沸石结晶度有所下降,但没有新的物相生成[8-10]。

图3 FA、合成ZFA和3ZFA-SA复合微球的XRD图Fig. 3 XRD patterns of FA, synthetic ZFA and 3ZFA-SA composite microspheres
2.1.2 SEM分析
图4为实验原样FA、制备样品ZFA和3ZFA-SA复合微球的SEM图,如图4所示。原样FA表面平整,大小不一,多数呈规则的球状或椭球状(图4a);粉煤灰基沸石ZFA晶体分布均匀,形貌规整,整体呈现较为明显的八面体结构(图4b);与海藻酸钠复合后可以明显到原本规则单个颗粒杂乱地结合在一起,形成大块的团聚物,团聚物表面疏松,沟壑结构明显[11-13](图4c、d)。

图4 SEM图Fig. 4 SEM images
2.1.3 FTIR分析
图5是实验原样SA、制备样品ZFA和3ZFA-SA复合微球的FTIR图。ZFA的图像中,400~800 cm-1处,出现有硅铝晶格变形振动以及混合振动形成的峰,证明样品中有沸石的存在。3ZFA-SA图像中,原本属于沸石的特征峰几乎没有发生变化,在2 901 cm-1和1 387 cm-1处分别观察到了C-H和C-N的拉伸峰,这两处特征峰在SA的图像中也可以观察到,其中C-H基团变化明显[14-15],证明SA与ZFA复合成功。
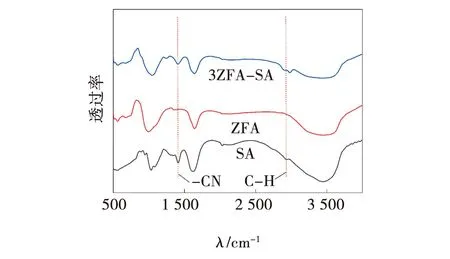
图5 SA、合成ZFA和3ZFA-SA复合微球的FTIR图谱 Fig. 5 FTIR diagram of SA, synthetic ZFA and 3ZFA-SA composite microspheres
2.2 复合微球吸附性能评价与优化
2.2.1 复合微球组成
在常温下,配置50 mL初始质量浓度为100 mg/L的MB溶液,吸附剂投加量为2 g/L,研究复合微球xZFA-SA的组成对MB的吸附量Q与去除率R的影响。复合微球的组成对吸附效果的影响,如图6所示。

图6 复合微球组成对MB吸附效果的影响Fig. 6 Influence of composition of composite microspheres on adsorption of MB
由图6可知,复合微球的吸附性能介于单一微球SA与ZFA之间,并随着ZFA所占比重的增加,吸附量Q与去除率R的增长呈先上升后平缓的趋势,说明ZFA在吸附过程中起到决定性作用。其中3ZFA-SA的吸附量为46.2 mg/g,去除率为92.4%,此后ZFA含量增加,吸附性能再无明显变化,这可能是因为吸附过程中,吸附位点由位于微球表面的ZFA所提供,虽ZFA含量有所增加,但微球表面积有限,吸附位点几乎不变。同时,由图6还可以观察到,复合微球的吸附性能均低于ZFA,这是由于与SA复合后的微球样品比表面积低于ZFA粉末状样品,同时SA也有可能导致ZFA孔道堵塞。因此考虑到资源的有效使用,后续实验选用3ZFA-SA6。
2.2.2 溶液初始质量浓度
在100 mL烧杯中,分别配置50 mL初始质量浓度为20、50、100、150、200、250、300 mg/L的MB溶液,3ZFA-SA的投加量为2 g/L,在常温下,吸附120 min,取清液,测量吸光度计算吸附量Q与去除率R,根据计算结果绘制吸附性能曲线,如图7所示。
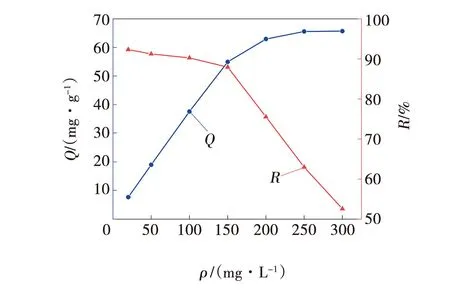
图7 溶液初始质量浓度对3ZFA-SA吸附性能的影响Fig. 7 Effect of initial solution concentration on adsorption performance of 3ZFA-SA
由图7可知,随着MB浓度的升高,吸附量Q逐渐升高,但去除率R逐渐下降,在150 mg/L处出现明显转折点。这是因为吸附剂投加量一定,所提供的吸附位点有限,随着MB浓度的升高,染料分子数量增多,吸附达到饱和,造成吸附剂对MB的去除率R反而降低。
2.2.3 吸附剂投加量
在100 mL烧杯中,配置50 mL初始浓度为150 mg/L的MB溶液,3ZFA-SA的投加量依次为1、2、3、4、5、6 g/L,在常温下,吸附120 min,取清液,测量吸光度计算吸附量Q与去除率R,根据计算结果绘制吸附性能曲线,吸附剂投加量对3ZFA-SA吸附性能的影响,如图8所示。
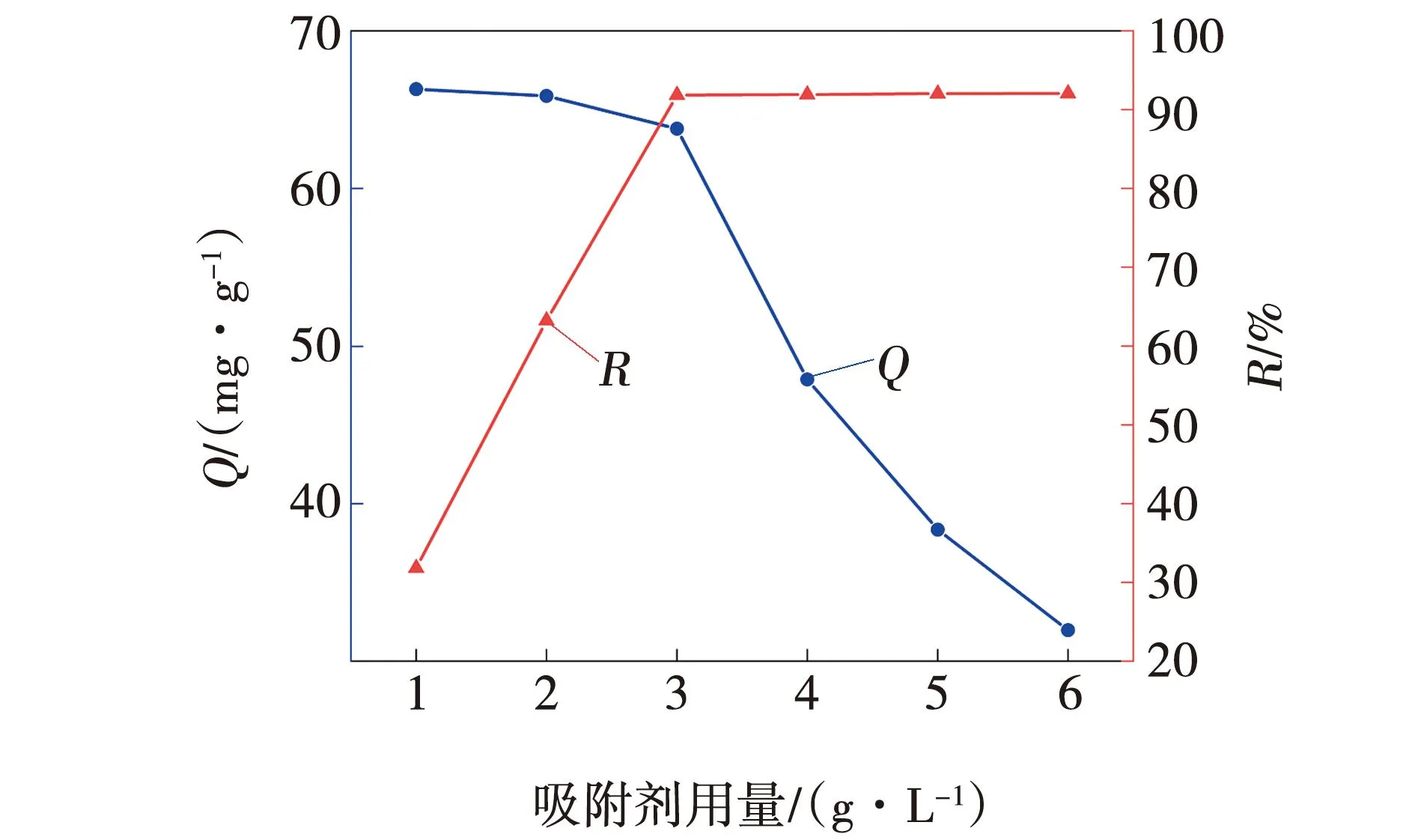
图8 吸附剂投加量对3ZFA-SA吸附性能的影响Fig. 8 Influence of adsorbent dosage on adsorption performance of 3ZFA-SA
由图8可知,随着吸附剂投加量的增加,吸附量Q逐渐下降,去除率R先增加然后趋于平缓。这是由于溶液浓度一定,吸附剂的增加使得染料分子有更多可供吸附的位点,吸附量Q下降,但去除率R整体增加。去除率在3 g/L处有明显转折点,因此,在后续实验中吸附剂投加量选择3 g/L。
2.2.4 温度与时间
取6个100 mL烧杯一组,配置50 mL初始浓度为150 mg/L的MB溶液,3ZFA-SA投加量为3 g/L,在磁力搅拌器上搅拌,控制温度为25 ℃,分别在10、20、30、60、90、120 min时,离心取清液,测定吸光度。在35 ℃与45 ℃下重复操作,绘制吸附量在不同温度下随时间变化曲线,如图9所示。
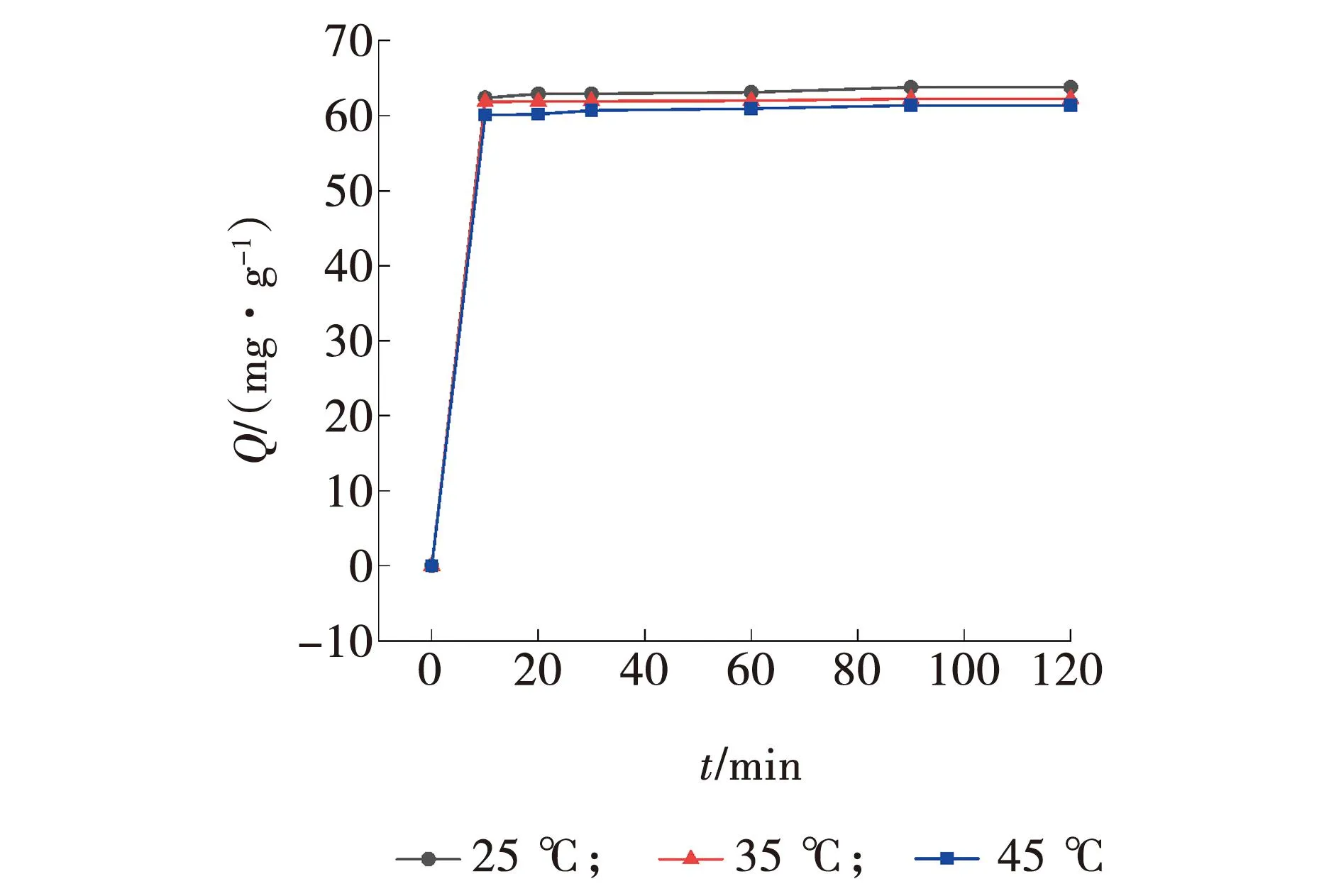
图9 温度、时间对3ZFA-SA吸附性能的影响Fig. 9 Effects of temperature and time on adsorption performance of 3ZFA-SA
由图9可知,随着吸附时间的不断延长,吸附剂对MB的吸附量Q逐渐增加,在0~10 min内,吸附量Q变化较快,在10 min后,吸附量Q增长平缓,至90 min时,吸附达到饱和,不再发生变化,且在之后的30 min内,没有脱附现象发生。温度对吸附剂吸附效果的影响较小,25 ℃为最佳吸附温度,随着温度的升高,吸附量Q略有下降。这是因为吸附为发热过程,温度的升高反而不利于吸附的进行[16]。出于经济效益的考虑,最佳吸附时间应为10 min。但为了后续实验研究,统一选择90 min作为吸附时间,让吸附达到饱和状态。
2.2.5 溶液pH值
在100 mL烧杯中加入7.5 mL浓度为1 g/L的MB溶液,加入去离子水37.5 mL,用HCl与NaOH标准滴定溶液调节杯中溶液pH值分别调至2、4、6、8、10、12,观察溶液体积,不足50 mL处用去离子水补充。在6个烧杯中均加入0.15 g 3ZFA-SA,整体置于恒温磁力搅拌器上,常温下吸附90 min,取清液,测量吸光度计算吸附量Q与去除率R,据计算结果绘制吸附性能曲线,如图10所示。
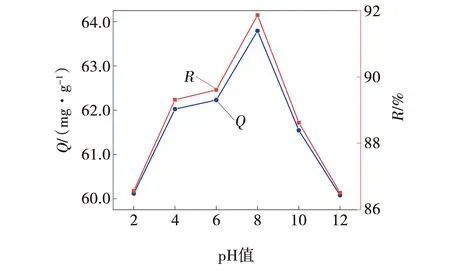
图10 溶液pH对3ZFA-SA吸附性能的影响Fig. 10 Effect of solution pH on adsorption properties of 3ZFA-SA
由图10可知,在过酸过碱的条件下,3ZFA-SA的吸附效果不佳,酸性条件整体略优于碱性条件,中性条件下更有利于吸附的发生。吸附量Q的变化范围不超过5 mg/L,说明吸附剂不具备pH敏感性,可广泛应用于各种pH下。在溶液pH=8处,吸附量Q与去除率R达到最大值,分别为63.79 mg/g、91.86 %。这与不加干预,直接取10 mL浓度为1 g/L的MB溶液,加入40 mL去离子水,测定pH=7.68时测得数据相近。这是因为在酸性条件下,溶液中H+含量较高,染料分子与H+相互竞争占据吸附剂表面的吸附位点,导致脱色率与吸附量Q降低[17-19];随着pH的逐渐升高,带正电染料分子与带负电的吸附剂可以发生静电相互作用,导致吸附剂吸附能力的上升;而在碱性条件下,MB随着pH的增加吸附量Q减少,说明此吸附剂对MB的吸附过程更为复杂,pH可能会影响吸附剂表面所带电荷,或者改变染料分子的电离程度[20]。
2.2.6 复合微球3ZFA-SA的吸附-脱附循环
取100 mL的无水乙醇,将完成吸附的3ZAF-SA置于其中,常温下静置3 h,过滤,用去离子水多次冲洗,放入烘箱中干燥至恒重,得到脱附后的吸附剂。在MB溶液初始浓度为100 mg/L,吸附剂投加量为2 g/L的条件下,分别测定3ZFA-SA脱附次数为1、2、3、4、5次时清液的吸光度,并计算吸附量Q,绘制相应柱状图如图11所示。

图11 循环次数对3ZFA-SA吸附性能的影响Fig. 11 Influence of number of cycles on adsorption performance of 3ZFA-SA
由图11可知,随着循环次数的增加,吸附剂的吸附能力有所下降,由最初未脱附时吸附量46.2 mg/g下降至39.8 mg/g,但总体吸附性能仍较高,证明复合微球具有循环利用的潜能。在复合微球的吸附-脱附循环实验后,微球的粒径有明显降低,说明在循环使用过程中,微球上的ZFA不断在脱落,如何维持复合微球的机械稳定性是后续研究的重要问题[5,13]。
2.3 复合微球吸附行为
2.3.1 吸附等温线
吸附等温线是指在同一温度下,吸附质在两相界面上吸附达到平衡时其在两相中浓度之间的关系曲线,一般有两种常见的形式,一种为Langmuir等温式,其一般形式为
其中:Qe——平衡时吸附量,mg/g;
Qm——吸附剂最大吸附量,mg/g;
ρe——平衡时溶液浓度,mg/L;
ρo——初始溶液浓度,mg/L;
Kl——常数;
Rl——分离因子。
另一种为Freundlich等温式,其一般形式为
式中:ρe——平衡时溶液浓度,mg/L;
Kf——吸附容量指标;
n——吸附强度参数。
实验温度为25 ℃时,在MB初始溶液浓度为20~300 mg/L、3ZFA-SA投加量为2 g/L、吸附时间为120 min的条件下,采用Langmuir模型和Freundlich模型[21-22]对实验数据进行线性拟合,评估3ZFA-SA对染料MB吸附的吸附等温线特性,结果见图12与表1。
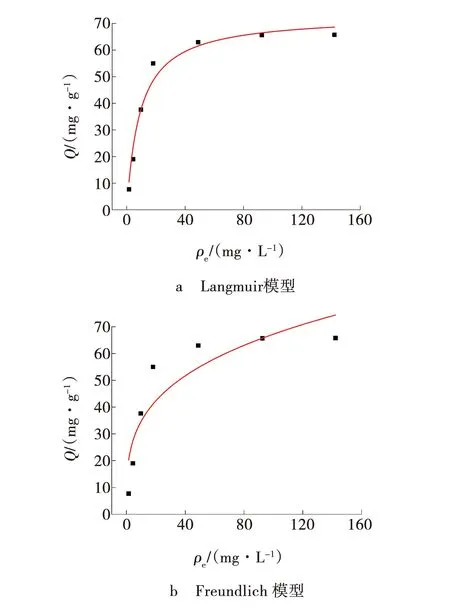
图12 3ZFA-SA对MB吸附的等温拟合曲线Fig. 12 Isothermal fitting curve of adsorption of MB by 3ZFA-SA
由图12、表1可知,Langmuir模型的相关系数R2(0.971)大于Freundlich模型的R2(0.798),表明Langmuir模型更适合描述3ZFA-SA对MB的吸附行为,3ZFA-SA对MB的吸附属于单分子层吸附;Rl的数值为0.029~0.313,介于0~1之间,表明该吸附反应过程是有利的。
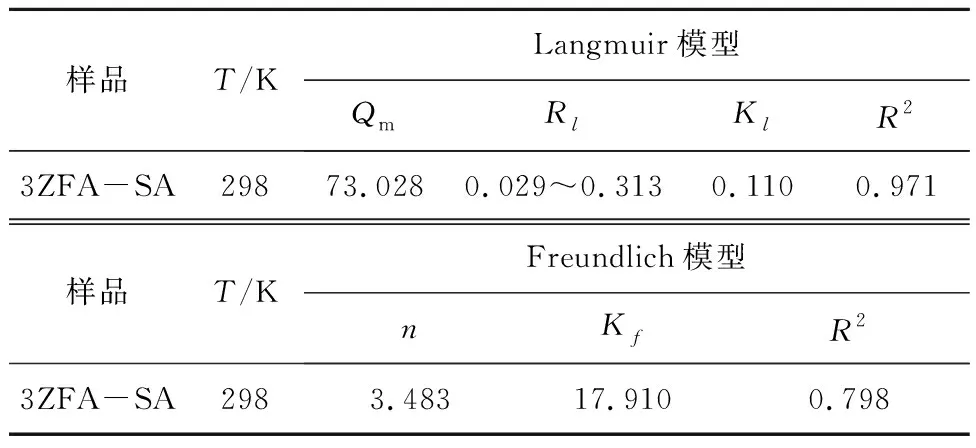
表1 3ZFA-SA对MB吸附的两种等温线模型参数
2.3.2 吸附动力学
吸附动力学是以研究吸附、脱附速度及各种影响因素为主的分支学科,表示反应速度与参与反应的物质浓度之间的关系,常见的有准一级、准二级动力学模型。
准一级动力学模型为
式中:Qe——平衡时吸附量,mg/g;
Qt——t时刻时吸附量,mg/g;
k1——准一级动力学速率常数。
准二级动力学模型为
式中,k2——准二级动力学速率常数。
实验温度为25 ℃时,在MB初始溶液浓度为150 mg/L,3ZFA-SA投加量为3 g/L,吸附时间120 min的最佳吸附实验条件下,采用准一级、准二级动力学模型[23-24]对实验数据进行线性拟合,进而评估3ZFA-SA对染料MB吸附的动力学特性,结果见图13与表2。
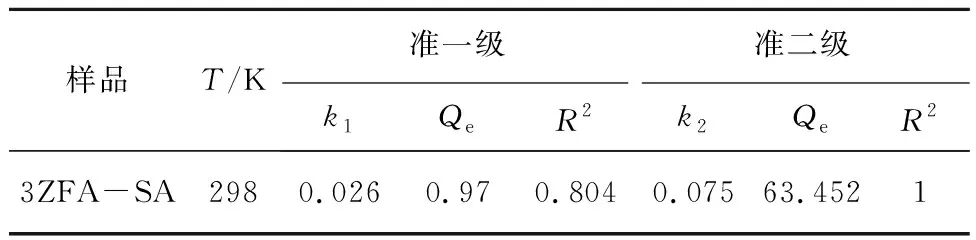
表2 3ZFA-SA对MB吸附的准一级和准二级动力学参数
从图13、表2可以看出,准一级动力学吸附模型的相关系数R2(0.804)小于准二级动力学的R2(1)。准二级动力学计算所得Qe(63.452 mg/g)与实验测得数据Qe(63.343 mg/g)极为接近,表明准二级动力学能够更好地描述3ZFA-SA对MB的吸附行为。
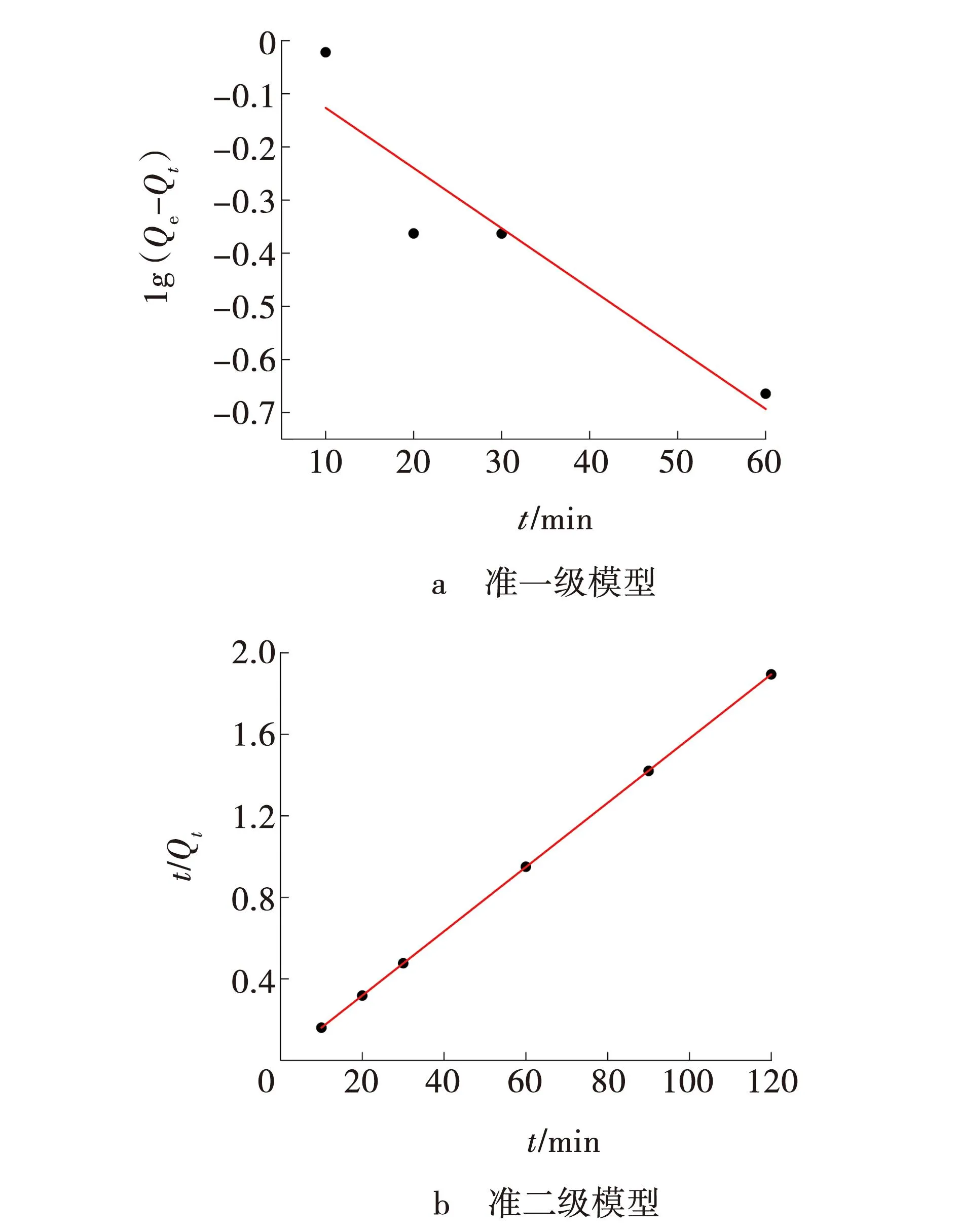
图13 3ZFA-SA对MB吸附的动力学模型Fig. 13 Kinetic models for adsorption of MB by 3ZFA-SA
3 结 论
(1)XRD分析结果表明,3ZFA-SA复合微球与ZFA特征衍射峰一致,因此ZFA与SA的复合过程中没有新的物相生成。FT-IR图谱中,与SA和ZFA相比,3ZFA-SA中没有新的特征峰出现,因此可以判断在形成微球的过程中没有发生化学反应,复合过程为简单的物理复合。
(2)在温度为25 ℃、MB溶液的初始浓度为150 mg/L,3ZFA-SA投加量为3 g/L、pH为8的条件下,吸附90 min可达饱和状态,最大吸附量和去除率为63.79 mg/g和91.86 %,并在吸附五次循环后对MB仍有较高的吸附能力,表明3ZFA-SA具有良好的可重复使用性。
(3)3ZFA-SA对于MB吸附的等温线拟合更符合Langmuir等温吸附模型,表明该吸附现象主要为单分子层吸附;动力学拟合更符合准二级动力学模型,表明该吸附过程同时包含化学与物理两种吸附行为。

