EDTA间接滴定法快速检测CO2吸收液中碳酸氢根与碳酸根总量的研究
李取超,殷国栋,姚国栋,朱宁正,Marta Sibhat,周仰原,赵建夫
(1.同济大学 环境科学与工程学院,上海 200092;2.上海洗霸气候科学技术有限公司,上海 200091)
2022年我国CO2排放量超过100 × 108t,CO2捕集、利用与封存(CCUS)技术是减少CO2排放的重要途径,尤其是利用碱性溶液吸收CO2的化学吸收法是目前应用相对广泛且成熟的CCUS技术[1-2]。CO2化学吸收法常用的碱性溶液包括有机醇胺、氨水、氢氧化钠、氢氧化钾和氢氧化钙溶液等,其中以含钙碱性溶液吸收CO2生成CaCO3的化学吸收方法也称矿化技术,是CCUS技术领域的研究重点之一[3-4]。燃煤电厂是CO2排放重点企业,其脱硫产生的大量碱性脱硫废水(简称“脱硫废水”),需用盐酸将pH值调至中性才能排放。如果利用脱硫废水作为CO2吸收液捕集燃煤电厂排放的CO2,可以达到减污降碳、协同增效的目标。如果吸收反应过程不产生CaCO3等沉淀,通常可以利用反应前、后溶液中碳酸氢根和碳酸根总量的变化情况确定CO2吸收量。
常用的测定碳酸氢根和碳酸根的方法主要有酸碱指示剂滴定法[5]、电位滴定法、紫外分光光度法、离子色谱法、双电极法和电感耦合等离子体原子光谱法等[6]。酸碱指示剂滴定法操作相对简便,但碳酸根与碳酸氢根的相互转化不稳定,且第一突变点酚酞褪色时间长,实验操作对测定结果影响较大[7]。采用电位滴定法测定碳酸根和碳酸氢根的相对含量可以避免滴加指示剂产生的颜色干扰,但易受水中杂质干扰[8]。詹文毅等[9]在采用紫外分光光度法直接测定硫酸根的研究中发现虽然碳酸氢根和碳酸根分别在193.2 nm和198.0 nm紫外光处有吸收,但吸收峰较缓,说明该方法不适用于碳酸氢根和碳酸根的测定。离子色谱法能快速检测溶液中碳酸氢根和碳酸根的含量,抗干扰能力强,但测定结果会受到溶液中氯离子和硫酸根的影响[10]。双电极法可实现对水中碳酸氢根和碳酸根现场采样后的快速测定,但金属离子(如K+、Mg2+)和阴离子(如Cl-、SO2-4)质量浓度较高时对测定结果有影响[11]。电感耦合等离子体原子光谱法通过测定CO2体积分数间接测定溶液中碳酸氢根和碳酸根的质量浓度,此法对待测溶液中盐类的控制要求较高,对组分复杂的溶液不适用。脱硫废水中的Cl-、SO2-4、Ca2+和Mg2+等质量浓度高、组分复杂,并且其在吸收CO2后形成的碳酸盐体系不稳定,碳酸氢根离子质量浓度随时间变化明显。因此,在对脱硫废水吸收CO2后形成的混合溶液中的高质量浓度碳酸根和碳酸氢根进行现场快速测定时,需要新的定量方法。
为此,本文开展针对脱硫废水中CO2吸收量的快速定量方法的研究,首先通过调节溶液pH值将待测CO2吸收液的碳酸氢根转化为碳酸根,然后加入过量Ca2+与碳酸根完全反应生成CaCO3沉淀析出,根据EDTA滴定法[12]测定反应前后溶液中的Ca2+质量浓度,计算溶液中碳酸氢根和碳酸根的总量(以碳酸根计),从而确定CO2吸收量。调节pH值可以将碳酸氢根完全转化为碳酸根,避免碳酸根和碳酸氢根之间的不稳定转化对测定结果的影响,同时也可以使溶液中的重金属离子和镁离子转化为氢氧化物形式的沉淀,避免其对测定结果的影响。EDTA滴定法测定Ca2+方法成熟稳定,因此通过EDTA间接滴定法实现CO2吸收液中碳酸氢根和碳酸根总量的快速定量检测具有可行性。在本研究中,使用外标法通过测定含碳酸氢根和碳酸根的系列标准溶液,拟合标准曲线,由测定结果与真实值间的相关系数和线性范围判断此测定方法的准确性与测定范围。同时通过测定不同脱硫废水CO2吸收液中碳酸氢根和碳酸根的总量,对测定结果进行验证。以上海某电厂脱硫废水和含CO2烟气作为工程试验对象,采用本文设计的方法检测并计算脱硫废水的CO2吸收量。
1 实验部分
1.1 实验仪器与试剂
数显控温磁力搅拌器(型号MPLR-702,常州市金坛大地自动化仪器厂);pH计(型号PHS-2F,上海仪电科学仪器股份有限公司)。
NaHCO3,分析纯,上海国药化学试剂有限公司;Na2CO3,分析纯,上海国药化学试剂有限公司;CaCl2溶液(300.0 g/L)、NaOH溶液(1.00 mol/L)、HCl标准溶液(0.05 mol/L)、KOH溶液(200.0 g/L)和三乙醇胺溶液(三乙醇胺和去离子水的体积比为1:2),所有溶质均为分析纯,上海国药化学试剂有限公司;钙羧酸指示剂(0.2 g钙羧酸与100.0 g氯化钾混合研磨)、EDTA标准溶液(0.01 mol/L)、酚酞的乙醇溶液(10.0 g/L)和甲基橙溶液(0.5 g/L),均为分析纯,上海国药集团化学试剂有限公司。
1.2 标准溶液制备与水样采集
标准溶液制备:用分析天平称取定量的碳酸氢钠和碳酸钠,配制一系列不同离子质量浓度的碳酸氢根标准溶液(系列A)、碳酸根标准溶液(系列B)、碳酸氢根和碳酸根混合标准溶液(系列C),同一系列标准溶液根据离子质量浓度对应编号为1~6,见表1。

表1 系列标准溶液Table 1 Series standard solutions
水样采集:CO2吸收液水样来自上海某发电厂碳捕集与资源化工艺,分别采集3个不同工艺段水样,依次编号为1、2和3。该工艺以电厂脱硫废水作为CO2吸收液,连续30 d每天定时进行脱硫废水采样分析,水质分析结果见表2。
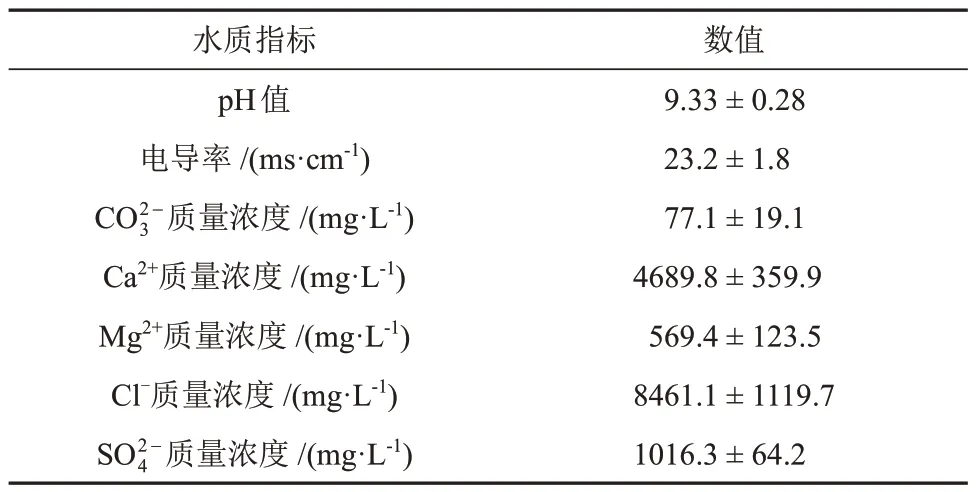
表2 CO2吸收液水质分析结果Table 2 Water quality analysis results of CO2 absorbent solution
1.3 测定原理与方法
碳酸根测定原理为碳酸根同过量的Ca2+完全反应生成CaCO3沉淀,经测定2500 mg/L的碳酸根标准溶液pH值为11.57,在此条件下Mg2+以Mg(OH)2形式完全沉淀,因此可在待测水样中滴加NaOH溶液至pH值为11.60,使碳酸氢根全部转化为碳酸根,Mg2+以Mg(OH)2形式完全沉淀,加入过量CaCl2使碳酸根全部转化为CaCO3沉淀,相关化学反应方程式见式(1)和式(2),通过式(3)计算反应前后溶液中的Ca2+物质的量浓度,通过式(4)计算溶液中碳酸根的质量浓度。本研究中,溶液的Ca2+物质的量浓度测定采用以钙羧酸为指示剂的EDTA滴定法,滴定终点为溶液颜色由红色变为蓝色。
式中,ɛ为溶液中Ca2+的物质的量浓度,mol/L;ρ为溶液中碳酸根的质量浓度,mg/L;C为EDTA标准溶液的物质的量浓度,mol/L;θ为CaCl2溶液中Ca2+的质量浓度,mg/L;ɛ0为反应前待测水样中Ca2+的物质的量浓度,mol/L;ɛ1为反应后待测水样中Ca2+的物质的量浓度,mol/L;V1为滴定Ca2+时EDTA标准溶液的消耗体积,mL;V2为滴定Ca2+时所取水样的体积,mL;V3为滴加CaCl2溶液的体积,mL;M1为钙的摩尔质量,40.08 g/mol;M2为碳酸根的摩尔质量,60.00 g/mol。
对系列标准溶液测定结果进行线性拟合,根据线性拟合范围确定测定范围。通过对CO2吸收液测定结果与酸碱滴定法测定结果进行对比证明该方法的现实可行性,实验装置示意图见图1。
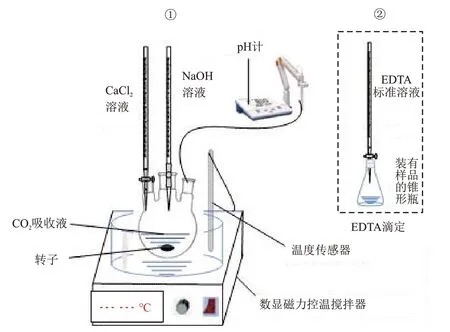
图1 实验装置示意图Fig.1 Schematic diagram of experimental device
EDTA间接滴定包括对CO2吸收液加CaCl2溶液前、后Ca2+的滴定与相关计算,酸碱滴定为用相应指示剂滴定中的碳酸氢根和碳酸根,以及相关计算。
CO2吸收液加CaCl2溶液前Ca2+滴定:取10 mL经0.45 μm滤膜过滤的CO2吸收液加入250 mL锥形瓶中,依次加入100 mL去离子水、3 mL三乙醇胺溶液、10 mL KOH溶液和0.2 g钙羧酸指示剂,用0.01 mol/L EDTA标准溶液滴定,当溶液颜色由红色变为蓝色时为终点。记录EDTA标准溶液的消耗体积,按照式(3)计算水样中碳酸根的质量浓度。
CO2吸收液加CaCl2溶液后Ca2+滴定:取100 mL经0.45 μm滤膜过滤的CO2吸收液,置于数显控温磁力搅拌器上搅拌,缓慢滴加NaOH溶液调节待测水样的pH值至11.60,并加入过量的CaCl2溶液,搅拌下加热至60 °C并保持5 min,冷却至室温,用0.45 μm滤膜过滤后将溶液转移至100 mL容量瓶中定容。同CO2吸收液加CaCl2溶液前Ca2+滴定步骤测定Ca2+质量浓度。
酸碱滴定CO2吸收液中碳酸氢根和碳酸根:取50 mL经0.45 μm滤膜过滤的CO2吸收液加入250 mL锥形瓶中,滴加4滴酚酞,如出现红色,用HCl标准溶液滴定至红色刚刚消失,记录HCl标准溶液消耗量。继续滴加4滴甲基橙指示剂,继续用HCl标准溶液滴定至由黄色突变至橙色,记录HCl标准溶液消耗量[5]。
2 结果与讨论
2.1 干扰因素分析
碳酸根测定结果的准确度主要受碳酸根转化为CaCO3沉淀程度的影响。通常CaCO3沉淀的生成受溶液过饱和度、pH值、温度和杂质离子的影响。研究表明随着溶液过饱和度的增加,CaCO3沉淀生成速率增加[13]。因此,在本研究中通过加入过量Ca2+的方式加快CaCO3沉淀的生成速率和促进反应平衡右移。
脱硫废水吸收CO2后可形成含碳酸根、碳酸氢根或碳酸根+碳酸氢根的溶液,升高溶液pH值会使碳酸氢根转化为碳酸根(式(1)),有利于CaCO3沉淀的生成(式(2))。在Na2CO3固体粉末和CaCl2溶液反应制备CaCO3的研究中,研究人员发现当pH值为11~12时可得到方解石和文石的混合物[14]。在不同pH值的900 mg/L和2500 mg/L的碳酸氢根标准溶液中分别进行EDTA间接滴定碳酸氢根实验,标准溶液滴定结果误差变化见图2。
由图2可知,当pH值为11.50左右时,用EDTA间接滴定法得到的标准液碳酸根质量浓度测定值与标准溶液真实值最接近,测定结果误差小,而2500 mg/L的碳酸根标准溶液的pH值为11.57。因此可将待测液pH值调节至11.60,提高EDTA间接滴定法测定碳酸根质量浓度的准确度。
通常情况下,CaCO3沉淀的溶解度随温度的升高而降低,CaCO3沉淀随温度升高其形成速率增大,温度较高时溶液中碳酸根与Ca2+沉淀较完全[15-16]。研究表明,当温度高于50 ℃时CaCO3沉淀多为方解石和针状文石晶体,并且形成的沉淀颗粒较大,更容易沉淀[17-18]。当温度为50 ℃、pH值为9.0时,含钙离子溶液与加入的Na2CO3粉末反应,可以CaCO3沉淀形式在5 min内可以完全沉淀[19]。为考察温度对间接滴定测定结果的影响,将2500 mg/L的碳酸根标准溶液与过量氯化钙溶液在20~60 °C、pH值为11.5的条件下反应30 min,然后进行间接滴定并计算测量误差,结果见图3。由图3可知,温度为20~60 ℃时,测量误差均在1.2%以下,其中温度为60 °C时碳酸根间接滴定结果测量误差最小(0.16%)。因此,本研究中的实验温度设定为60 °C。
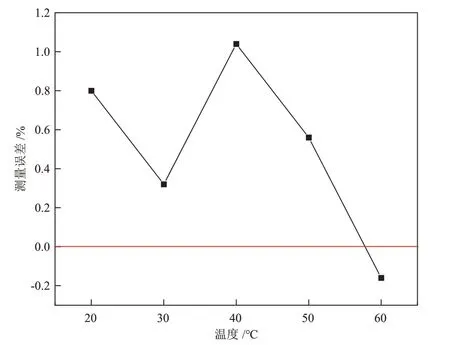
图3 不同温度下2500 mg/L碳酸根标准溶液的测量误差Fig.3 Measurement errors of 2500 mg/L carbonate standard solution at different temperatures
溶液中的杂质离子(主要是Mg2+和Fe2+)对CaCO3沉淀的生成有一定影响。研究表明,Mg2+的存在会影响CaCO3沉淀的晶型和形貌[18-20]。Mg2+会取代Ca2+插入方解石晶体使方解石溶解度增加,从而抑制CaCO3沉淀的生成[21-22]。而当溶液中Mg2+物质的量浓度达到一定值时,CaCO3沉淀只能以文石晶体的形式析出,不能以方解石和钒石形式存在[23]。因此,待测溶液加入Ca2+前,需用NaOH溶液调高待测溶液的pH值,使Mg2+以Mg(OH)2的形式沉淀析出,以消除Mg2+对CaCO3沉淀生成的影响。根据Mg(OH)2的溶解度常数,常温下当溶液pH值为11.04时,溶液中的Mg2+物质的量浓度为1.0 × 10-5mol/L,本研究参考文献[24-26]方法将溶液pH值调整为11.60,并加热30 min使Mg2+以Mg(OH)2完全沉淀,避免Mg2+对CaCO3沉淀的影响。有研究显示在溶液饱和度较低情况下,Fe2+会部分取代Ca2+,进而抑制钒石向文石的转化,导致文石数量随着Fe2+物质的量浓度提高而减少,从而抑制CaCO3沉淀的析出[27-28]。但过高饱和条件下,Fe2+对CaCO3沉淀的抑制作用小而本研究设置了较高过饱和条件,因此可忽略Fe2+的影响。
综上,通过将待测溶液的pH值调节至11.60并加热至60 °C,可避免pH值和杂质离子等因素的影响,确保测量结果的准确性。
2.2 标准溶液测定结果分析
对表1中的系列标准溶液A、B和C分别进行酸碱滴定和EDTA间接滴定实验,结果见表3。
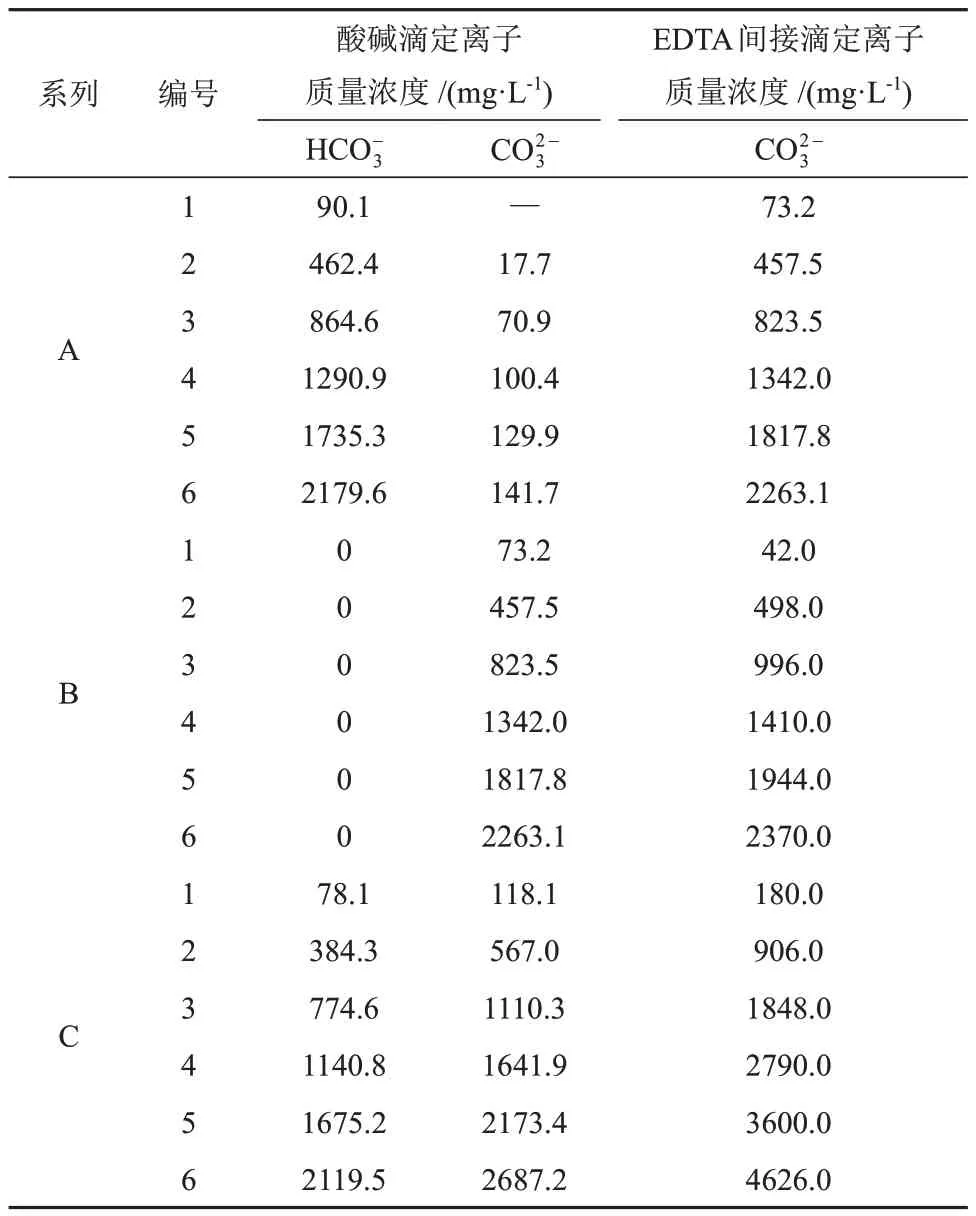
表3 系列标准溶液的酸碱滴定和EDTA间接滴定实验结果对比Table 3 Experimental results comparison of acid-base titration and EDTA indirect titration for series standard solutions
结合表3数据进行过原点的一元一次线性方程拟合并计算方差。结果显示,系列A的酸碱滴定法测定结果拟合方程为Y= 0.869X、R2= 0.9998,EDTA间接滴定法测定结果拟合方程为Y= 0.897X、R2= 0.9993,拟合程度均较高。系列B的酸碱滴定法测定结果拟合方程为Y= 0.946X、R2= 0.9989,EDTA间接滴定法测定结果拟合方程为Y= 0.958X、R2= 0.9993,EDTA间接滴定法测定结果拟合方程的方差略大于酸碱滴定法,因此EDTA间接滴定法的准确度略高。系列C的EDTA间接滴定法测定结果拟合方程为Y= 0.926X、R2= 0.9998,拟合程度高,EDTA间接滴定法测定碳酸根和碳酸氢根总量的准确度高。由系列A和系列C的酸碱滴定结果可知,当溶液中单独存在碳酸氢根或同时存在碳酸氢根和碳酸根时,溶液中的碳酸氢根会部分转化为碳酸氢根,存在碳酸氢根和碳酸根的动态平衡。通过加入NaOH溶液将碳酸氢根转化为碳酸根,再用EDTA间接滴定法测定碳酸根,可以准确测定溶液中碳酸氢根和碳酸根的总量。
2.3 方法线性范围和精确度分析
采用外标法分析EDTA间接滴定法的线性范围和精确度,同时用酸碱滴定法和EDTA间接滴定法分别测定系列A和系列B的碳酸氢根和碳酸根质量浓度,并绘制标准浓度-测定浓度标准曲线(图略)。通过分析曲线发现,对于系列A和系列B,酸碱滴定法和EDTA间接滴定法的测定结果都有较好的拟合曲线,其中EDTA间接滴定法滴定结果标准曲线线性拟合系数均大于0.999,测定数据与原始数据吻合度高,符合滴定分析要求,其检测范围(以碳酸根计)为100~2500 mg/L。
2.4 方法验证与分析
为验证EDTA间接滴定法的实际应用效果,取采集的实际工程水样(编号依次为1、2和3),分别用EDTA间接滴定法与酸碱滴定法平行测定5次,取平均值并计算相对标准偏差(RSD,指标准偏差(SD)与测量结果算术平均值(X)的比值,可反映测定结果的精密度差),结果见表4。由表4可知,对于实际工程水样1,两种测定方法的测定结果差别大且偏差都较大,其原因是实际工程水样1中含大量未溶解CO2,溶液中的碳酸氢根和碳酸根体系不稳定,导致误差较大。用EDTA间接滴定法测定实际工程水样2和实际工程水样3,所得结果的偏差较酸碱滴定法所得结果的偏差小,测定结果的相对标准偏差为0.92%~1.28%(n= 5),表明EDTA间接滴定法可以准确测定实际工程水样中碳酸氢根和碳酸根的总量,具备现实可行性。
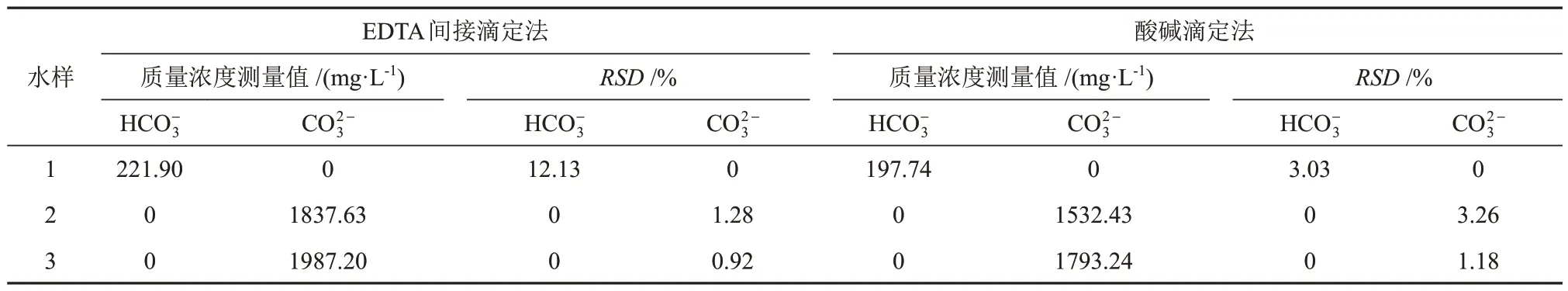
表4 EDTA间接滴定法和酸碱滴定法测定实际工程水样的结果对比Table 4 Results comparison of EDTA indirect titration and acid-base titration in determination of actual engineering water samples
在针对上海某电厂脱硫废水吸收烟气所含CO2的研究中,吸收CO2前后脱硫废水的pH值、EDTA间接滴定法、酸碱滴定法所得碳酸根质量浓度和计算所得CO2吸收量(1 t脱硫废水可吸收的CO2质量,g/t)见表5。由表5可知,脱硫废水吸收烟气中的CO2后pH值均达到中性,说明脱硫废水吸收了CO2并与部分CO2发生了反应。通过反应前后测定的碳酸氢根和碳酸根总量差值可快速计算出CO2吸收量,随后可用EDTA间接滴定法快速测定脱硫废水吸收CO2前后的碳酸根和碳酸氢根总量,进而确定CO2吸收量。
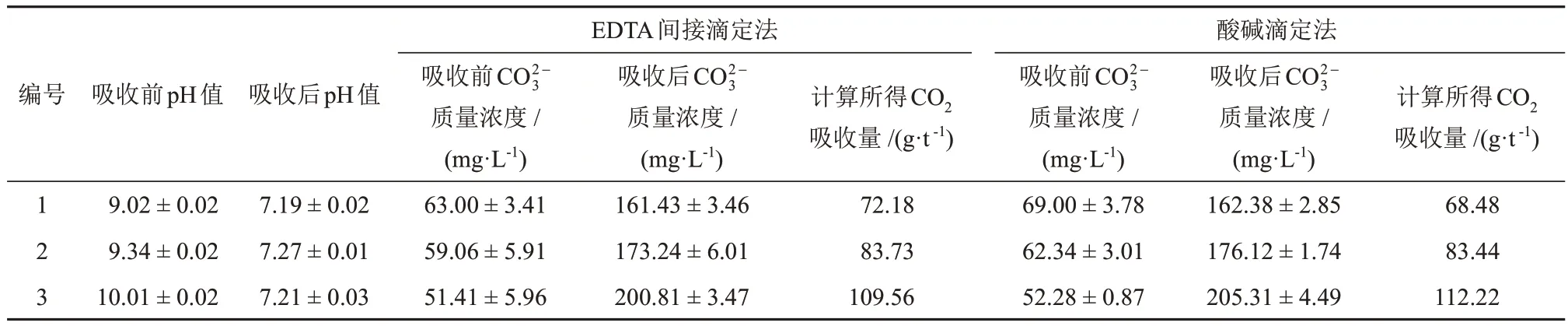
表5 吸收CO2前后脱硫废水的pH值与EDTA间接滴定法、酸碱滴定法所得碳酸根质量浓度和计算所得CO2吸收量Table 5 pH values of the desulfurization wastewater before and after CO2 absorption, and carbonate mass concentration obtained by EDTA indirect titration and acid-base titration and the calculated CO2 absorption
3 结论
本文主要研究了EDTA间接滴定法用于快速测定CO2吸收液中碳酸氢根与碳酸根总量的可行性,通过测定配制的标准溶液并拟合标准曲线,确定测定结果的线性相关性和线性范围,以准确测定CO2吸收液中碳酸氢根和碳酸根的总量(以碳酸根计),从而达到准确测定CO2吸收量的目标。同时将测定结果与常规酸碱滴定法进行了比较,得到以下结论。
(1)对于标准溶液系列A、B和C,EDTA间接滴定法测定结果的标准曲线线性拟合系数均大于0.9993,线性拟合范围为100~2500 mg/L,EDTA间接滴定法测定碳酸氢根和碳酸根总量(以碳酸根计)具有线性可行性,测定范围为100~2500 mg/L。
(2)分别采用EDTA间接滴定法与酸碱滴定法对实际工程水样(编号依次为1、2和3)的碳酸氢根和碳酸根总量进行了测定。结果表明,对于实际工程水样2和3,EDTA间接滴定法测定结果的偏差较酸碱滴定法小,测定结果的相对标准偏差为0.92%~1.28%(n= 5),说明EDTA间接滴定法可以准确测定实际CO2吸收液中碳酸氢根和碳酸根总量,具备现实可行性。

