海巴戟果实软化相关基因McXTH的克隆和表达分析
李佳莹,宫树森,秦英,金璨,吴田
(西南林业大学园林园艺学院,昆明 650224)
海巴戟(Morinda citrifoliaL.)别名诺丽,为茜草科(Rubiaceae)巴戟天属的多年生热带、亚热带植物,海巴戟果实具有可食用性,含有丰富的功能性成分和营养成分,被广泛应用于医学、食品等领域[1]。海巴戟果实成熟类型为呼吸跃变型,在成熟阶段中体积逐渐膨大,表皮由绿色逐渐转变为奶白色,物质积累逐步达到鼎盛状态,而果实硬度则呈现下降状态。有研究表明,果实硬度与果实组织细胞的细胞壁等细胞结构有密切的联系[2]。细胞壁作为植物所特有的一种细胞结构,对细胞起着保护和支撑的作用。XTH作为细胞壁松弛因子[3],通过对半纤维素木葡聚糖有转糖基和水解作用,从而修饰细胞壁功能,在果实成熟的过程中起到软化果实的作用[4]。因此,XTH基因在海巴戟果实软化过程中的功能研究具有重要的意义。通过M.J.Baumann等[5]对XTH活性蛋白的研究,发现按照XTH蛋白可以被分为两类。一类具有木葡聚糖内转糖苷酶活性(xyloglucan endoglycosylase, XET),对木葡聚糖分子进行内切,并将内切产生的还原性末端连接到另外一个木葡聚糖链上;另一类具有木葡聚糖内转糖水解酶(xyloglucan endo-hydrolase, XEH)活性,对木葡聚糖β-1,4糖苷键具有专一性水解作用[6]。XTH是一类多基因家族的编码蛋白[7],在与最适底物木葡聚糖相结合后,能使底物水解并产生中间产物“糖基-酶”,继而进一步产生糖基酶反应和水解反应,从而作用在细胞壁结构上,调节细胞壁的完整性[8],其中序列为DEIDFEFLG的催化位点起重要作用,与XTH的酶促反应相关,是XTH基因家族的一段保守基因序列[9-10]。通常XTH基因家族有20~60个成员在同类高等植物基因组中[11]。已公布的基因组数据显示,从花[12]、茎干[13]、根系[14]和果实[15]等不同部位在生长发育过程中受到各种环境刺激,会影响XTH的活性和XTH基因的表达情况。张萍萍等[12]对大丽花(Dahlia pinnatacv.Danbanhuang)进行高温胁迫处理,显著性抑制DpXTH1和DpXTH2的表达;C.F.Nardi等[15]对草莓(Fragaria×ananassaDuch.)XTH基因家族中3个不同品种的果实进行赤霉素和脱落酸处理,发现FaXTH1对果实有软化作用;对在常温贮藏过程中的桃(Prunus persica)果实进行XTH基因家族的基荧光定量PCR(RT-qPCR)检测,PpXTH33在溶质桃与硬质桃2种不同硬度果实中特异性表达,与果实软化密切相关[16];对在成熟发育过程中的枣(Ziziphus jujuba)果实利用荧光定量PCR检测XTH基因表达量,分析表明软化阶段比生长阶段XTH基因更为活跃[17]。
近年来,随着对果实成熟软化的深入研究,研究者们开始关注XTH基因在果实软化过程中的作用。果实采摘前为成熟阶段,采摘后为后熟阶段,有研究表明,猕猴桃(Actinidia deliciosa)XTH基因家族中的AdXTH5、AdXTH7基因分别在成熟阶段和后熟阶段大量表达,释放大量内源乙烯,使果实快速软化[18]。对葡萄(Vitis vinifera)进行外源乙烯利处理,可以刺激XTH基因表达导致果实膨胀变大[19]。对丙烯处理后的柿(Diospyros kaki)果实构建XTH基因家族原核重组蛋白,部分重组蛋白表现出XET活性,推测有XTH基因参与细胞壁重组及组装[20]。这些研究表明植物激素乙烯是果实软化的重要影响因子[21],在呼吸跃变型果实的成熟过程中,可以通过增加果实对乙烯的接受能力,包括内源乙烯的释放及外源乙烯的处理,促进果实软化,通过调控XTH基因对植物细胞壁的水解和重构,在果实的成熟和软化过程中起到一定的催化作用。
本研究通过乙烯对后熟阶段海巴戟果实产生的影响,揭示海巴戟果实的软化规律,并通过果实采后0~48 h转录组测序结果找到对果实软化起重要作用的基因XTH。通过对XTH基因进行克隆和表达分析,以期后续研究成果可以在海巴戟果实采后储存运输等方面提供便利,为保证果实品质添加一层保障。测量成熟阶段不同成熟度海巴戟果实硬度,并对海巴戟XTH基因进行克隆和表达分析,为进一步明确其功能,揭示海巴戟果实软化机理奠定基础。
1 材料和方法
1.1 试验材料
试验材料中海巴戟果实均为2019年7月于云南省元江县的海巴戟种植基地(102°E, 23.59°N)采摘。元江为季风气候,立体气候特点分明,阳光充足、雨热同季且年均温约为23~25 ℃,年均降水量1 600 mm,全年无霜,是符合海巴戟生长的自然环境条件。
对后熟阶段的果实标记分装后进行保鲜处理备用,以果实成熟过程中色泽变化及果实大小为判断依据,绿色小果为未成熟状态,对成熟阶段的果实按成熟度分为40%(整花脱落)、50%(幼果形成)、60%(幼果膨大)、80%(果实表皮绿色变浅)、100%(果实表皮接近奶白色)成熟[22],部分保鲜处理,部分切成薄片标记分装,用液氮速冻后保存在-80 ℃冰箱备用。
1.2 后熟阶段的果实硬度检测
对后熟阶段保鲜状况良好的海巴戟果实分为自然放置组和乙烯利处理组,均置于相对湿度为70%的含有自然光照密闭环境。自然放置组与乙烯处理组在处理上仅区别于自然放置组不设处理,而乙烯利处理组在距离果实约5 cm处使用200 mg/L的乙烯利溶液喷施果实至少3次,并以乙烯利溶液湿润果实表面且能成滴落下为标准。对2组果实每隔8 h按照使用说明使用果实硬度计(GY-2,杭州)测量果实硬度,测量过程中取样点随机分布,并设置3个相同成熟度的果实为1组材料,测量4个生物学重复数据。
1.3 基于转录组数据的目的基因序列分析
基于本课题组前期海巴戟果实采摘后0~48 h转录组测序结果[23],以关键词“XET”“XEH”“XTH”检索目的基因XTH,并使用NCBI-Blast(http://www.ncbi.nlm.nih.gov/BLAST)比对,以明确是否存在拼接重叠、两者是否属于同类基因且是否具有完整的开放阅读框(ORF)。
1.4 XTH基因克隆
将上述比对获得的XTH基因片段根据XTH基因家族特定的保守结构域的完整性筛选出XTH(DN16278)为目的基因McXTH,使用引物设计软件Premier 5.0设计特异性引物(表1)。采用Trigol总RNA提取试剂盒(鼎国生物科技有限公司,北京)提取不同成熟度海巴戟果实的RNA,并以其反转录得到的海巴戟cDNA的一条链为模板克隆McXTH基因。对特异性引物进行PCR全长扩增,设置25 μL的反应体系为2× master mix酶12 μL、ddH2O 10 μL、正向引物1 μL、反向引物1 μL、cDNA模板1 μL,反应条件为设置94 ℃预变性3 min、94 ℃变性30 s、60 ℃复性30 s、72 ℃延伸30 s和72 ℃重复温度10 min,共35个循环。对扩增产物进行琼脂糖凝胶电泳检测,使用胶回收试剂盒(天根生化科技有限公司,北京)回收凝胶,连接pMD18-T Vector克隆载体(TaKaRa公司,大连)转入大肠杆菌进行涂板,选取生长状况良好的单菌落进行挑菌,摇菌结果经PCR扩增验证后,将检测为阳性的菌液进行测序,菌液PCR的25 μL反应体系除菌液作为反应底物其余同全长扩增体系一致。将测序得到的基因序列与测序获得的序列进行比对,碱基差异小于5个则视为克隆的序列为目的基因序列。
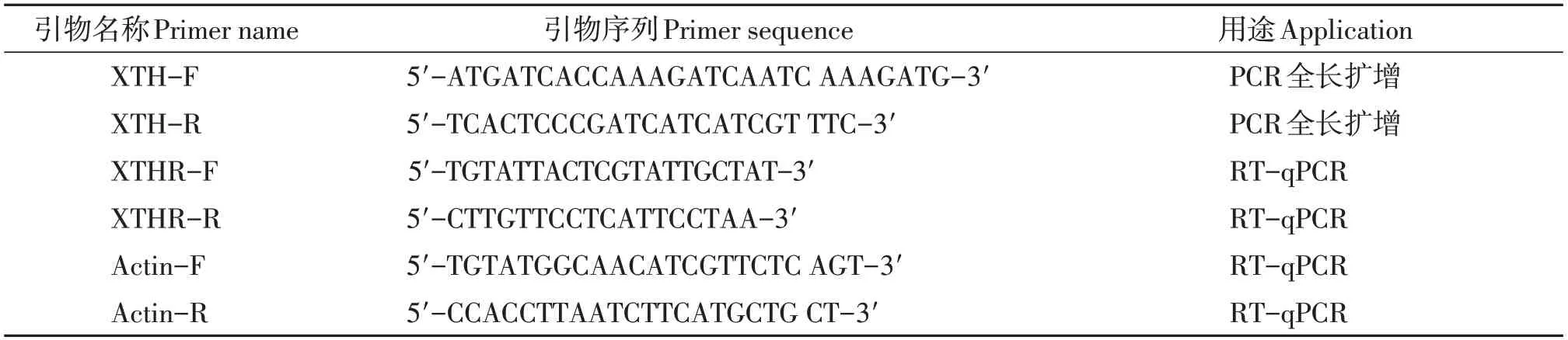
表1 引物序列Table 1 Primer sequence
1.5 生物信息学分析
将测序得到的目的基因序列,在NCBI-Blast比对,选取相似性较高的氨基酸序列,通过MEGA 7.0软件分析基因相似性并预测、分析其同源性,并使用TBtools 1.0软件总结并建立基于结构域分析的系统进化树。运用生物信息学在线的蛋白质同源建模软件Swiss-Model Workspace(http://swissmodel.espasy.org/)预测蛋白三级结构。
1.6 XTH基因表达量分析
根据克隆得到的XTH基因序列,使用引物设计软件Premier 5.0设计XTH基因荧光定量扩增片段引物,参照吴田等以海巴戟Actin基因片段为内参基因设计引物[24](表1),并以不同成熟度的海巴戟果实的cDNA为模板,进行RT-qPCR扩增。RT-qPCR反应体系为20 μL,荧光定量酶10 μL、ddH2O 6.8 μL、不同成熟度果实cDNA单链2 μL、正向引物0.6 μL、反向引物0.6 μL,反应程序共40个循环分为95 ℃预变性10 min、95 ℃变性15 s、60 ℃退火30 min和72 ℃延伸30 s共4个过程。
1.7 乙烯释放量检测
使用便携式乙烯气体分析仪(CI-900,美国),按照使用方法说明,按照每3个相同成熟度的海巴戟果实为1组材料的标准,设置3个生物学重复,测量1.1中不同成熟度的海巴戟果实乙烯释放量。
2 结果与分析
2.1 后熟阶段的海巴戟果实成熟软化规律
海巴戟果实的硬度测量结果显示,在果实后熟阶段的成熟进程中,随着时间的推移,大概可分为3个阶段:快速软化阶段、软化阶段、稳定阶段,时间大致可对应为0~16 h、16~40 h、40 h以上(图1),其中在2种处理下0~16 h和16~40 h 2段时间内果实硬度变化较大,以0 h、16 h、40 h的果实硬度为时间节点通过计算3个阶段的拟合直线方程得到果实硬度变化斜率(表2)。在0~16 h的过程中外源乙烯利的刺激导致果实更快的软化,经历相同的时间,经过外源乙烯利处理的果实更早地降低了硬度,相较于自然放置的果实,软化阶段更易于过渡到稳定阶段。也就是说,在海巴戟果实后熟阶段,果实对外源乙烯利的刺激有明显反应,可以推测海巴戟对乙烯敏感,在果实后熟阶段通过增加外源乙烯的用量可以加速海巴戟果实的软化并促进其成熟。
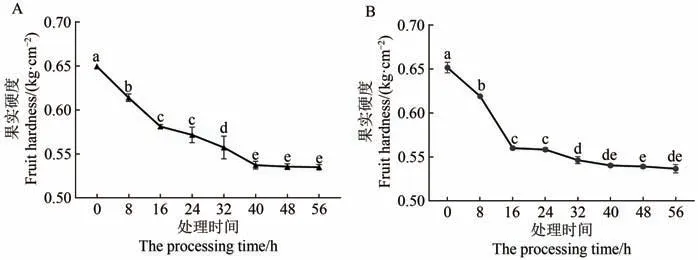
图1 后熟阶段海巴戟果实硬度Figure 1 Firmness of M.citrifolia fruit at post-ripening stage
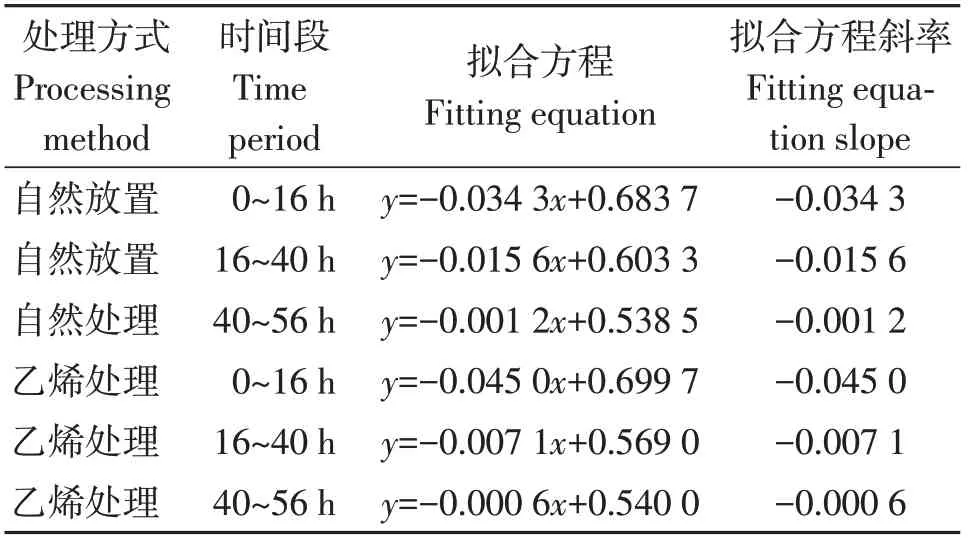
表2 后熟阶段海巴戟果实硬度变化拟合直线方程Table 2 Imitative straight line equation in changs of firmness of M.citrifolia fruit at post-ripening stage
2.2 基于转录组测序结果的XTH基因序列分析
对海巴戟果实采摘后0~48 h的转录组测序结果进行筛选,检索出5个基因片段,绘制出对应的基因表达量热图(图2)。经过Blast比对结果显示基因片段均具有XTH基因家族特有的保守催化位点和GH16结构域,判断为XTH基因家族基因。根据热图结果直观显示,5个基因片段的表达量中,下调的3个基因片段中基因片段XTH(DN28281)、XTH(DN2044)在生物学重复中出现零表达,而XTH(DN16391)同上调基因XTH(DN17930g1)长度不超过400 bp且无完整的开放阅读框,故选用上调基因、表达差异极大且有完整开放阅读框的XTH(DN16278g1)用以进行后续基因克隆。

图2 从转录组数据中筛选到的XTH基因表达量热图Figure 2 Heat map of XTH genes expression from the data of transcriptome
2.3 海巴戟XTH基因的克隆及生物信息学分析
使用ORF Finder对克隆出来的XTH基因进行分析,发现该基因的完整ORF长度为1 062 bp,与扩增结果一致(图3)且编码353个氨基酸,在127~918 bp的位置包含GH16基因家族,是XTH基因家族独特的结构域,初步证明该基因是XTH基因家族的一员。

图3 XTH(DN16278g1)基因的PCR扩增产物Figure 3 PCR amplification product of XTH(DN16278g1)
通过NCBI-Blast比对结果显示海巴戟XTH基因编码的氨基酸序列与其他植物有较大的相似性,选取相似性较大的植物,结合DNA-man软件进行序列分析(图4),采用最大似然法(maximum likelihood method, ML)建立基于结构域的系统进化树(图5)。结果发现,海巴戟XTH是XTH家族成员中关系较远的一支,且整个基因家族在进化过程中保留较为保守的基因模式。海巴戟与茄科、木犀科、紫葳科、芝麻科植物为亲缘关系较近的一支,在与柿科、豆科等植物为亲缘关系较远的一支。通过上述比对后,将该基因命名为McXTH,并提交Genbank,获得登录号为ON512442。

图4 海巴戟与其他植物XTH蛋白的氨基酸序列比对Figure 4 Amino acid sequence alignment of M.citrifolia with other XTH proteins
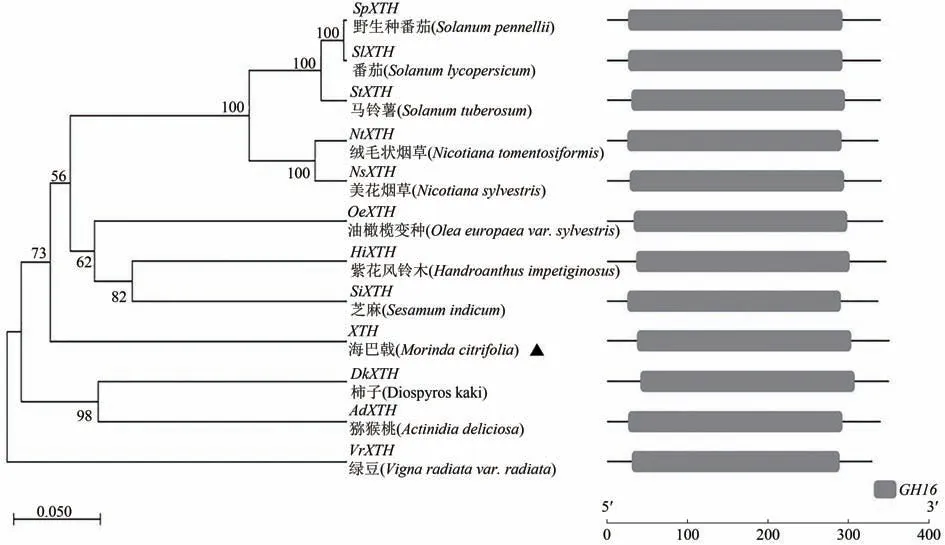
图5 基于保守结构域的海巴戟XTH与其他植物XTH的系统进化树分析Figure 5 Phylogenetic tree analysis of XTH from M.citrifolia and other plants based on the conserved domain
对McXTH蛋白进行三级结构进行在线预测(图6),对比了43个XTH蛋白结构及模型,与数据库目标蛋白木葡聚糖内转糖基化酶1un1.2.A的天然结构相似度达到40%,GMQE值为0.6。通过该结果可以认为McXTH的蛋白结构同时与木葡聚糖内转糖苷酶、木葡聚糖内转糖水解酶的结构相关,具备XTH家族中的典型结构特征。

图6 McXTH蛋白的三级结构Figure 6 The tertiary structure of McXTH
2.4 McXTH基因的表达分析
分别对成熟度为40%、50%、60%、80%和100%的海巴戟果实中McXTH基因的表达量进行RT-qPCR分析,设置成熟度为40%的海巴戟果实中的McXTH表达量为对照,发现McXTH在成熟阶段皆有表达,并且其表达量随着果实成熟度增加而上升,在果实成熟度为100%时达到最高值(图7-A)。
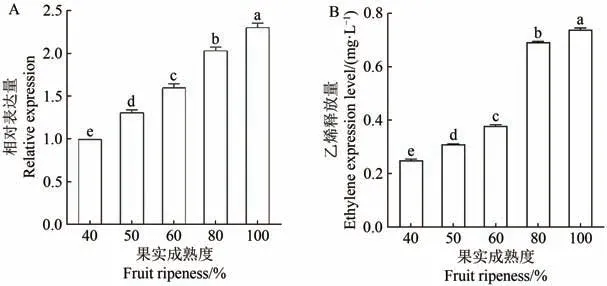
图7 不同成熟阶段的海巴戟果实中McXTH的表达及乙烯释放量Figure 7 The expression trendency of McXTH and ethylene in different maturity of M.citrifolia fruit
测量不同成熟度的海巴戟果实乙烯释放量的结果显示在不同成熟度的海巴戟果实释放出的内源乙烯差异显著。随着海巴戟果实成熟度的提高,海巴戟内源乙烯的释放量相应提高(图7-B),并在果实成熟度为60%~80%的区间出现跨越式增长,约为1.7倍。乙烯释放量与McXTH表达量均呈现上调趋势(图7),因此推测伴随海巴戟果实成熟,在成熟阶段中McXTH基因的表达量与内源乙烯释放量为正相关关系,McXTH高表达时,内源乙烯释放量相应较多,作用于海巴戟果实上表现为果实变软成熟。
3 讨论
海巴戟是一种新兴的药食同源植物,富含多种黄酮类、萜类等化合物,其果实等可食用,根、叶、果实等部位均可入药[25]。本研究用乙烯利处理成熟的海巴戟果实,探究其软化规律,并以海巴戟果实cDNA为模板,克隆出McXTH基因。通过RT-qPCR验证基因表达量,分析了McXTH在不同成熟度海巴戟果实中的表达,并测量同期果实的乙烯释放量佐证McXTH对海巴戟果实软化的影响。通过研究结果发现,McXTH随着海巴戟果实的成熟,其表达量不断上升,当果实趋于成熟时,表达量达到高峰并逐渐趋于平稳。
基因表达分析发现,XTH基因在海巴戟果实成熟过程中受乙烯含量影响软化程度,其中,成熟阶段中McXTH表达量高则内源乙烯释放量高,后熟阶段中外援乙烯利处理加速果实软化。Zhai Z.F.等[26]以甜樱桃(Prunus aviumL.cv.Zaodaguo)为材料,利用乙烯利进行分组定量处理果实,结果表示乙烯利的处理使PavXTH15表达上调,对PavXTH15用樱桃果实构建过表达载体进行瞬时转化,并用RT-qPCR验证了PavXTH15对果实软化有显著的调控作用,与我们的实验结果基本一致。在以往的研究中表明,XTH基因与果实的成熟软化联系密切。辣椒(Capsicum annuumL.)基因组中XTH基因在不同组织中呈现出不同的时空特性,在果实中表现为随着果实从绿熟期至红熟期的转变,调控着果实的膨大[27],成为果实成熟的重要环节。果实作为海巴戟的重要组成部分,软化是成熟的重要标志,与果肉组织细胞中细胞壁的重构有紧密联系。木葡聚糖内转糖苷酶/水解酶是促使细胞壁松弛的重要因子,在果实成熟早期,通过对半纤维素木葡聚糖有转糖基和水解作用来修饰细胞壁的功能,增大细胞壁空隙并促进水解酶释放,是植物细胞壁重构的关键酶。甜瓜(Cucumis meloL.cv Hetao)Cm XTH28-2基因启动子中含有乙烯应答元件,与调控细胞壁的作用相呼应,对该基因进行编辑后培育出的过表达果实出现的早熟表型与表达量检测更是说明其参与调控果实的成熟进程[28]。Zhang Z.Y.等[29]对早熟苹果(Malus pumilacv.Taishanzaoxia)XTH基因进行研究,通过对苹果硬度、乙烯浓度的测定,发现果实的正常成熟需要乙烯正向调控XTH基因的活性,同时XTH基因可以作为信号开关,促进乙烯的释放并开启果实成熟软化的进程。
4 结论
本研究通过对后熟阶段的海巴戟果实软化推测成熟规律,并从采摘后0~48 h转录组数据中筛选并克隆海巴戟McXTH基因,通过成熟期不同成熟度的海巴戟果实McXTH基因的表达与乙烯释放量正相关的情况,判断乙烯是促进海巴戟果实成熟软化的重要因子,后熟期的海巴戟果实对乙烯敏感,随着时间的增长能加速果实的软化,因此推测海巴戟McXTH基因是海巴戟果实的成熟软化的关键基因,参与调控海巴戟果实软化,在果实软化过程中起重要作用。后续拟将海巴戟McXTH基因构建过表达载体,通过同源转化及异源转化进一步明确其功能。

