增强型体外反搏对老年原发性高血压伴静息心率增快患者RAAS系统因子等的影响
杨海燕, 丁宇, 王灿
河北省第八人民医院心内科(河北石家庄 050024)
原发性高血压是最常见的慢性病,也是心脑血管疾病最主要的危险因素,长期高血压可损害全身血管,引起动脉硬化,影响心、脑、肾等重要器官的结构及功能,终致其功能衰竭。原发性高血压的病理生理机制复杂,目前尚未完全阐明。已有的研究显示,血管紧张素Ⅱ或醛固酮合成增加、交感神经系统激活、内皮功能障碍、氧化应激、炎症反应、血管张力改变及遗传易感性等参与了高血压的发生与发展[1]。静息心率加快是交感神经过度激活的特征性早期临床表现,与高血压、糖尿病、缺血性卒中、肾功能损害、心血管死亡率及全因死亡率间关系紧密,是心血管疾病的独立危险因子。研究表明,静息心率加快既是导致高血压的因素,也是高血压病患者发生心血管事件和靶器官损害的重要危险因素,尤其在动脉粥样硬化、肾功能受损中起重要作用[2]。同时高血压导致的交感神经系统激活又会引起心率加快,二者形成恶性循环。因此,目前国内外相关指南中将心率作为高血压风险管理的重要内容[3-4],并建议高血压伴有心率增快的患者首先需改善不良的生活方式,同时服用兼有减慢心率和降低交感神经兴奋性作用的β受体阻滞剂美托洛尔缓释片和比索洛尔。增强型体外反搏(EECP)因具有无创、有效、安全、简便、经济等独特优势,已广泛用于缺血性心脑血管疾病的辅助治疗。本研究将其用于治疗老年原发性高血压伴心率增快患者,评估对患者血压、心率及高血压靶器官损害的影响,为患者提供个体化综合治疗方法,报告如下。
1 资料与方法
1.1 一般资料 选取2021年1月至2022年1月就诊于我院的老年原发性高血压伴慢性心率增快患者150例,根据随机数字表将其分为2组。观察组75例,男性40例,女性35例;年龄61~79岁,平均(69.88±9.43)岁;高血压病程8~17年,平均(11.20±4.47)年。对照组75例,男性42例,女性33例;年龄63~78岁,平均(67.27±10.51)岁;高血压病程7~18年,平均(11.66±5.31)年。两组患者性别、年龄及病程方面比较,差异无统计学意义(P>0.05),具有可比性。
1.2 病例选择
1.2.1 纳入标准 符合原发性高血压的诊断标准[5],且160 mmHg≤收缩压≤140 mmHg,60 mmHg≤舒张压90 mmHg,同时伴有心率增快[4],静息心率>80次/min,<100次/min;年龄60~80岁;病历资料完整,常年居住本地,治疗依从性高;患者均自愿参加本研究,并签署知情同意书;本研究获得医院伦理委员会批准(伦理批件编号:2021科伦审第(5号))。
1.2.2 排除标准 继发性及难以控制的高血压;严重心律失常;因运动、咖啡、饮酒等引起的一过性心率增快,以及因贫血、甲亢等疾病导致的继发性心率增快;近1个月口服β受体阻滞剂者;平均肺动脉压>50 mmHg;合并有中重度主动脉瓣关闭不全、肺源性心脏病、先天性心脏病者;正在服用抗凝药,合并有凝血功能障碍、血栓性静脉炎、下肢深静脉血栓形成、大隐静脉曲张、严重骨质疏松、髋关节疼痛、糖尿病外周血管病变严重等EECP治疗禁忌者;近2周股动脉处有穿刺;合并有恶性肿瘤、活动性或慢性感染;精神疾病或老年痴呆等无法交流者;多脏器功能衰竭者;对本研究药物过敏者。
1.3 治疗方法
1.3.1 对照组 予生活干预和药物治疗。(1)生活干预:包括指导患者改变不良的生活方式,禁烟戒酒,低盐饮食,不大量饮用咖啡或浓茶。适当运动,以步行、慢跑等有氧运动为主,每日30 min左右,以降低交感神经活性。肥胖者积极减重,控制高脂肪、高糖食物的摄入。保持心情舒畅和乐观的情绪,避免紧张、焦虑等导致血压波动。(2)药物:予富马酸比索洛尔(厂家:北京华素制药股份有限公司,国药准字:H20023132),起始剂量为1.25 mg,每日1次口服,若患者可耐受则每1~2周增加1.25 mg,每日最大用量不超过5 mg。
1.3.2 观察组 在对照组治疗基础上加EECP治疗。采用重庆普施康科技发展股份有限公司生产的P-ECP/TI型(一体式)气囊式体外反搏装置治疗。治疗前向患者交代注意事项,避免患者紧张。患者仰卧于治疗床上,接通心电电极,将小腿、大腿和臀部分别包扎适宜大小的气囊,设置充气压力10~30 kPa,每日1次,每次30 min,每周5次,治疗12周。治疗过程中密切观察患者耐受情况,发现问题及时处理。
1.4 观察指标 (1)肾素-血管紧张素-醛固酮(RAAS)系统指标:分别于治疗前后采集两组患者晨间空腹时坐位静脉血标本,采用放射免疫法测定血浆肾素(PRA)、血管紧张素Ⅱ(AngⅡ)、醛固酮(ALD)水平,所有操作均严格按照说明进行。(2)颈动脉超声:治疗前后用飞利浦EPIQ7C 全数字化彩色多普勒超声诊断仪对颈动脉进行探查,测量颈总动脉分叉部、分叉部近心端和远心端1 cm处颈动脉内-中膜厚度(IMT)、血管舒张期内径(Dd),并用脉冲多普勒探测颈总动脉血流参数进行,包括血管搏动指数(PI)、阻力指数(RI)、舒张末期峰值流速(EDV)及收缩期峰值流速(PSV),血流最大剪切率(SR)。(3)生化检测:治疗前后用迈瑞BS-2000M全自动生化分析仪检测总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、同型半胱氨酸(Hcy)、脂蛋白相关磷脂酶A2(Lp-PLA2)及超敏C反应蛋白(hs-CRP)水平。(4)血压、心率:两组治疗治疗前后各行24 h动态血压、动态心电图测得24 h平均收缩压(24hmSBP)、24 h平均舒张压(24hmDBP)以及日间心率(dHR)、夜间心率(nHR)和24 h心率(24hHR)。
2 结果
2.1 两组治疗前后血压、心率比较 两组患者治疗后24hmSBP、24hmDBP、dHR、nHR和24hHR均显著降低(均P<0.05),且观察组均低于对照组(均P<0.05)。见表1。
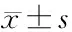
表1 两组治疗前后血压、心率比较
2.2 两组治疗前后血清RAAS指标水平比较 观察组患者治疗后AngⅡ、ALD和PRA水平均显著降低(均P<0.05),且也均低于对照组(均P<0.05)。对照组患者治疗后AngⅡ、ALD水平也较治疗前显著降低(均P<0.05)。见表2。
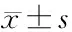
表2 两组治疗前后血清RAAS指标水平比较
2.3 两组治疗前后炎症因子及Hcy水平比较 两组患者治疗后hs-CRP、Hcy、Lp-PLA2均显著降低(均P<0.05),且观察组均低于对照组(均P<0.05)。见表3。
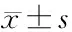
表3 两组治疗前后炎症因子及Hcy水平比较
2.4 两组治疗前后颈总动脉血流动力学比较 观察组患者治疗后IMT、PI、RI、Dd均低于治疗前(均P<0.05),EDV、PSV及SR均高于治疗前(均P<0.05),且以上指标也与对照组同期比较差异有统计学意义(均P<0.05)。对照组除PI,其余各指标均较治疗前改善(均P<0.05)。见表4。

表4 两组治疗前后颈总动脉血流动力学比较
2.5 两组治疗前后血脂水平比较 两组患者治疗后TG、TC、LDL-C均低于治疗前(均P<0.05),且观察组均低于对照组(均P<0.05)。两组患者治疗后HDL-C水平无明显变化(均P>0.05)。见表5。
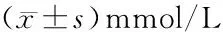
表5 两组治疗前后血脂水平比较
3 讨论
长期的血压增高会导致动脉粥样硬化的发生与发展,而动脉粥样硬化是高血压心血管事件发生的基础病理环节。RAAS系统是人体内最重要的体液调节系统,参与调解血管舒缩及水盐代谢,与循环系统相互作用,共同维持人体各个系统之间的平衡。虽然目前关于原发性高血压的发病机制尚未形成共识,但都普遍认为RAAS系统激活是原发性高血压发生、发展的病理基础。正常生理状态下,RAAS 系统是机体长期血压调节的重要机制。肾素是由肾小球入球动脉的球旁细胞合成和分泌的蛋白水解酶,经过肾静脉进入血液循环,可水解肝脏分泌的血管紧张素原而产生血管紧张素Ⅰ(AngⅠ),AngⅠ在体内循环过程中在血管紧张素转换酶作用下水解产生AngⅡ[6]。AngⅡ可促进血管收缩,同时可刺激肾上腺皮质分泌ALD,而ALD具有保钠排钾的作用,进而刺激交感神经节,促进交感神经递质分泌,使交感神经处于过度兴奋状态,使得血压升高、心率。此外,RASS系统Ang-Ⅱ不仅能促进血管收缩,还可激活氧化应激,诱导多种炎症因子和细胞外基质的分泌,促进血管平滑肌细胞增殖和血管重构,加速动脉粥样硬化的发生[7]。而高静息心率也参与了动脉粥样硬化的形成与发展。一方面,高静息心率会增强动脉血流的搏动,使动脉管壁的压力增加,并产生沿切应力方向的震荡,使血流速度和方向改变,并损伤血管内皮而导致动脉粥样硬化[8]。另一方面,炎症反应贯穿动脉粥样硬化的全过程,而高静息心率导致的交感神经兴奋、自主神经系统失衡还会诱导多种炎性因子如hs-CRP、白细胞介素-6的分泌,促进动脉粥样硬化的发生、斑块的破裂和血栓形成[9]。伴有静息心率增加的高血压患者动脉管壁的压力进一步增高,血流对血管的冲击力强度更大,加之静息心率增快,交感神经激活、自主神经功能紊乱导致的炎症因子、氧化应激反应、神经内分泌因子的分泌增加,更易使血管内膜损伤、破裂,使动脉管壁不平整,促进血小板、脂质在管壁上沉积,导致血管壁变厚、变硬,弹性下降,进而促进动脉粥样硬化的发生、发展以及斑块的形成,管腔随之狭窄或堵塞,血管阻力也增大,血流速度减慢,血流动力学也随之发生改变,最终导致靶器官损伤。由此可见,心率增加可加重高血压的动脉粥样硬化和靶器官损害。
颈动脉是反映全身动脉粥样硬化的窗口。颈动脉IMT是评价早期动脉粥样硬化的敏感特异性指标,能够很强地独立预测心、脑血管病事件发生,还可用于评价各种治疗方法对动脉硬化的逆转或消退作用。当高血压升高时,颈动脉IMT也随之增厚,斑块的发生率随之而升高,二者呈正相关,同时随着血压的升高,颈动脉血流动力学也发生改变。学者通过回顾性研究证实,老年高血压患者颈动脉形态及血流动力学均存在明显的异常改变,表现为颈总动脉内径、IMT及RI均显著升高,颈总动脉PSV和SR均显著降低,且与高血压分级有明显关联[10-11]。而静息心率增快也进一步加重了高血压患者颈动脉结构和血流动力学的异常[12]。相关调查研究显示,我国中老年人群中静息心率与颈动脉粥样硬化的发生呈正相关,高静息心率人群IMT升高的风险是低静息心率人群的2.82倍[13]。张岩等[14]研究显示,24 h平均心率与初诊高血压患者颈动脉粥样硬化相关,IMT越厚,24 h平均心率就越高。巩黎雯等研究显示,随着静息心率的升高,中老年高血压患者颈动脉IMT越厚,颈总动脉内径也随之增大,斑块的检出率也升高[15]。林腾等[16]研究显示,老年高血压患者颈总动脉IMT、RI升高,EDV及PSV降低,斑块检出率也较健康者高。
hs-CRP是非特异性炎症反应标志物,参与动脉粥样硬化的形成。大量的hs-CRP分泌并进入血液循环,可进一步与单核巨噬细胞、补体复合物共同沉积在动脉管壁中,刺激单核巨噬细胞吞噬脂质,形成泡沫细胞并逐步形成粥样斑块,并影响斑块的稳定性。有研究显示,hs-CRP>3 mg/L时动脉粥样硬化风险较高,为5.02 mg/L时诊断颈动脉粥样硬化风险的敏感度和特异度最佳[17]。Lp-PLA2为磷脂酶A2超家族中的一员,是血管特异性炎症的标志物,其可水解动脉壁内的氧化低密度脂蛋白,产生溶血卵磷脂、氧化型游离脂肪酸等促炎因子,增强巨噬细胞的炎症反应,诱发血管内皮细胞凋亡,进而促进动脉粥样硬化的形成[18]。Hcy是蛋氨酸的代谢产物,是一种具有细胞毒性的含硫氨基酸,是诱发高血压、心脑血管疾病的重要因子,其能降低甲硫氨酸转甲基水平,促进氧自由基和过氧化物的形成,损伤血管内皮功能,促进血管平滑肌增殖,抑制内皮细胞增殖,导致血小板聚集,促进LDL-C的氧化修饰和泡沫细胞形成,进而导致动脉粥样硬化的发生[19]。因此Hcy也可作为动脉硬化的预测指标。研究显示,高血压患者无论是否合并颈动脉粥样硬化,血清hs-CRP、Hcy水平均升高,且合并颈动脉粥样硬化的患者更高[20]。另有研究显示,原发性高血压患者Hcy、Lp-PLA2水平均明显高于健康人群,且随着高血压级别的增加,两者水平越高,颈动脉粥样硬化的程度也增加[21-22]。以上研究均证实,微炎状态及Hcy代谢异常在高血压患者中普遍存在,并能促进高血压患者颈动脉粥样硬化的发展。赵伟等[23]研究显示,快心率组高血压患者的Hcy水平较非快心率组患者明显升高,与静息心率及斑块Crouse积分、高血压病程均成正相关,证实了高血压患者静息心率越快,颈动脉损害越严重,血浆Hcy水平越高。 陈勇等[24]研究显示,Hcy、hs-CRP和Lp-PLA2诊断高血压颈动脉粥样硬化风险的临界值分别为14.15 μmol/L、3.65 mg/L、207.64 μg/L,三者联合检测的特异度可高达92.1%。
高血压、脂质代谢紊乱都是动脉粥样硬化的危险因素,二者既彼此独立又密切联系相互作用。脂质代谢紊乱可通过影响细胞膜脂质结构, 使其通透性改变,钙离子内流增加而导致高血压,同时还可通过氧化型低密度脂蛋白途径损害内皮功能,导致舒血管因子一氧化氮等合成释放减少, 而缩血管因子内皮素1等因子释放增多, 导致血压升高。二者同时存在时,动脉粥样硬化的危险性明显增加。临床上也发现高血压患者常常伴随有血脂异常。有研究证实,高血压患者的静息心率与TC、LDL-C、TG水平呈正相关,与HDL-C呈负相关,存在脂质代谢异常,加重患者的靶器官损害[25]。高血压患者随着静息心率的增加,血压及TG、TC、LDL-C也呈进行性增加,HDL-C水平降低[26-27]
综上分析可见,老年高血压伴慢性静息心率增快可通过激活RAAS系统、加重炎症反应及Hcy、脂质代谢等导致动脉粥样硬化的发生,加重靶器官损伤。而治疗后结果显示,两组患者血压和心率均下降,且观察组均低于对照组,RSSA系统AngⅡ、ALD和PRA水平低于对照组,hs-CRP、Hcy、Lp-PLA2低于对照组,颈动脉超声IMT、PI、RI、Dd低于对照组,EDV、PSV及SR均高于对照组,血脂TG、TC、LDL-C均低于对照组(P<0.05)。证实EECP能改善老年高血压伴慢性静息心率增快导致动脉粥样硬化的多个环节。既往研究也证实,EECP能有效抑制动脉粥样硬化病变的发生、发展,降低各种心血管疾病的发生或恶化。如白杨等[28]研究证实,体外反搏可抑制冠心病不稳定型心绞痛患者AngⅡ的产生,减轻脂质过氧化反应,保护血管内皮,从而稳定易损斑块,保护血管内皮,降低患者心绞痛发作频率。程修平等[29]研究显示,EECP能有效降低高血压患者AngⅡ水平,调控内皮素(ET)、一氧化氮(NO)水平,改善血管内皮修复的生物活性,从而起到良好的降压作用。Zhang等[30]研究显示,EECP治疗后能明显改善冠心病颈动脉和外周动脉的血流动力,尤其是降低女性患者RI方面效果显著。吴献豪等[31]研究显示,EECP可降低冠心病患者hs-CRP及Lp-PLA2水平,稳定斑块。EECP能改善非痴呆性血管性认知障碍患者头颈部动脉血流动力学,增加颈总动脉PSV、EDV、SR,降低PI、RI,降低动脉管壁的阻力,从而改善脑低灌注状态[32],EECP可降低冠心病患者Hcy、hs-CRP、Lp-PLA2、LDL-C、TG、TC水平,改善冠心病患者血管老化[33]。EECP是一种无创循环辅助装置,可调节颈动脉窦压力感受器,抑制交感神经和RASS系统升压物质的释放,从体液调节方面发挥降压、降低心率等作用。另一方面其能通过增加回心血量,降低外周血管阻力,促进侧支循环开放,促使血管径增大,提高血管剪切力的血流动力学效应,抑制内皮细胞凋亡,促进内皮修复,从而抗动脉硬化。同时,EECP还能抑制炎症因子分泌,减轻血管内皮炎症反应,修复血管内皮,调节脂质代谢,拮抗动脉粥样硬化。
综上所述,本研究初步证实了EECP能改抑制老年原发性高血压伴心率增快患者RAAS系统激活,抑制炎症反应,调节脂质代谢紊乱和Hcy水平,改善颈动脉血流动力,减轻颈动脉粥样硬化,有助于预防靶器官损害。但本研究鉴于时间的限制并未对患者相关靶器官的损害情况进行长期随访观察,有待大样本、长期随访进一步验证。
利益相关声明:本文不存在任何利益冲突。
作者贡献说明:杨海燕负责设计论文框架、起草论文、论文修改、拟定写作思路指导撰写论文并最后定稿;丁宇负责实验操作、研究过程实施;王灿负责数据收集,统计学分析,绘制图表。

