孤立性直肠溃疡综合征伴反复腹股沟疝1例
王振芳,李 斌,侯英勇,徐 晨
患者男性,43岁,体检发现直肠肿物2年余。2019年1月当地医院肠镜示:距肛门口齿状线上方至直肠4 cm内见片状充血糜烂,血管纹理不清晰。活检病理诊断:肠黏膜腺体局灶紊乱,细胞轻度非典型,间质纤维化,散在浆细胞、淋巴细胞和少许嗜酸细胞浸润;临床医师建议随访。2021年2月再次就诊于当地医院,肠镜示:距肛门口齿状线上方至直肠4 cm内黏膜片状发红,黏膜表面充血糜烂,血管纹理不清。病变范围较前明显增大。活检病理诊断:黏膜上皮息肉样增生,部分黏膜上皮和腺体低级别上皮内瘤变。遂于2021年11月30日在外院行内镜黏膜下剥离术,肠镜示:距肛门4 cm处可见一大小4.5 cm×3.5 cm扁平黏膜隆起,表面发红、粗糙,中央可见溃疡形成(图1)。2021年12月至我院会诊。追问病史:患者自诉排便困难2年,伴少量鲜血。
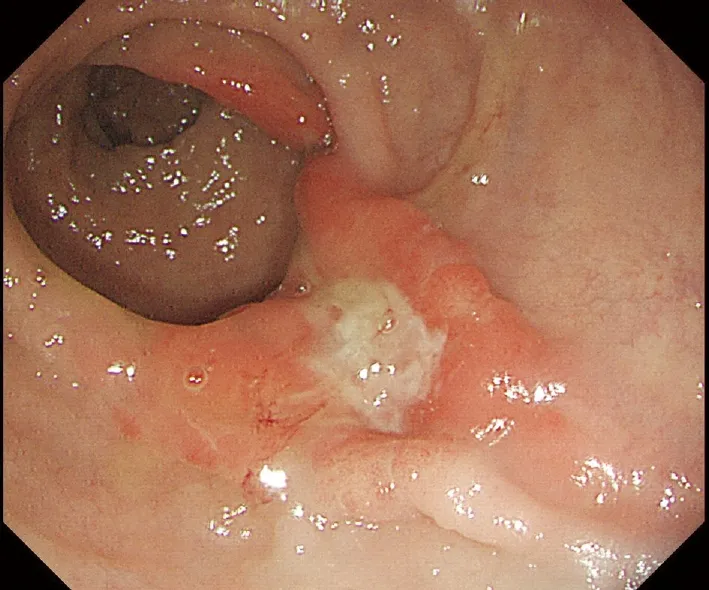
图1 肠镜检查见一大小4.5 cm×3.5 cm扁平黏膜隆起,表面发红、粗糙,中央可见溃疡形成
1981年行右侧腹股沟疝修补术;1990年行阑尾切除术;2011年1月和11月分别行右侧和左侧腹股沟疝修补术。
病理检查眼观:灰白色黏膜组织,大小6 cm×3.5 cm×0.2 cm,黏膜上见浅表凹陷区,范围3.5 cm×3 cm,局部紧贴切缘(图2)。镜检:中央可见溃疡形成,溃疡周边见增生腺体,腺体拉长扭曲,形态不规则,并延伸至黏膜下层,黏膜下层见无细胞黏液湖形成(图3)。免疫表型:desmin染色示平滑肌增生,包绕腺体生长(图4)。
病理诊断:孤立性直肠溃疡综合征(solitary rectal ulcer syndrome, SRUS)。
讨论SRUS是一种罕见的慢性非肿瘤性疾病,常发生于20~40岁青年人,是黏膜脱垂综合征中最常见的类型,临床主要表现为排便困难、疼痛和血便[1-2]。SRUS多发生于距肛门4~15 cm的直肠前壁,内镜下最常见单个溃疡,其次为多个溃疡、息肉状或增生性病变,也可仅表现为红斑、糜烂[3-4]。采取大便软化剂、高纤维饮食、药物和生物反馈等保守治疗可改善大多数SRUS患者症状,对保守治疗无效的患者可采取内镜下黏膜剥离术,行经肛门直肠切除术等手术治疗[5-6]。
SRUS需与一系列良恶性疾病鉴别:(1)Peutz-Jeghers息肉:其典型形态可见腺体间增生的平滑肌呈树枝状,腺体周围固有层间质存在,无明显的炎症反应;也可结合临床鉴别。(2)炎性假息肉:常见于炎症性肠病患者,通常不会局限于直肠,可出现更广泛的浆细胞和淋巴细胞浸润,固有层内无增生的平滑肌。(3)子宫内膜异位症:常可见子宫内膜型腺体、子宫内膜间质和出血,免疫组化标记ER、PR、CD10阳性也可协助鉴别。(4)腺瘤:腺瘤会出现细胞异型。恶性疾病主要与浸润性腺癌鉴别,浸润性腺癌可出现促纤维结缔组织增生反应,腺体结构复杂、细胞异型显著。当SRUS中出现无细胞黏液湖时,尤其黏液湖推挤至黏膜下时,需与分化好的黏液腺癌鉴别,SRUS黏液湖中腺体异型不明显,无漂浮的异型上皮细胞。
Sadakierska-Chudy等[7]对1例直肠黏膜脱垂的11岁女童及其父母和姐姐进行全外显子组测序,该女童的COLGALT2基因第11外显子发现新的杂合错义突变(c.1406G>T),并通过Sanger测序验证,其父母和姐姐均未携带该变异。计算机预测模型分析该突变可影响胶原半乳糖转移酶[collagen beta(1-O)galactosyltransferase 2, COLGALT2/GLT25D2]的稳定性和功能,可能会影响胶原的表达。
COLGALT2基因位于1号染色体长臂(1q25.3),包含13个外显子,编码GLT25D2[8]。GLT25D2由626个氨基酸组成,在大脑、肌肉和胃肠道中表达较高[7],在胶原蛋白糖基化修饰中起重要作用。
胶原蛋白是结缔组织具有连接、支持和保护功能的基础。糖基化修饰在调节胶原蛋白折叠和稳定性方面起重要作用[9]。Schegg等[10]证实GLT25D1和GLT25D2是催化胶原糖基化修饰的两种酶。GLT25D1的活性降低可影响脑血管基膜中胶原蛋白的合成,导致脑小血管疾病的发生[11]。
结合其他的研究结果,作者推测本例患儿可能是由于胶原蛋白表达异常,腹壁腹横筋膜和直肠黏膜附着点的功能降低,导致腹股沟疝的反复发生和SRUS。胶原蛋白代谢紊乱,导致腹股沟区腹横筋膜薄弱或缺失,腹壁抵抗拉力能力下降,在腹内压力增高时,形成腹股沟疝。胶原蛋白表达异常使黏膜松弛,在排便、腹内压增高时,移位的黏膜无法回到原位而发生黏膜脱垂,加重排便困难,导致该区域黏膜缺血,最终发生SRUS。
SRUS的内镜和临床表现缺乏特异性,需与恶性疾病相鉴别,准确诊断是为患者提供有效治疗的关键。SRUS的发病机制尚不完全清楚,胶原蛋白代谢紊乱与SRUS的关系尚需进一步研究。

