结直肠癌中GIPC2表达及临床病理意义
刘雅新,闫文卿,马怡君,韩 微,周彩婷,吴 艳,严雪冰,徐 健,王 磊
我国结直肠癌的发病率位居所有恶性肿瘤的第3位,病死率位居第5位[1],早期因无明显症状易被忽视[2]。目前临床多采用肠镜、影像学检查、病理活检等方式综合诊断,术后主要依据TNM分期进行预后评判,目前仍缺乏更为有效的早期诊断和预后评判标志物。多项研究表明GIPC2在多种肿瘤中的表达发生变化,如在胃癌中表达上调,在肾癌和肾上腺皮质癌中表达下调[3]。GIPC2在结直肠癌中的表达尚无相关报道。本组前期在以m6A甲基化修饰和上皮-间充质转化(epithelial-mesenchymal transition, EMT)构建的结直肠癌多基因模型分析中发现,GIPC2表达发生显著改变[4]。现通过GEPIA数据库检索并预测GIPC2在结直肠癌中的表达情况;采用免疫组化法检测GIPC2在结直肠癌组织中的表达,分析其与临床病理特征、患者预后之间的关系,以探讨GIPC2在结直肠癌诊疗和预后评判中的意义。
1 材料与方法
1.1 临床资料收集2021~2022年扬州大学附属医院行手术治疗的结直肠癌患者95例,所有病例均经术后病理检查确诊,且均为结直肠原发病例,患者术前未行其他相关治疗,临床资料均完整。回顾性分析其临床资料并通过电话随访,将临床病理特征分组:年龄、性别、大体类型、肿瘤最大径、分化程度、淋巴结转移情况、TNM分期。其中,≤60岁21例,>60岁74例;男性54例,女性41例;肿瘤最大径≤5 cm的62例,>5 cm的33例;大体类型中,隆起型36例,溃疡型59例,无弥漫型;高分化4例,中分化70例,低分化21例;淋巴结转移38例,无淋巴结节转移57例;Ⅰ期12例,Ⅱ期44例,Ⅲ期36例,Ⅳ期3例。
1.2 方法免疫组化检测采用手工SP染色法:73 ℃烤片箱烤片后,脱蜡脱水,于高压锅中以pH 6.0的柠檬酸盐修复液煮沸后晾凉;再加入适量内源性过氧化物酶阻断剂,室温10 min后PBS洗净;加入适量GIPC2(上海雅吉生物公司)过夜后用PBS冲洗,再加入适量二抗37 ℃孵育30 min;加入DAB显色后用水冲洗,苏木精染色,分化、冲洗反蓝、脱水透明,封固[5]。
1.3 结果判定免疫组化染色强度分数判定:(1)按染色强度评分:无阳性着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。(2)按阳性细胞百分比评分:≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分。将两项得分结果相乘:0~7分为低表达,8~12分为高表达[6]。依据抗体使用说明,GIPC2阳性定位于细胞质。
1.4 GEPIA数据库分析GEPIA是以癌症基因组图谱TCGA和基因型-组织表达GTEx数据为基础的应用程序[7]。本研究通过GEPIA数据库分析GIPC2在不同肿瘤和其对应癌旁正常组织中的表达差异,及其与结直肠癌患者TNM分期和预后的相关性。
1.5 统计学分析采用SPSS 25.0软件进行统计学分析,计数资料以例数和百分率(%)描述,组间差异采用χ2检验或Fisher确切概率法。生存分析采用Kaplan-Meier法,生存曲线比较采用Log-rank检验,评估GIPC2表达与结直肠癌患者预后的关系。以上均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 GEPIA数据库分析结直肠癌中GIPC2表达在m6A甲基化修饰及EMT构建的结直肠癌多基因模型的生信分析中,筛选EMT基因进行加权基因共表达网络分析,应用Cox分析筛选出与m6A相关的模块基因,通过分析风险比及预后显著性,得到特征基因合计9个,其中GIPC2:HR=1.57,P<0.001,提示GIPC2与结直肠癌的发生密切相关;GEPIA数据库检索结果显示,GIPC2在多种肿瘤中的表达发生变化,其在结直肠癌组织中的表达显著低于癌旁正常肠组织(图1A);生存预测显示,低表达GIPC2的患者生存率更低(图1B);GIPC2与结直肠癌的TNM分期密切相关(图1C)(P<0.01)。

图1 GEPIA数据库分析:A.GIPC2在结直肠癌组织和癌旁正常肠组织中的表达;B.GIPC2表达与结直肠癌患者预后的关系;C.GIPC2表达与结直肠癌TNM分期的关系
2.2 结直肠癌组织和癌旁正常肠组织中GIPC2的表达免疫组化结果显示,GIPC2表达定位于腺上皮胞质(图2)。95例结直肠癌中GIPC2高表达40例(42.1%)(图2A),低表达55例(57.9%)(图2B);对应癌旁正常肠组织中GIPC2高表达82例(86.3%)(图2C),低表达13例(13.7%)(图2D)。与癌旁正常肠组织相比,结直肠癌组织中GIPC2多呈低表达,两组相比差异有显著性(P<0.001)。
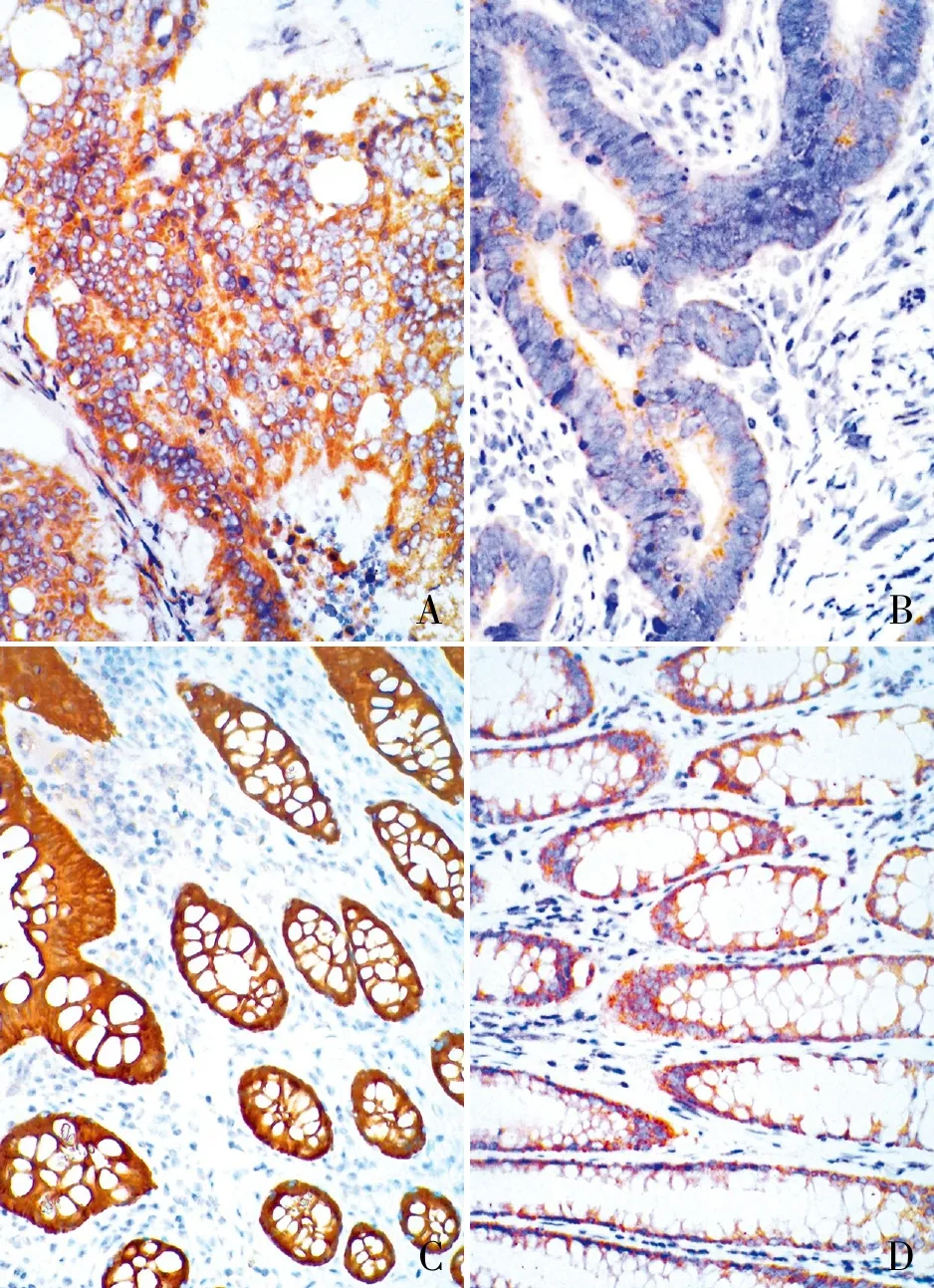
ABCD
2.3 GIPC2表达与结直肠癌临床病理特征的相关性统计分析显示,GIPC2表达与患者性别、年龄、肿瘤大体类型和肿瘤最大径无关(P均>0.05);与淋巴结转移、肿瘤分化程度和TNM分期相关(P均<0.05,表1)。
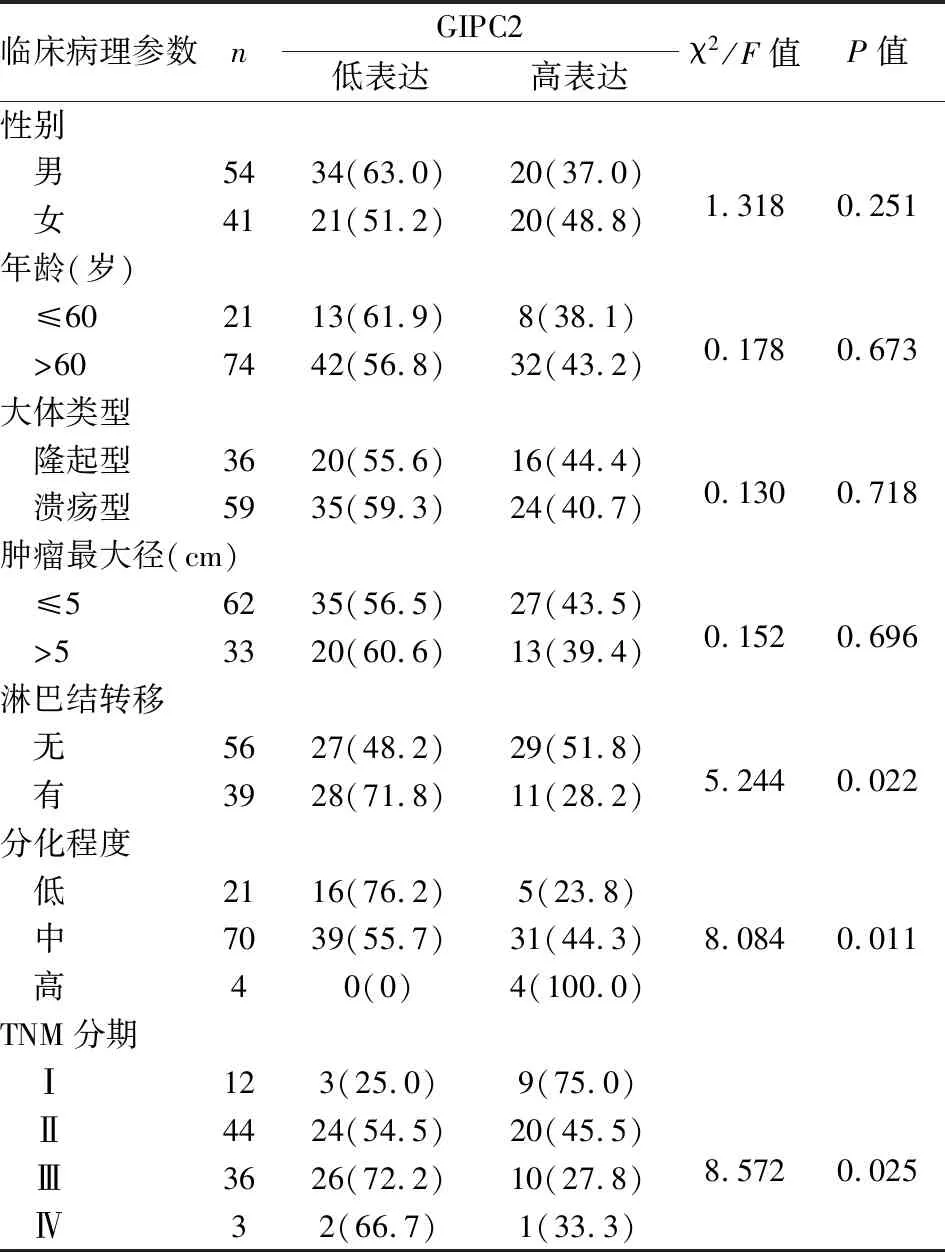
表1 GIPC2表达与结直肠癌临床病理特征的相关性[n(%)]
2.4 GIPC2表达与结直肠癌患者预后的关系95例结直肠癌患者中19例失访。生存分析结果显示,低表达GIPC2结直肠癌患者的2年生存率(47.3%)明显低于高表达GIPC2患者(72.5%),差异有统计学意义(P<0.05,图3)。
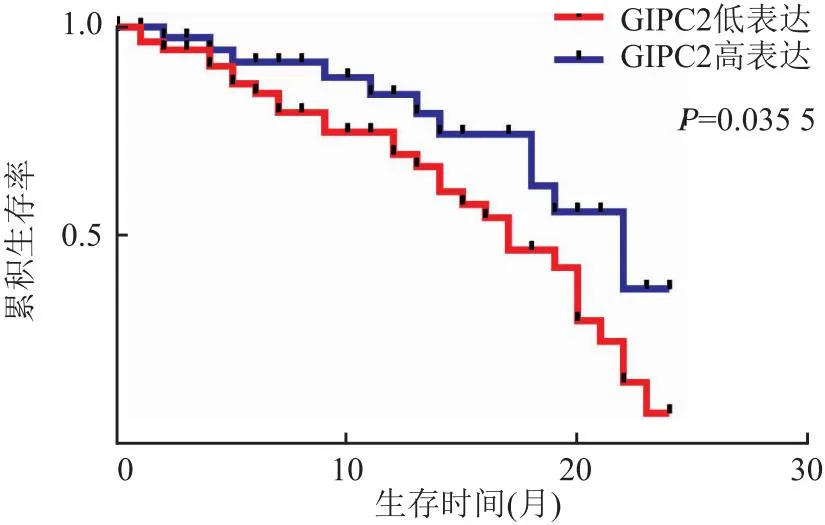
图3 Kaplan-Meier法分析GIPC2表达与结直肠癌患者预后的关系
3 讨论
结直肠癌来源于结直肠黏膜上皮,常由基因突变引起,基因异常表达可影响结直肠癌的发生[8]。结直肠癌肿瘤标志物现以CEA、CK20、Villin、CDX-2、HER2等为主,对诊断、治疗和预后具有一定的意义[9]。因结直肠癌早期缺乏特异性体征,中晚期病变深入盆腔,导致患者预后不良[10]。因此,寻找有效的早期诊断指标和治疗靶点成为临床研究的热点。
GIPC基因由GH1、GH2和PDZ三个结构域共同构成[11]。GIPC2(GIPC PDZ domain containing family member 2)与GIPC1和GIPC3共同构成GIPC家族,具有进化的保守性和功能的相似性。GIPC1可与多种蛋白相互作用,参与跨膜分化程度和TNM分期的组间比较采用Fisher确切概率法,其余采用χ2检验蛋白转运、调控信号通路等[12]。有报道称,GIPC2是一种内分泌特异性肿瘤抑制基因,在嗜铬细胞瘤中表达下调,激活p27的转录和表达,从而抑制细胞增殖和细胞周期[13]。此外GIPC2在急性淋巴细胞白血病中的表达下调,在雌激素诱导的乳腺肿瘤中表达上调;GIPC2的体细胞突变发生于黑色素瘤和卵巢癌中;GIPC2的高甲基化和低表达则导致乳头状肾细胞癌患者的存活率低[14]。最新研究表明m6A甲基化修饰通过多种途径参与调控结直肠癌的分化增殖过程,其主要转录因子Snail、ZEB1/2和Twist1/2可能发挥重要作用[15]。有研究证实EMT转录因子的表达水平与结直肠癌患者的总生存率有关[16]。还有研究指出,在结直肠癌组织中GIPC2 mRNA和蛋白水平均显著下调[17]。截至目前,GIPC2在结直肠癌中的表达及临床意义尚未见详细报道。
基于m6A甲基化修饰和EMT构建结直肠癌多基因预后模型的研究结果提示,GIPC2表达与结直肠癌的发生、发展可能密切相关[4]。GEPIA数据库的检索也预测了结直肠癌中GIPC2的表达低于癌旁正常肠组织。本组免疫组化染色显示,GIPC2表达于腺上皮胞质,在正常肠组织中呈高表达,在结直肠癌组织中呈低表达;GIPC2在结直肠癌中的阳性率明显降低(P<0.05)。GIPC2表达与肿瘤分化程度、淋巴结转移和TNM分期相关(P<0.05),这些结果均提示了GIPC2参与肿瘤侵袭和发展的过程,并且其表达水平越低,肿瘤分化越差。生存分析表明,低表达GIPC2患者较高表达患者的生存率更低(47.3%vs72.5%,P<0.05),推测GIPC2的下调很可能导致患者不良预后,其可以作为评估患者预后的指标。临床可通过免疫组化检测GIPC2表达为结直肠癌患者的临床治疗和预后评判提供一定的参考。
综上,GIPC2可能参与结直肠癌的发生、发展、侵袭和转移,影响患者预后,未来有可能作为新的结直肠癌临床诊断和预后评估的可靠指标。后续我们将扩大样本量并改进免疫组化手工染色方法,进一步探讨GIPC2在结直肠癌中的作用机制。

