两种养殖蛙类肌肉品质、肠道形态学及微生物构成比较分析
王志龙 ,夏 耘,谢 骏,舒 锐,王广军,郁二蒙,雷小婷,龚望宝
1. 水产科学国家级实验教学示范中心 (上海海洋大学),上海 201306
2. 中国水产科学研究院珠江水产研究所/农业农村部热带亚热带水产资源利用与养殖重点实验室,广东 广州 510380
3. 广东省星蛙农业科技有限公司,广东 肇庆 526070
牛蛙 (Lithobatescatesbeiana) 原产于北美洲,具有繁殖快、适应性强、生长迅速等优点,已成为我国主要养殖蛙类[1];泰国虎纹蛙 (Hoplobatrachus tigerinus) 是广东省近年来引进的优良水产养殖蛙类,其养殖投入低、养殖周期短且生长快,现已初步形成产业规模[2]。由于近几年养殖蛙市场需求量大,养殖户大多采用小池高密度养殖模式,且不同养殖品种均使用同一种 (同品牌) 商业人工配合饲料。同种人工饲料是否适宜不同养殖品种的生长和消化,相应的蛙产品肌肉品质是否能满足消费者需求以及如何科学开发饲料配方是养殖蛙产业研究的热点问题。肌肉品质是进入消费市场的重要评价指标,而肠道菌群一定程度上可反映养殖蛙的消化特性,这些基础数据对蛙类养殖和配合饲料的可持续开发至关重要。
肌肉品质包括营养价值和质构特性等[3],肌肉营养价值通常由蛋白质和氨基酸、脂肪和多不饱和脂肪酸的组成来作为评估指标[4],肌肉质构特性则由肌肉的硬度、黏性、弹性、咀嚼性、胶黏性和内聚性等质构参数来体现[3]。有关养殖蛙的肌肉营养价值,有学者针对黑斑蛙 (Pelophylaxnigromaculatus)[5]、棘胸蛙 (Quasipaaspinosa)[6]、泰国虎纹蛙[7]、东北林蛙 (Ranadybowskii) 和牛蛙[8]肌肉营养组成开展了部分研究。然而,国内外有关养殖蛙类肌肉质构特性的研究报道较少,而肌肉质构是产品进入消费市场的重要评价指标。
肠道菌群与宿主的消化、营养吸收、代谢和生理功能密切相关[9]。目前,已报道肠道菌群的养殖蛙类有棘胸蛙[10]、黑斑蛙[11]、虎纹蛙 (H.chinensis)[12]等,但对泰国虎纹蛙和牛蛙肠道菌群的研究较少。开展人工养殖条件下泰国虎纹蛙和牛蛙肠道显微结构和微生物群落结构研究,有助于分析其对饲料的消化吸收及生长特性。本研究通过测定泰国虎纹蛙和牛蛙的肌肉营养组成和肌肉质构特性对其肌肉品质进行全面评价,通过高通量测序技术和组织切片技术分析两种养殖蛙的肠道微生物群落构成和显微结构,旨在全面了解泰国虎纹蛙和牛蛙的肌肉品质和肠道菌群差异,为养殖蛙类的开发利用及配合饲料的研制提供基础资料。
1 材料与方法
1.1 样品采集
鲜活的成年雄性牛蛙和泰国虎纹蛙 (投喂同种膨化配合饲料) 取自广东省星蛙农业科技有限公司花都养殖基地。采用小池高密度养殖模式,养殖密度为140 只·m−2,养殖水位为5~10 cm,水温为 (28±2) ℃。配合饲料营养成分组成 (w):水分9.34%、粗蛋白质41.90%、粗脂肪5.78%、粗灰分9.48%。同一种蛙随机选择大小均一、形态相近的个体各6 只,泰国虎纹蛙体质量为 (125.28±2.56) g,牛蛙体质量为 (151.87±3.15) g。毁髓处死后,每只蛙取1 cm 大小的腿部肌肉组织,并于前肠相同肠道部位切取肠道组织各1 cm,用4% (φ) 多聚甲醛溶液固定,用于组织切片制作;将其余含有内容物的肠道组织迅速取出,液氮速冻后于−8 0 ℃保存,用于肠道菌群分析;沿着肌纤维剪取腿部肌肉组织,切成1 cm×1 cm×2 cm 的长方体组织块,用于质构特性检测;腿部其余肌肉用于营养成分测定。每组做6 个重复 (n=6)。
1.2 肌肉营养成分测定
按照鲜质量计算各营养成分的含量。参照GB 5009.5—2016 (凯氏定氮法)、GB 5009.6—2016 (索氏抽提法)、GB 5009.3—2016 (直接干燥法) 和GB 5009.4—2016 (第一法) 分别检测两种蛙肌肉的粗蛋白、粗脂肪、水分和灰分含量。使用全自动氨基酸分析仪参照GB 5009.124—2016 测定氨基酸组成;由于采用酸水解处理样品,色氨酸被酸解,未测定。使用气相色谱仪参照GB 5009.168—2016 分析脂肪酸种类和含量。根据联合国粮农组织/世界卫生组织 (FAO/WHO) 提出和1991 年中国预防医学科学院提出的氨基酸评分模式,计算氨基酸评分(Amino acid score, AAS)、化学评分 (Chemical score,CS) 和必需氨基酸指数 (Essential amino acid index,EAAI)[13]。
1.3 肌肉质构测定
将肌肉组织块放在CT3 质构仪 (Brookfield 公司,美国) 上,探头为P35,采用TPA 模式进行测定,测前速度为2 mm·s−1,测试速度为1 mm·s−1,测后速度为5 mm·s−1,2 次压缩的时间间隔为2 s,压缩比为25%,对肌肉质构特性进行测定。
1.4 组织切片观察
组织切片:对肌肉和肠道组织按照固定、脱水、透蜡、包埋、切片和染色的顺序进行操作,最终制作成组织切片。按照S=πr2计算肌纤维直径(S为肌纤维横切面面积;r为肌纤维横切面半径;π 为圆周率) ;并测量统计不同区域内肌纤维的数量和面积,计算肌纤维密度。每个样本对300 条肌纤维进行统计。
1.5 肠道菌群高通量测序
按照EZNA®Soil DNA Kit 试剂盒 (Omega Biotek) 说明书提取肠道菌群总DNA。DNA 浓度和纯度使用NanoDrop2000 检测。以正向引物338F (5'-ACTCCTACGGGAGGCAGCA-3') 和反向引物806R(5'-GGACTACHVGGGTWTCTAAT-3') 扩增16S rRNA基因V3—V4 区。20 μL PCR 反应体系为:10 μL 2×Pro Taq,正向引物和反向引物 (5 mmol·L−1) 各0.8 μL,10 ng DNA 模板,ddH2O 补足至20 μL。PCR 过程:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,29 个循环;最后72 ℃延伸10 min。利用AxyPrep DNA Gel Extraction Kit 进行PCR 产物纯化,使用Illumina 测序专用的TruSeqTMDNA Sample Prep Kit 试剂盒建立基因文库。构建好的文库通过Illumina Miseq PE300 平台进行测序,由上海美吉生物医药科技有限公司完成。对获得的原始测序序列进行过滤、双端拼接,得到优化序列(Tags);将优化序列进行聚类,划分操作分类单元(Operational taxonomic units, OTU),并根据OTU 的序列组成得到其物种分类。基于OTU 分析结果,在美吉生物云平台 (https://cloud.majorbio.com) 上利用R 语言 (version 3.3.1) 软件进行Alpha 多样性指数分析、显著物种差异分析及功能差异预测分析。具体测定和分析方法参照Xia 等[14]。
1.6 统计学分析
2 结果
2.1 常规营养成分
如表1 所示,牛蛙的粗脂肪含量显著高于泰国虎纹蛙,而泰国虎纹蛙的灰分含量显著高于牛蛙(P<0.05)。泰国虎纹蛙和牛蛙的水分含量和粗蛋白含量均无显著性差异 (P>0.05)。
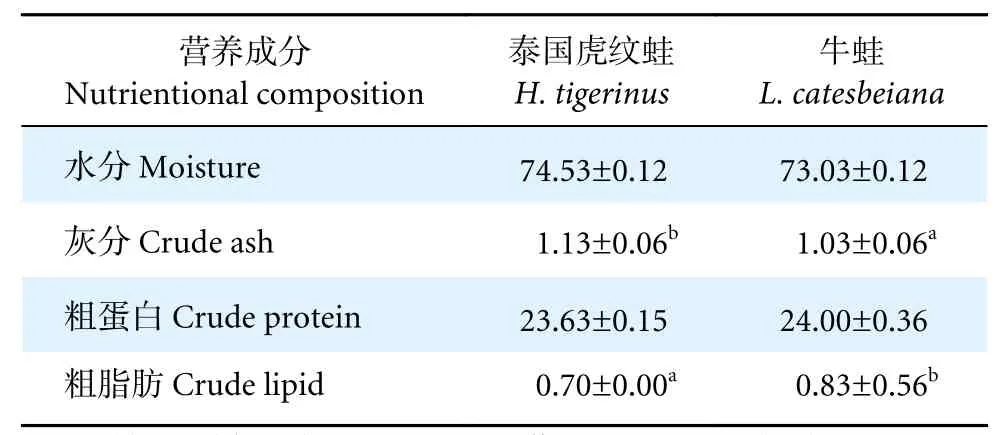
表1 泰国虎纹蛙和牛蛙每100 g 肌肉常规营养成分比较Table 1 Comparison of conventional nutrients per 100 g of muscle between H. tigerinus and L. catesbeian g
2.2 氨基酸含量
在两种养殖蛙肌肉中均检测到16 种氨基酸,其中必需氨基酸7 种,非必需氨基酸9 种 (表2)。两种蛙的甘氨酸含量均最高,其次是天门冬氨酸和异亮氨酸。除泰国虎纹蛙的苏氨酸含量显著高于牛蛙外 (P<0.05),其余氨基酸之间无显著性差异(P>0.05)。两种蛙的必需氨基酸 (Essential amino acids, EAA)、非必需氨基酸 (Non-essential amino acids, NEAA)、呈味氨基酸 (Flavor amino acids,FAA)、支链氨基酸 (Branched chain amino acids,BCAA)、芳香氨基酸 (Aromatic amino acids, AAA)与氨基酸总量 (Total amino acids, TAA) 均无显著性差异 (P>0.05)。
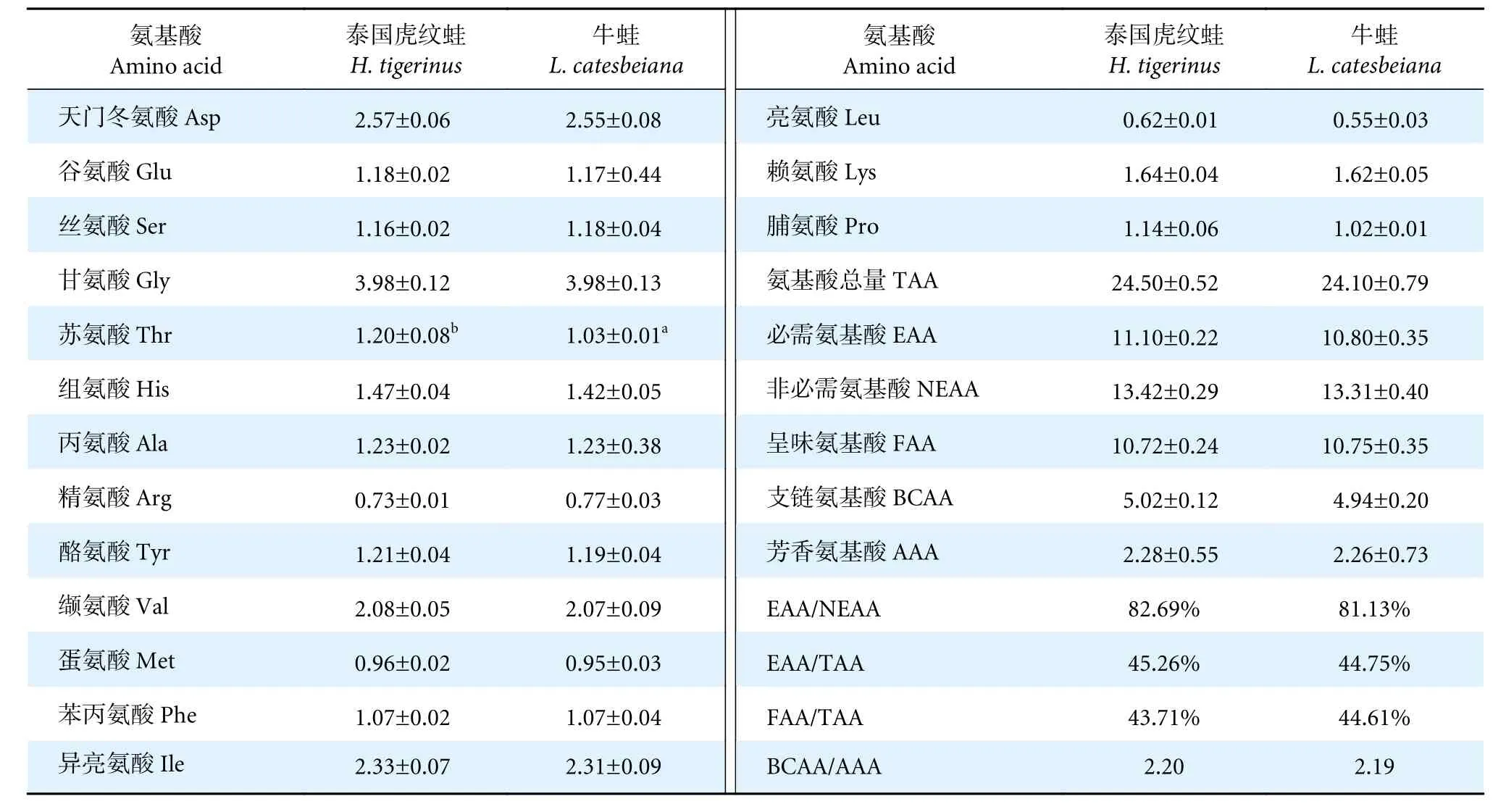
表2 泰国虎纹蛙和牛蛙每100 g 肌肉氨基酸比较Table 2 Comparison of amino acids per 100 g of muscle of H. tigerinus and L. catesbeiang
2.3 氨基酸营养品质评价
对泰国虎纹蛙和牛蛙肌肉必需氨基酸进行氨基酸评分(表3),两者除异亮氨酸的AAS (0.58)外,其他均小于0.50;两者异亮氨酸的化学评分最高。
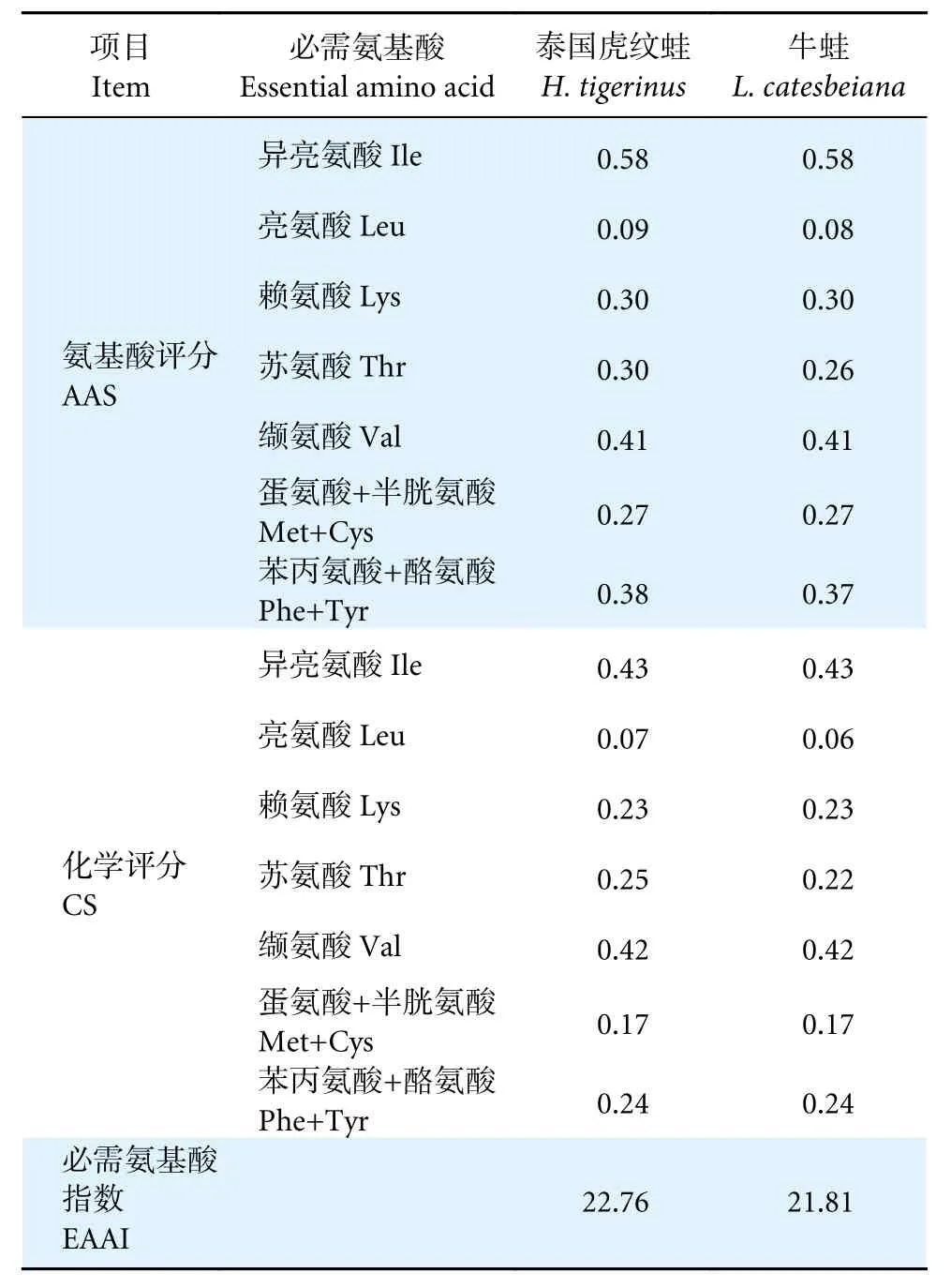
表3 泰国虎纹蛙和牛蛙肌肉氨基酸营养价值评价Table 3 Evaluation of amino acids traits in muscles of H. tigerinus and L. catesbeiana
2.4 脂肪酸含量
两种蛙的肌肉中均含有22 种脂肪酸 (表4),包括饱和脂肪酸酸 (Saturated fatty acids, SFA)8 种,不饱和脂肪酸 (Unsaturated fatty acids, UFA)14 种;单不饱和脂肪酸 (Monounsaturated fatty acids, MUFA) 6 种,多不饱和脂肪酸酸 (Polyunsaturated fatty acids, PUFA) 8 种。从总体脂肪酸含量来看,泰国虎纹蛙为多不饱和脂肪酸>饱和脂肪酸>单不饱和脂肪酸,牛蛙为多不饱和脂肪酸>单不饱和脂肪酸>饱和脂肪酸,其中泰国虎纹蛙肌肉中饱和脂肪酸含量显著高于牛蛙 (P<0.05);牛蛙肌肉中单不饱和脂肪酸含量显著高于泰国虎纹蛙 (P<0.05),而多不饱和脂肪酸含量显著低于泰国虎纹蛙 (P<0.05)。
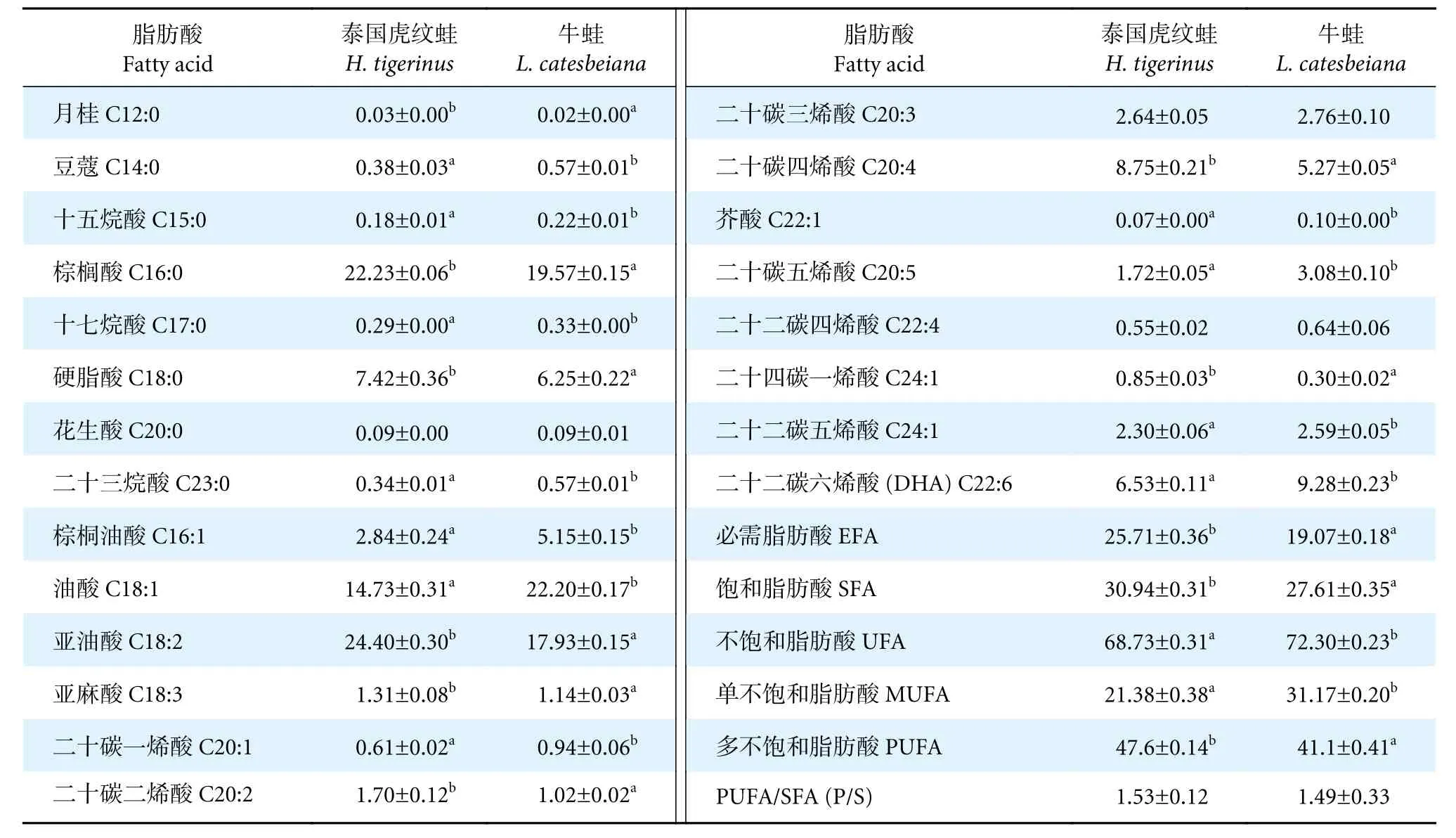
表4 泰国虎纹蛙和牛蛙每100 g 肌肉脂肪酸比较Table 4 Comparison of fatty acids in per 100 g muscles of H. tigerinus and L. catesbeianag
泰国虎纹蛙的必需脂肪酸 (Essential fatty acids,EFA) 含量显著高于牛蛙 (P<0.05),其中,亚油酸和亚麻酸显著高于牛蛙 (P<0.05)。SFA 中,除C20:0 含量在两种蛙间不显著外 (P>0.05),其余各脂肪酸含量在两者之间均有显著性差异 (P<0.05)。UFA 中,除C20:3 和C22:4 在两种蛙间不显著外(P>0.05),其余各脂肪酸含量在两者间均有显著性差异 (P<0.05),此外,P/S 介于1.49~1.53,符合WHO 建议值 (P/S≥0.4)。
2.5 肌肉质构特性
如表5 所示,牛蛙肌肉的硬度、咀嚼性、胶黏性均显著高于泰国虎纹蛙 (P<0.05),而黏性显著低于泰国虎纹蛙 (P<0.05)。此外,两者肌肉的弹性和内聚性无显著性差异 (P>0.05)。

表5 泰国虎纹蛙和牛蛙肌肉质构特性的比较Table 5 Comparison of texture properties in muscle of H. tigerinus and L. catesbeiana
2.6 肌肉和肠道形态结构比较
泰国虎纹蛙和牛蛙的肌肉和肠道形态结构如图1 所示。两者肌纤维完整,排列规则,纤维大小与间隙均匀一致。牛蛙肌纤维直径显著大于泰国虎纹蛙 (P<0.05),而两者的肌纤维密度无显著性差异(P>0.05,表6)。
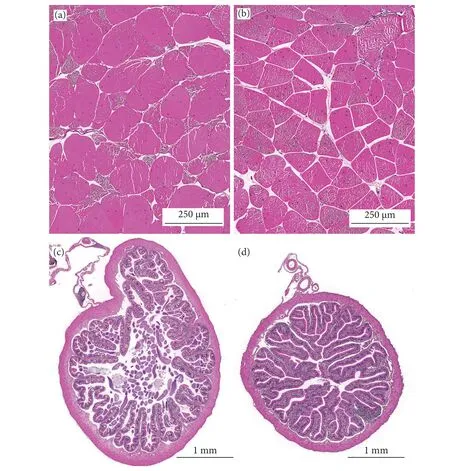
图1 泰国虎纹蛙和牛蛙肠道和肌肉的组织结构Fig. 1 Tissue structures of intestine and muscle of two frogs species
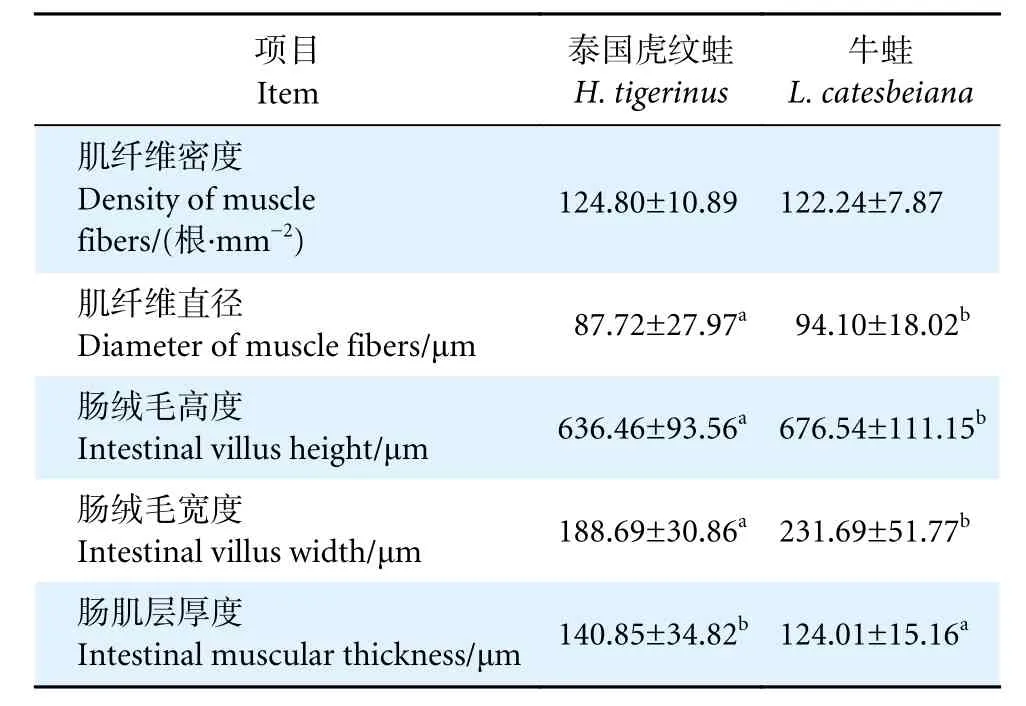
表6 泰国虎纹蛙和牛蛙肌纤维和肠道组织结构比较Table 6 Comparison of muscle fibe and intestine morphology of H. tigerinus and L. catesbeiana
泰国虎纹蛙和牛蛙的肠道组织结构正常,肠壁较厚,结构完整性较好,肠绒毛密且粗壮,末端无破损,在两者的肠绒毛上皮细胞间均可观察到大量的杯状细胞。牛蛙的肠绒毛高度和宽度显著高于泰国虎纹蛙 (P<0.05),而肠肌层厚度则显著低于后者(P<0.05)。
2.7 肠道微生物群落结构
2.7.1 Alpha 多样性指数
高通量测序筛选后共获得945 594 个有效序列,序列长度为201~451 bp,平均长度为426 bp。按照97%的序列相似性可聚类为618 个 OTU。Alpha 多样性分析显示,两种养殖蛙Good_coverage 均高于0.99,说明样本中肠道微生物被充分检出,测序质量良好 (表7)。微生物群落多样性由Shannon 和Simpson 指数来反映,微生物群落丰富度由Ace 和Chao1 指数来反映。泰国虎纹蛙Shannon 指数显著高于牛蛙 (P<0.01),表明泰国虎纹蛙肠道微生物群落多样性高于牛蛙。泰国虎纹蛙肠道的Ace 和Chao1 指数显著高于牛蛙 (P<0.05),表明泰国虎纹蛙肠道微生物的物种丰富度高于牛蛙。
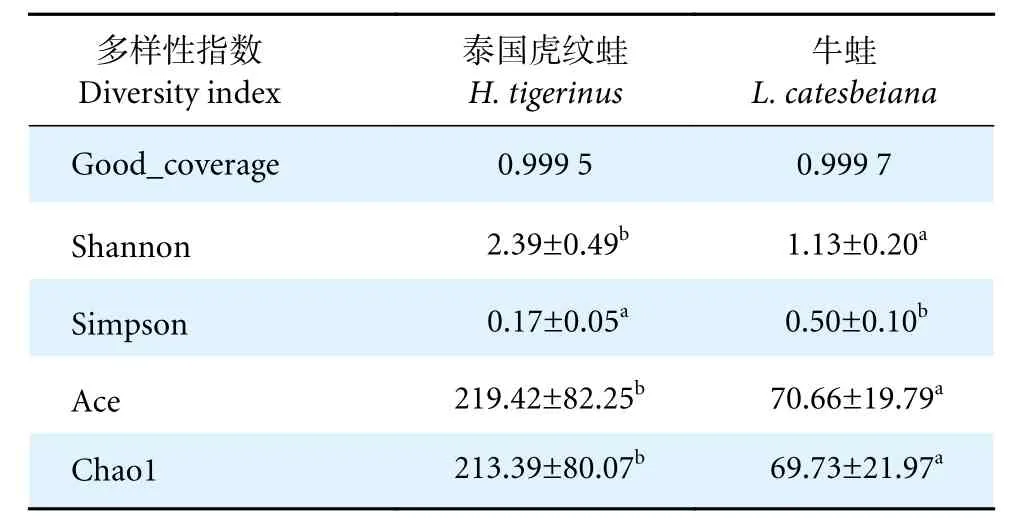
表7 Alpha 多样性指数Table 7 Alpha diversity indices of six samples
2.7.2 OTU 分布
两种养殖蛙之间有98 个 (15.86%) 相同OTU,泰国虎纹蛙有487 个 (78.80%) 独有OTU,牛蛙有33 个 (5.34%) 独有OTU (图2)。泰国虎纹蛙的OTU 数量显著高于牛蛙 (P<0.05),这与Shannon指数的结果一致。
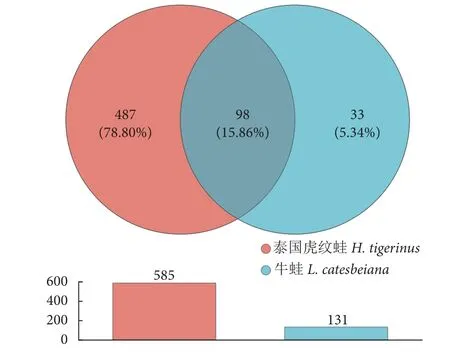
图2 OTU 水平下两种养殖蛙肠道微生物的Veen 图Fig. 2 Veen diagrams of intestinal microbiota in H. tigerinus and L. catesbeiana at OTU level
2.7.3 基于门水平肠道菌群分析
如图3 所示,牛蛙肠道优势菌门是厚壁菌门(92.26%) 和变形菌门 (7.36%)。泰国虎纹蛙优势菌门是厚壁菌门 (63.41%)、变形菌门 (19.43%)、梭杆菌门 (8.70%) 和拟杆菌门 (5.76%)。单因素方差分析显示,牛蛙肠道的厚壁菌门丰度显著高于泰国虎纹蛙 (P<0.05),而放线菌门丰度显著低于后者(P<0.05)。

图3 门水平上的肠道菌群组成Fig. 3 Intestinal microbiota composition at phylum level
2.7.4 基于属水平肠道菌群分析
如图4 所示,泰国虎纹蛙肠道菌群中丰度排名前5 的菌属为乳球菌属 (Lactococcus, 32.34%)、埃希杆菌-志贺菌属 (Escherichia-Shigella, 10.36%)、肠球菌属 (Enterococcus, 10.11%)、鲸杆菌属 (Cetobacterium, 8.62%) 和魏斯氏菌属 (Weissella, 6.90%);牛蛙肠道优势菌属为乳杆菌属 (Lactobacillus,59.30%)、魏斯氏菌属 (15.37%)、明串珠菌属 (Leuconostoc, 10.98%)、柠檬酸杆菌属 (Citrobacter,6.82%) 和乳球菌属 (5.19%)。单因素方差分析显示,泰国虎纹蛙的乳球菌属和埃希杆菌-志贺菌属丰度显著高于牛蛙 (P<0.05),而乳杆菌属和明串珠菌属丰度显著低于后者 (P<0.05)。

图4 属水平上的肠道菌群组成Fig. 4 Intestinal microbiota composition at genus level
2.7.5 肠道微生物功能预测
泰国虎纹蛙和牛蛙肠道菌群功能基因中占比较高的均为与新陈代谢相关的功能基因 (图5),包括碳水化合物代谢、氨基酸代谢、辅助因子和维生素代谢、能量代谢和脂代谢等新陈代谢功能基因,此外,膜转运和信号转导等功能基因也在两者肠道菌群中占有优势。功能预测显示泰国虎纹蛙和牛蛙肠道菌群可能主要参与宿主营养物质转运及代谢等相关进程。

图5 泰国虎纹蛙和牛蛙肠道微生物功能预测Fig. 5 Functional prediction of intestinal microbiota in H. tigerinus and L. catesbeiana
3 讨论
3.1 肌肉常规营养成分
水分是肌肉含量最多的成分,一定程度上来说,肌肉水分充足则肉质更鲜嫩[8],这也是两种养殖蛙类口感鲜嫩多汁的主要原因。灰分是肌肉经高温处理后残留的无机物质,结果显示泰国虎纹蛙的灰分含量显著高于牛蛙。粗蛋白、粗脂肪水平是评价肌肉品质的重要指标,本研究中两种蛙的粗脂肪含量远低于15 种常见的经济淡水鱼类[15],泰国虎纹蛙相比于牛蛙脂肪含量偏低,这可能是由于两者的规格不同。此外,与棘胸蛙[6]、黑斑蛙[10]和双团棘胸蛙 (Paayunnanensis)[16]等养殖蛙类相比,泰国虎纹蛙和牛蛙的粗蛋白含量依然占据优势。泰国虎纹蛙和牛蛙肌肉营养总体呈现高蛋白低脂肪的特点,符合现代人们对高品质膳食的营养需求。
3.2 肌肉氨基酸组成
泰国虎纹蛙和牛蛙氨基酸总量中必需氨基酸的占比分别为45.26%和44.75%,必需氨基酸与非必需氨基酸的比值分别为82.69%和81.13%,优于FAO/WHO 建议的理想模式40%和60%,因此在营养学上,泰国虎纹蛙和牛蛙肌肉均属于优质蛋白质来源。此外,泰国虎纹蛙和牛蛙的第一限制性氨基酸是亮氨酸,第二限制性氨基酸为蛋氨酸。
泰国虎纹蛙和牛蛙肌肉中必需氨基酸含量最丰富的是异亮氨酸,其属于人体必需氨基酸。异亮氨酸具有增强肠道黏膜免疫功能的作用[17],此外其通过调节机体对葡萄糖的摄取来调节肠道发育[18]。适量食用泰国虎纹蛙和牛蛙能够大量补充异亮氨酸,具有一定的保健功效。泰国虎纹蛙中苏氨酸含量显著高于牛蛙,苏氨酸是一种重要的营养强化剂,有缓解人体疲劳、促进生长发育的效果[19]。支链氨基酸具有促进蛋白质的合成、减缓衰老和防治肝肾功能衰竭的作用[20]。高支链氨基酸、低芳香氨基酸混合物对人体肝脏具有保护作用[21]。泰国虎纹蛙和牛蛙肌肉支链氨基酸与芳香氨基酸的比值基本一致,分别为2.20 和2.19,均属于高支链氨基酸、低芳香氨基酸的食品。因此,食用泰国虎纹蛙和牛蛙肌肉可能有助于维持机体肝脏健康。肉类产品鲜美程度一般受呈味氨基酸含量和构成比例的影响,其中天冬氨酸、谷氨酸呈鲜味特性,甘氨酸、丙氨酸则呈甘味特性,且以谷氨酸的鲜味最强[22]。本研究中泰国虎纹蛙和牛蛙肌肉中含量最高的呈味氨基酸均为甘氨酸。泰国虎纹蛙和牛蛙肌肉中呈味氨基酸与总氨基酸的比值 (FAA/TAA) 较高,分别为43.71%和44.61%,这也是其味道鲜美的主要原因。
3.3 肌肉脂肪酸组成
泰国虎纹蛙和牛蛙肌肉中饱和脂肪酸以C16:0 居多,单不饱和脂肪酸以C18:1 居多,多不饱和脂肪酸以C18:2 居多。两者饱和脂肪酸中含量最高的是C16:0,其次是C18:0;前者能使血清胆固醇降低,起到改善胰岛素抵抗的作用[23],后者可以减少肠道胆固醇吸收进而使肝脏胆固醇含量降低[24]。不饱和脂肪酸具有降血脂、预防心血管疾病和促进生长发育的功能[25],此外,不饱和脂肪酸含量对于肉质风味的形成具有重要作用[26],牛蛙的不饱和脂肪酸含量显著高于泰国虎纹蛙,说明其具有更好的风味和保健效果。单不饱和脂肪酸的适量摄入可以使低密度脂蛋白水平和冠心病发生率显著降低[27]。C18:1 可降低血液总胆固醇含量,减少动脉粥样硬化与心脏病的患病风险[28]。牛蛙的单不饱和脂肪酸和C18:1 含量显著高于泰国虎纹蛙,拥有更好的心脏保健效果。多不饱和脂肪酸含量与肉质加热过程中产生的香气成正比[29],一定程度上体现了肌肉的多汁性;多不饱和脂肪酸具有控制血压、血脂和抗肿瘤的作用[30],还具有延缓衰老等保健功效。泰国虎纹蛙的多不饱和脂肪酸含量显著高于牛蛙,其肌肉口感更具多汁性。C22:6(DHA) 是人体必需脂肪酸,具有保护心肌及血管、治疗癌症、增强视力和健脑的功能[22]。牛蛙DHA 含量比泰国虎纹蛙更高,因此从DHA 含量角度来看,食用牛蛙的保健效果更佳。P/S 是衡量脂肪酸营养价值的重要指标,WHO 建议P/S 应高于0.4[31]。泰国虎纹蛙和牛蛙的P/S 介于1.49~1.53,超过一般的经济鱼类 (0.35~1.25)[32],说明泰国虎纹蛙和牛蛙是很好的脂肪酸营养食物源。可见,泰国虎纹蛙和牛蛙具有较高的脂肪酸营养价值,可对其营养和保健功效进行开发利用。
3.4 肌肉形态结构与质构特性
肌纤维是肌肉的基本组成单位,肌纤维直径会影响肌肉的质地和结构参数,如硬度、弹性和咀嚼性等[33],且肌纤维直径越大,肌肉硬度越高[34],而高弹性、高硬度的肌肉口感更佳[33]。肌肉形态学显示牛蛙肌纤维直径大于泰国虎纹蛙,这与肌肉质构特性的结果相一致。因此,从肌肉质构特性的角度看,牛蛙肌肉的食用口感更佳。
3.5 肠道形态结构和微生物多样性
肠绒毛高度、宽度和肌层厚度常用于评价肠道形态健康[35]。肠道绒毛的形态结构对其消化吸收营养物质的能力有着直接影响[36],肠绒毛的高度和宽度影响营养物质消化的速度;而食糜主要通过肠道肌层的收缩进行机械消化,因而肠肌层厚度的增加有利于机体对食糜的充分消化[37]。牛蛙肠绒毛高度和宽度均大于泰国虎纹蛙,表明牛蛙肠道消化吸收能力更优;而泰国虎纹蛙肠肌层厚度显著高于牛蛙,说明其对食糜的机械消化能力更胜一筹。
肠道微生物群落参与宿主的消化、代谢调节、免疫系统调控等过程。刘文舒等[12]发现虎纹蛙肠道优势菌门为厚壁菌门、变形菌门、拟杆菌门和梭杆菌门,与本研究结果相似。邵闯等[38]研究发现牛蛙肠道优势菌门为解糖微小寄生菌门、放线菌门及变形菌门,与本研究结果存在差异。以全豆粕蛋白为饲料来源的牛蛙,其肠道优势菌门为变形菌门、梭杆菌门和厚壁菌门[39],与本研究结果相似。因此,不同饲料可能会影响牛蛙肠道的优势菌。江昀等[40]推测蛙类肠道固有菌群为厚壁菌门、拟杆菌门和变形菌门,基因、年龄、性别以及养殖环境等多种因素会影响其组成比例。泰国虎纹蛙和牛蛙的厚壁菌门和放线菌门丰度差异显著,可能是由于两者基因不同对肠道优势菌产生了影响。
益生菌对维持肠道健康有重要作用,作为添加剂可以提高水产动物的生长率,增强其免疫力和抗病性,但是非宿主来源的益生菌在使用过程中存在潜在风险,宿主来源的益生菌更值得关注和挖掘[41]。乳球菌属[42]、乳杆菌属[43]、肠球菌属[44]、魏斯氏菌属[45]和明串珠菌属[46]是泰国虎纹蛙和牛蛙肠道菌群的优势菌属,均被证实是水产动物的潜在益生菌,对营养吸收、生长发育和抑制有害菌有积极作用;泰国虎纹蛙的乳球菌属丰度显著高于牛蛙,而乳杆菌属和明串珠菌属丰度则显著低于牛蛙,表明两者潜在的益生菌比例构成存在种间差异。鲸杆菌属能提高氨基酸转运和代谢率[47],泰国虎纹蛙中该菌属相对丰度最高,这与功能预测中氨基酸代谢的功能基因丰度的结果相一致。泰国虎纹蛙和牛蛙肠道菌群功能基因中占比较高的均为与新陈代谢相关的功能基因,这有利于提高宿主的生长发育、营养物质转运及代谢性能。
4 结论
泰国虎纹蛙和牛蛙肉质总体呈现高蛋白、低脂肪的特点,具有高质量的必需氨基酸组成以及丰富的不饱和脂肪酸和必需脂肪酸;牛蛙的FAA/TAA和肌肉质构特性优于泰国虎纹蛙,具有更优质的风味和口感。高通量测序显示,泰国虎纹蛙的肠道菌群Alpha 多样性更高;乳球菌属在泰国虎纹蛙肠道中显著富集,而乳杆菌属和明串珠菌属在牛蛙肠道中显著富集;功能预测显示两者肠道菌群可能主要参与宿主营养物质转运及代谢等相关进程。泰国虎纹蛙和牛蛙是平衡膳食营养结构的优质来源,具有良好的开发利用与人工养殖前景。

