鲜胚移植周期超声参数预测体外受精-胚胎移植患者妊娠结局的临床价值
王付敏 申向辉 尹素芳 侯晓英 张 欢
近年来,我国不孕症发病率逐渐上升,随着科学技术的发展及人们生活观念的改变,多数不孕的女性最终会选择体外受精-胚胎移植(in vitro fertilizationembryo transfer,IVF-ET)[1]。目前鲜胚移植技术胚胎着床率为40%~60%,IVF-ET 技术的研究重点仍聚焦于提高患者的妊娠成功率[2-3]。研究[4]表明,IVF-ET患者妊娠成功率与胚胎本身质量、子宫整体状态及子宫内膜容受性情况密切相关。子宫内膜容受性是指胚胎被子宫内膜接受和植入的能力,是保证胚胎成功着床,使胎儿和胎盘正常发育的前提,其影响因素包括子宫内膜厚度、形态、血流动力学等[5]。IVF-ET 治疗方案的制定需以子宫内膜容受性参数作为参考依据,超声是目前评价子宫内膜容受性常用的检查方法,子宫内膜类型、容积、血流指数(FI)、搏动指数(PI)和阻力指数(RI)均可对子宫内膜容受性进行评估,但较易受子宫动脉血流灌注波动等因素影响干扰诊断的准确性,而子宫内膜血流参数变化可直观准确地评估内膜运动,实现更精准地探测胚胎着床部位血流灌注状态[6-7]。本研究应用经阴道超声检查IVF-ET患者子宫整体状态及子宫内膜下动脉收缩期峰值血流速度与舒张末期血流速度比值(S/D)、RI、PI、FI、血管指数(VI)、血管血流指数(VFI)和子宫内膜FI、VI、VFI等超声参数,探讨鲜胚移植周期子宫内膜容受性参数预测IVF-ET患者妊娠结局的临床价值。
资料与方法
一、研究对象
选取2020年7月至2023年1月在我院就诊的98例IVF-ET 患者,根据患者移植术后12~14 d 是否妊娠将其分为妊娠组59 例和非妊娠组39 例,其中妊娠组年龄20~40 岁,平均(30.23±4.72)岁,体质量指数(BMI)19~26 kg/m2,平均(22.35±1.54)kg/m2;非妊娠组年龄21~38 岁,平均(29.35±3.95)岁,BMI 18~26 kg/m2,平均(21.74±1.67)kg/m2。纳入标准:①首次接受IVF-ET 治疗;②血常规及肝肾功能正常;③无子宫、卵巢手术史;④促卵泡激素<8 U/ml,基础窦卵泡数≥8 个。排除标准:①入组前1 个月内使用过激素类药物或促排卵药物;②存在自身免疫系统疾病;③伴子宫腺肌症、子宫卵巢内膜异位症、卵巢肿瘤、宫颈病变者;④卵巢功能减退或卵巢功能早衰。本研究经我院医学伦理委员会批准,所有患者均知情同意。
二、仪器与方法
1.超声检查:使用GE Voluson E10彩色多普勒超声诊断仪,RIC 5-9-D 探头,频率4~9 MHz。在移植胚胎当天对患者进行子宫内膜检查,先行常规超声测量子宫内膜厚度,观察子宫内膜形态,依据文献[8]将子宫内膜形态分为三线型(A 型)、过渡型(B 型)、均质强回声型(C型);于子宫矢状切面内膜与肌层交界处能量多普勒获取子宫螺旋动脉血流频谱,检测子宫内膜下S/D、RI和PI。对检测区进行三维重建,通过VOCAL分析软件得到内膜容积,直方图分析软件自动计算FI、VI、VFI;选择内膜下区域厚度1 mm,获得子宫内膜FI、VI、VFI。以上操作均由5年以上工作经验的超声主治医师完成。
2.妊娠诊断标准[9]:新鲜胚胎移植术后12~14 d 行血人绒毛膜促性腺激素检测,检测结果为阳性者行经阴道超声检出宫内妊娠囊、卵黄囊即可诊断妊娠。
3.一般资料获取:通过电子病历获取年龄、BMI;于移植胚胎当天,采集空腹静脉血5 ml,离心后取上清液。采用化学发光法检测血清雌二醇(E2)、促黄体生成素(LH)和促卵泡生成素(FSH)水平。
三、统计学处理
应用SPSS 21.0统计软件,计量资料以x±s表示,两组比较采用独立样本t检验;计数资料以例或率表示,两组比较采用χ2检验。应用Logistic 回归分析IVF-ET患者妊娠结局的独立影响因素,并建立联合应用模型。绘制受试者工作特征(ROC)曲线分析各超声参数单独及联合应用预测IVF-ET 患者妊娠结局的诊断效能;曲线下面积(AUC)比较采用Delong检验。P<0.05为差异有统计学意义。
结果
一、两组患者一般资料比较
两组患者一般资料比较差异均无统计学意义。见表1。
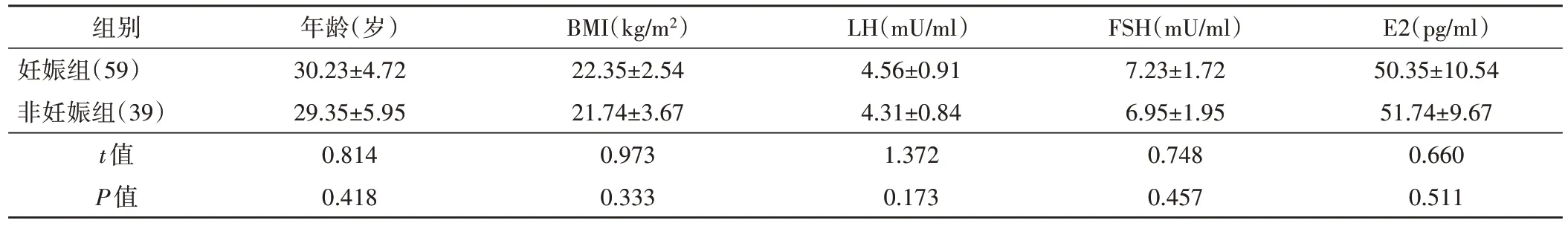
表1 两组患者一般资料比较(x±s)
二、两组患者超声参数比较
妊娠组患者子宫内膜下S/D、PI、RI 均低于非妊娠组,子宫内膜和子宫内膜下FI、VI、VFI 均高于非妊娠组,差异均有统计学意义(均P<0.05);两组患者子宫内膜厚度、容积及形态比较差异均无统计学意义。见表2和图1,2。

图1 妊娠组一患者(30岁)声像图

图2 非妊娠组一患者(29岁)声像图
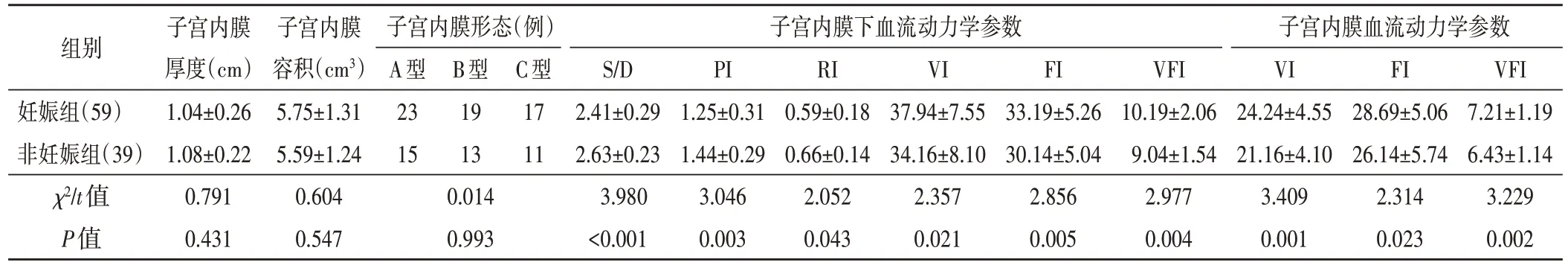
表2 两组患者超声参数比较
三、超声参数预测IVF-ET 患者妊娠结局的诊断效能
1.以子宫内膜下S/D、RI、PI、FI、VI、VFI和子宫内膜FI、VI、VFI为自变量,妊娠结局为因变量进行Logistic 回归分析,结果显示子宫内膜下S/D、PI、VI 和子宫内膜VI、VFI 为预测IVF-ET 患者妊娠结局的独立影响因素(OR=2.782、2.354、2.656、3.529、2.861,均P<0.05),基于此建立联合应用模型为:Logit(P)=-6.013+1.025×子宫内膜下S/D+3.428×子宫内膜下PI+0.831×子宫内膜下VI+0.633×子宫内膜VI+5.934×子宫内膜VFI。
2.ROC曲线分析显示,子宫内膜下S/D、PI、VI和子宫内膜VI、VFI单独及联合应用预测IVF-ET 患者妊娠结局的AUC 分别为0.796、0.736、0.735、0.780、0.725 和0.978,其中联合应用预测IVF-ET 患者妊娠结局的AUC 最高,与各超声参数单独预测的AUC 比较差异均有统计学意义(均P<0.05);其对应的灵敏度为94.9%,特异度为41.0%。见图3和表3。
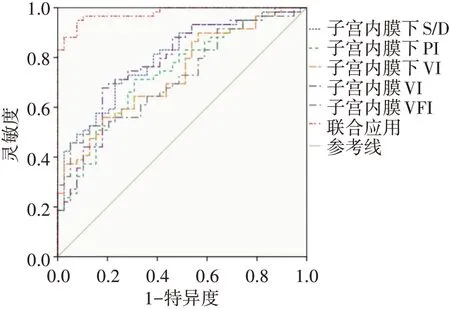
图3 超声参数预测IVF-ET患者妊娠结局的ROC曲线图

表3 超声参数预测IVF-ET患者妊娠结局的ROC曲线分析
讨论
IVF-ET技术的胚胎着床率受子宫内膜容受性、胚胎质量、子宫整体状态及其他因素影响,其中子宫内膜容受性和卵巢反应性均为影响胚胎成功着床的重要指标,研究[10-12]表明,67%的胚胎着床失败可能原因为子宫内膜容受性差。目前临床评估子宫内膜容受性的金标准为子宫内膜活检,但其为有创性检查,患者的接受度和医师的可实施性均不理想。超声能够对患者子宫内膜厚度、容积及形态进行检测,其中经阴道三维超声可更加直观地观察子宫内膜整体状况,在临床诊断及治疗中更具有优势[13-14]。本研究应用经阴道三维超声检测鲜胚移植周期子宫内膜下S/D、RI、PI、FI、VI、VFI 和子宫内膜FI、VI、VFI 等超声参数评估子宫内膜容受性,旨在探讨其联合诊断预测IVF-ET患者妊娠结局的临床价值。
子宫螺旋动脉血管丰富,子宫内膜下S/D、RI、PI、FI、VI、VFI 和子宫内膜FI、VI、VFI 均可准确反映胚胎着床部位的血流灌注情况,进而对患者子宫内膜容受性进行评估[15]。本研究妊娠组患者鲜胚移植周期子宫内膜下PI、S/D、RI 均低于非妊娠组,差异均有统计学意义(均P<0.05),表明PI、RI 的升高可能影响血流灌注状况,导致供血障碍,而较低的血管阻力和良好的卵巢、子宫血流灌注状况则更有利于妊娠[16]。胡涛等[17]研究指出,优质胚胎患者左侧子宫动脉血管阻力低时可促进内膜接纳胚胎,有助于维持妊娠状态,提示右侧子宫动脉PI和S/D对妊娠结局具有一定的预测价值。石富文等[18]研究则认为,自然周期中子宫内膜下血流灌注波动范围较大,较易受各种因素影响干扰诊断的准确性,而子宫内膜血流可真实反映胚胎着床所需的血流灌注状态,直观地显示内膜运动和血流参数变化情况,对子宫的血供进行高效准确的评估。本研究妊娠组患者子宫内膜和子宫内膜下FI、VI、VFI均高于非妊娠组,差异均有统计学意义(均P<0.05),说明子宫螺旋动脉的微血管灌注状况可以客观地评估子宫内膜容受性,且充足的子宫供血和良好的子宫内膜发育状况是成功妊娠的前提。与既往研究[19-21]结论一致。但由于单个指标预测灵敏度和特异度有限,且检测数据的可重复性受患者个体情况和检测人员操作及仪器等客观因素影响较大,本研究应用Logistic 回归分析建立各超声参数联合应用模型,绘制ROC曲线分析各超声参数单独及联合应用预测IVF-ET患者妊娠结局的诊断效能,结果显示子宫内膜下S/D、PI、VI 和子宫内膜VI、VFI 预测IVF-ET 患者妊娠结局的AUC分别为0.796、0.736、0.735、0.780、0.725、0.978,其中各超声参数联合应用预测妊娠结局的AUC 最高,与各超声参数单独预测的AUC 比较差异均有统计学意义(均P<0.05),说明子宫内膜下S/D、PI、VI 和子宫内膜VI、VFI 联合应用的诊断效能优于各超声参数单独应用。其对应的灵敏度为94.9%,但是特异度较低,仅41.0%,分析其原因为临床实际操作中超声检查受设备或人为因素的影响,可能出现妊娠结局良好的IVFET 患者子宫内膜下S/D、PI、RI 降低,VI 升高,以及子宫内膜VI、VFI升高等异常表现,使临床误诊率显著升高,导致各超声参数联合应用的特异度降低。此外,子宫内膜下S/D、PI、VI和子宫内膜VI、VFI等超声参数的检测会受到图像灰度阴影影响,故临床应严格遵循超声检查规范的操作流程,对于有疑问的超声诊断结果应及时进行复查,以降低误诊的风险。
综上所述,鲜胚移植周期子宫内膜下S/D、PI、VI、和子宫内膜VFI、VI 均可预测IVF-ET 患者妊娠结局,且多参数联合检测的预测价值更高。但本研究样本量偏小,且不同型号仪器、检测时间、检测人员均可能对结果有一定影响,待今后扩大样本量深入研究。

