杀菌剂甲基托布津和多菌灵对泥鳅的急性毒性及肝脏酶活性的影响
谭婷,杨超超,杨娜,王琪,雷忻
(1.延安大学生命科学学院,陕西 延安 716000;2.延安市生态恢复重点实验室,陕西 延安 716000)
近年来,随着杀菌剂的广泛使用,其在环境中的残留与日俱增,对生态系统和人类健康产生了潜在的危害[1],引起了人们的关注。甲基托布津(Methyltobuzine,TM,化学分子式为C12H14N4O4L2)是一种广谱内吸性杀菌剂,对禾谷类、蔬菜类、果树上的多种病害有较好的防治作用[2]。TM通过转化为2-苯并咪唑类物质产生杀菌作用,易在生态环境中富集[3]。据报道,在大白菜、黄瓜、柑橘、海带等均可检测到TM残留[4],对水生生物也有一定威胁,如严重破坏萼花臂尾轮虫(Brachionus calyciflorus Pallas)的无性生殖和有性生殖[5],对小球藻(Chlorella)、水蚤(Daphnia)、网状水母(Plathymentia reticulata Blgelou)、虹鳟(Oncorhynchus keta)也可产生毒性效应[6]。TM可对不同生长时期的黄颡鱼(Pelteobagrus fulvidraco)具有较强毒性,影响生长发育相关基因的表达[7]。TM暴露对大鼠产前发育有影响,造成局部性坏死、微泡性脂肪变性、炎症浸润、肝细胞核固缩,并诱发母体毒性效应[8]。多菌灵(Carbendazim,BCM,化学分子式为C9H9N3O2)为食品、土壤和水中经常检测到的主要污染物[9,10],通过农药喷洒和水体径流等方式进入水体环境[11]。佘伟铎等[12]对长江流域重庆段水体和沉积物检测发现,BCM 浓度范围为2.1~46.9 ng·L-1。BCM 不仅可诱导斑马鱼(Danio rerio)快速游动,增加攻击性行为和异常行为的表现[13],还可改变斑马鱼组织中的总蛋白水平,降低鱼类的营养价值以及生理和代谢状态[14],神经毒性作用还显著改变参与抗原处理和呈递、凋亡、自噬和代谢相关基因的表达[15]。目前TM和BCM杀菌剂的毒性效应研究,主要是分析蔬菜、水果等食品的残留与降解,其次是对水生生物的生殖毒性和神经毒性报道较丰富,而2 种杀菌剂对水生生物肝脏代谢的干扰作用及关键生化指标的影响,目前研究报道尚少。一定剂量农药在动物机体内累积可诱发产生大量活性氧(Reactive oxygen species,ROS)[16],攻击机体组织,造成一定程度过氧化损伤,机体需要及时清除或降低过量ROS,其中过氧化物酶(Peroxidase,POD)可将体内过氧化产物转化为H2O 和O2,也是目前评价机体氧化损伤程度的生物标志物[17,18]。同时动物体需对外源化合物进行一系列代谢反应,其中主要包括谷草转氨酶(Aspartate aminotransferase,GOT)和谷丙转氨酶(Glutamate pyruvic transa,GPT)2种关键酶。外源污染物进入机体,组织中GOT 和GPT 大量释放,加速体内代谢产物排出,缓解或消除过氧化带来的组织损伤,维持肝脏组织正常运转,其也可作为污染物毒性检测的生物标志物[19,20]。泥鳅(Misgurnus anguillicaudatus)一般生存在沙泥底层的缓流浅水区,适应能力较强,广泛分布于我国各个水系,可作为毒理学试验的试验模式生物。
本研究通过检测泥鳅96 h 内的死亡数,以评估TM和BCM对6 月龄泥鳅的急性毒性,并检测28 d内TM 和BCM 胁迫对POD、GOT 和GPT 活性的变化,探究两种杀菌剂对泥鳅抗氧化酶的影响及其毒性效应,以期为两种杀菌剂的污染治理和安全合理使用提供科学依据。
1 材料与方法
1.1 材料
6 月龄泥鳅平均体长(6.3±0.7)cm、平均质量(2.4±0.5)g,购于陕西省水产贸易市场。实验开始前,选择体型相当,反应灵敏,体质健康的泥鳅,在实验室环境中用自然脱氯的水驯养7 d,使泥鳅适应环境,每天喂食少量食物。实验开始前一天停止喂食。实验期间,试液每24 h 更换,维持水温在(25±2)℃,pH(7.5±0.2)。
水中农药残留测定仪(CSY-N12A,深圳芬析仪器制造有限公司);酶标分析仪(Multiskan FC,上海博讯公司);高速离心机(KH19A,湖南凯达科学仪器有限公司);恒温水浴锅(DZKW-C,河南沃林仪器设备有限公司);电子分析天平(BCE64-1CCN,聚仪惠供应链有限公司)。
甲基托布津(CAs:23564-05-8,纯度≥95%,上海允发化工有限公司);多菌灵(CAs:10605-21-7,纯度≥98%,江苏蓝丰生物化工股份有限公司);二甲基亚砜(DMSO,分析纯,济南欧莱博生物科技有限公司);生理盐水(四川科伦药业股份有限公司);2,4 二硝基苯肼(分析纯,上海吉至生化科技有限公司);磷酸缓冲液(pH 为7.4);NaOH(0.4 mmol·L-1);HCl(0.05 mmol·L-1,10 mmol·L-1);愈创木酚、过硫酸铵、硝酸银(均为分析纯,上海易恩化学技术有限公司)。
1.2 方法
1.2.1 急性毒性实验
依据预实验和相关文献[21,22],分别设5 个质量浓度处理组:TM 为65 mg·L-1、85 mg·L-1、112 mg·L-1、146 mg·L-1和191 mg·L-1;BCM 为26 mg·L-1、34 mg·L-1、45 mg·L-1、58 mg·L-1和76 mg·L-1。采用半静水实验法,设3 个重复,每个重复放健康、活泼且体型相近的20 尾泥鳅,观察96 h,统计死亡率。每24 h 更换1 次试验试剂,若有死亡及时捞出,以保证水环境酸碱度、含氧量等性质稳定。根据最大耐受浓度和最小全致死浓度,记录泥鳅死亡情况,计算得到TM 和BCM 的LC50和安全浓度(SC)。
1.2.2 肝脏酶活性检测
将TM和BCM用去DMSO 配制为1.00 g·L-1的母液,根据急性毒性24 h 安全浓度等梯度设置TM和BCM 浓度为分别 为0.05 mg·L-1、0.50 mg·L-1、5.00 mg·L-1和0.02 mg·L-1、0.10 mg·L-1、0.50 mg·L-1、2.50 mg·L-1,并设置空白对照组与溶剂对照组(DMSO 水溶液),每组设3 个重复,每个重复中放入规格相似的泥鳅15 尾。实验周期为28 d,每24 h 更换实验试剂,每隔3 h 测定各实验组2 种药物浓度变化,保证实验浓度波动于±0.50 ng·L-1。实验第7 d、14 d、21 d、28 d 取样,观察记录泥鳅情况,有死亡泥鳅及时记录并捞出。
酶活性测定时,拍晕泥鳅,沿着泄殖孔剪开,提取肝脏组织、称量,将预冷过的生理盐水依据重量∶体积=1∶19 的比率加入,于研钵中在冰袋上研磨为组织匀浆,做好标记,以转速3 000 r/min处理20 min,取上清于干净离心管中在4 ℃冰箱中保存以便后续测定酶活性。
用愈创木酚法[23]检测POD 活性,25 ℃环境下1 mg 组织蛋白1 min 催化分解l μg 底物为1 个酶活性单位;GOT 和GPT 活性用赖氏比色法[24]检测,37 ℃环境下1 mg 组织蛋白与底物反应30 min后形成1 g 丙酮酸为1 个酶活性单位。
1.3 数据处理
在急性毒性实验中,用Excel 软件和SPSS 26.0软件,利用TM和BCM质量浓度对数值与泥鳅死亡几率制作线性回归分析方程y=ax+b,计算出24 h、48 h、72 h 和96 h TM 和BCM 对6 月龄泥鳅的LC50和24 h SC[25],计算公式为:
24 h SC=48 h LC500.3/(24 h LC50/48 h LC50)2。
在亚急性毒性实验中,数据均用平均值±标准偏差(Mean±SD)来表示,利用统计软件SPSS 20.0开展单因素方差分析,采用Duncan 法比较组间差异,使用GraphPad 8.0 作图。当0.01<P<0.05 时,用“*”标注表示处理组与对照组之间差异显著;P<0.01 时,用“**”标注表示处理组与对照组之间差异极显著。
2 结果与分析
2.1 急性毒性效应
2.1.1 TM 对泥鳅的急性毒性效应
高浓度TM 胁迫期间,泥鳅体色发红,在水中不活跃,随着暴露时长增加,泥鳅身体失衡侧翻,鱼体明显弯曲,并分泌红色黏液,最终死亡。由表1可得,TM对泥鳅LC50随时间增长而减小,泥鳅死亡数量随时间延长增加。TM 对泥鳅24 h、48 h、72 h和96 h LC50分别为35.48 mg·L-1、26.98 mg·L-1、17.25mg·L-1和10.03mg·L-1,24h 的SC为6.16mg·L-1。
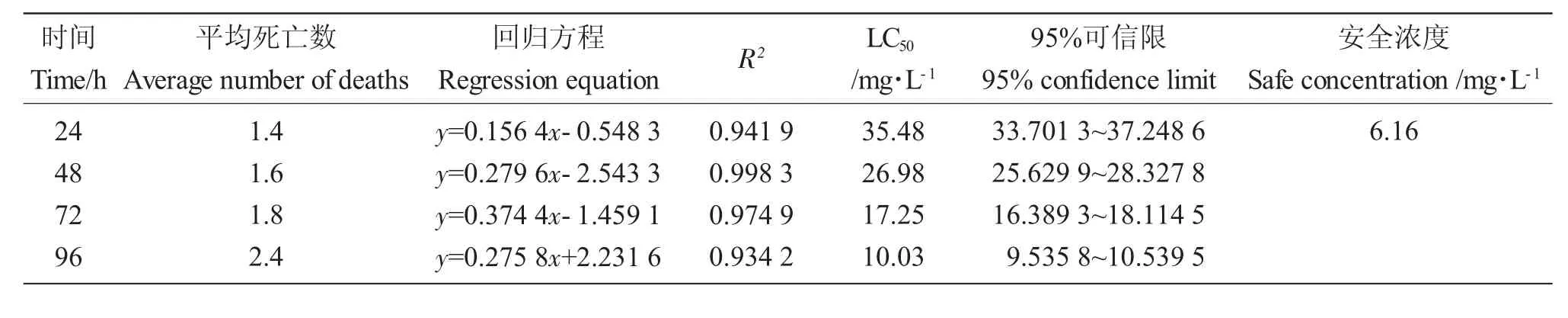
表1 TM 对泥鳅急性毒性结果Tab.1 Results of acute toxicity of TM to loach
2.1.2 BCM 对泥鳅的急性毒性效应
高质量浓度BCM组的泥鳅泄殖腔分泌黄色黏液,体表褶皱变形,在水中的兴奋性降低,对食物敏感性下降,鱼体发白逐渐死亡。BCM对泥鳅的LC50随时间增长而减小,泥鳅死亡数量随胁迫时间持续上升。BCM对泥鳅的24 h、48 h、72 h 和96 h LC50分别为23.53 mg·L-1、17.66 mg·L-1、6.54 mg·L-1和3.58 mg·L-1,24 h 的SC 为3.98 mg·L-1(表2)。
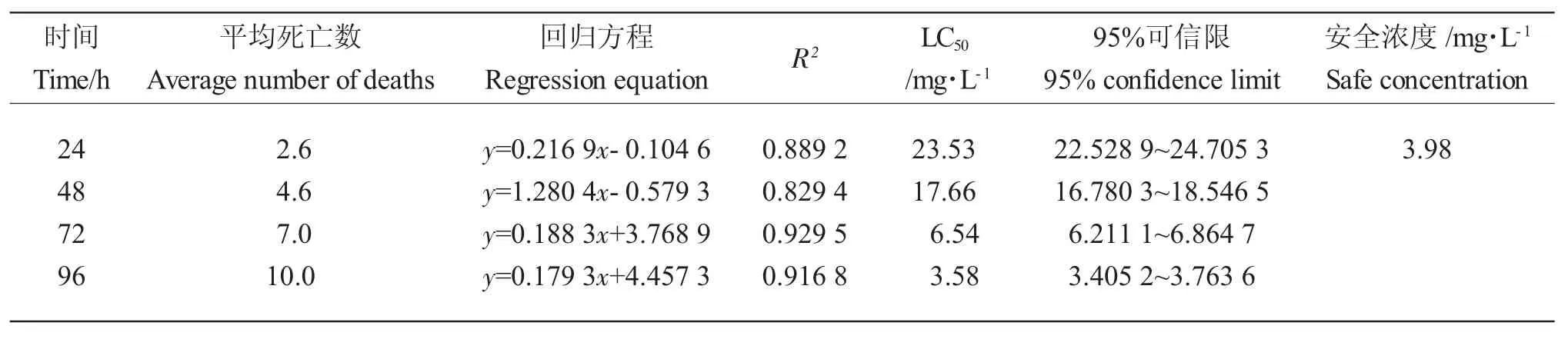
表2 BCM 对泥鳅急性毒性结果Tab.2 Results of acute toxicity of BCM to loach
2.2 2 种杀菌剂对泥鳅亚急性毒性效应
2.2.1 对泥鳅死亡数目影响
由图1 可知,空白对照组与溶剂对照组泥鳅死亡数目相同,未出现显著差异。由图1-a 可知,各TM处理组泥鳅死亡数目差异较大,胁迫7 d、14 d、21 d 和28 d 时,泥鳅死亡数目随胁迫浓度增加呈现升高趋势,其中5.00 mg·L-1浓度组死亡数目最多;由图1-b 可知,各BCM处理组泥鳅死亡数目同样差异较大,胁迫期内泥鳅死亡数目的增加与胁迫浓度存在明显剂量效应,其中2.50 mg·L-1浓度组死亡数目大于其他3 个浓度组;同一TM、BCM浓度胁迫下,泥鳅死亡数目随胁迫时间增加而升高,TM、BCM胁迫下泥鳅死亡数目表现为:7 d<14 d<21 d<28 d,整体上BCM胁迫下泥鳅死亡数目大于TM。

图1 泥鳅死亡数目随TM、BCM 胁迫时间的变化Fig.1 Changes in death member in loach liver with TM and BCM stress period
2.2.2 对肝脏POD 活性的影响
由图2-a 可知,TM 各浓度组胁迫7 d 时泥鳅肝脏POD 活性显著高于对照组,14 d 时活性达到最高,21 d 时活性明显下降,28 d 时活性最低,高浓度组(5.00 mg·L-1)POD 活性低于对照组。由图2-b 可知,BCM 各浓度组胁迫7d 时泥鳅肝脏POD活性显著高于对照组,其中0.02 mg·L-1、0.10 mg·L-1、0.50 mg·L-1浓度组胁迫14 d 时活性最高,之后下降。高浓度组(2.50 mg·L-1)在胁迫7 d 时POD 活性即达到最大值,胁迫14 d 时活性显著下降,28 d时活性最低。
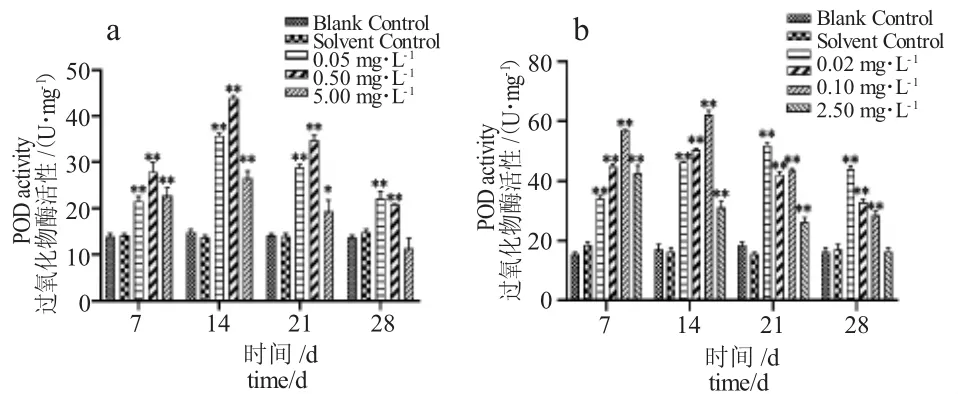
图2 泥鳅肝脏抗氧化物酶活性随TM、BCM 胁迫时间的变化Fig.2 Changes in POD activity in loach liver with TM and BCM stress period
2.2.3 对GOT 活性的影响
由图3-a 可知,TM各浓度组胁迫7 d 时泥鳅肝脏GOT 活性显著高于对照组,TM胁迫14 d 后高浓度组GOT 活性下降,胁迫28 d 时各浓度组GOT 活性均受到抑制作用,低浓度组(0.05 mg·L-1)活性最大。由图3-b 可知,与对照组相比,BCM胁迫7 d 时各浓度组GOT 活性被显著激活,胁迫28 d 时各浓度组GOT 活性被明显抑制。在不同浓度TM 和BCM胁迫时,随着胁迫浓度的增大,GOT 活性表现为低浓度时促进高浓度时抑制的现象,BCM处理组GOT 活性变化较TM处理组更敏感。
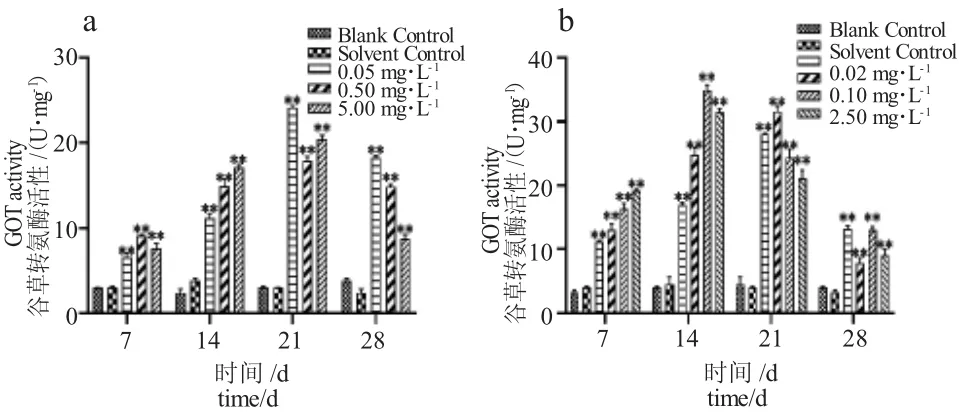
图3 泥鳅肝脏谷草转氨酶活性随TM、BCM 胁迫时间的变化Fig.3 Changes in GOT activity in loach liver with TM and BCM stress period
2.2.4 对GPT 活性的影响
由图4-a 可知,与对照组相比,TM各浓度组胁迫7 d 时GPT 活性显著升高,超出对照组活性2倍,胁迫14 d 后各浓度组GPT 活性均下降,随着浓度提升GPT 活性逐渐下降,出现明显的剂量-效应关系。由图4-b 可得,与对照组相比,BCM胁迫7 d各浓度组GPT 活性呈显著上升趋势,胁迫14 d 后活性总体下降,高浓度组(2.50 mg·L-1)28 d 时GPT活性低于对照组。
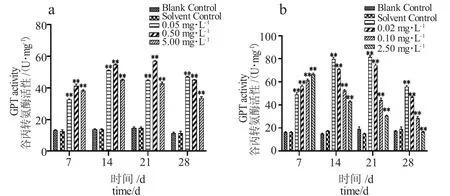
图4 泥鳅肝脏谷丙转氨酶活性随TM、BCM 胁迫时间的变化Fig.4 Changes in GPT activity in loach liver with TM and BCM stress period
3 讨论
3.1 TM 和BCM 对泥鳅的急性毒性效应
施用杀菌剂农药对水生动物有一定毒性效应,其毒性等级在评价农药毒性中扮演着重要角色。李亚梦[26]研究发现,BCM 对克氏原螯虾(Procambarus clarkii)成体具中度毒性。袁思亮[27]研究发现,有效成分为50%的BCM 和TM 悬浮剂对大型溞(Daphnia magna)分别具有中毒与低毒。依照目前农药对鱼类毒性等级分级准则:LC50(96 h)>10.0 mg·L-1的为低毒,1.0 mg·L-1<LC50≤10.0 mg·L-1的为中毒,0.1 mg·L-1<LC50≤1.0 mg·L-1的为高毒,LC50mg·L-1≤0.1 mg·L-1为剧毒[28],不同物种间毒性等级研究中可能存在一定差别,这可能与2 种杀菌剂的制剂类型、物种间差异和物种的生长阶段密切相关。在本研究中,TM 96 h LC50为10.03 mg·L-1,对6 月龄毒性等级为低毒;BCM 96 h LC50为3.58 mg·L-1,对6 月龄泥鳅毒性等级为中毒,这与熊昭娣等[29]发现有效成分22%BCM杀菌剂96 h LC50为7.64 mg·L-1,对斑马鱼毒性属于中毒的研究结果相似。
3.2 TM 和BCM 对泥鳅亚急性毒性效应
TM和BCM长期胁迫对泥鳅的影响严重,两种杀菌剂刺激泥鳅死亡数目变化趋势相似,BCM胁迫下泥鳅死亡数趋势变化更显著。TM和BCM同一时间胁迫下,泥鳅死亡数目均随胁迫浓度增加而不断增加,高浓度组死亡数持续上升;同一TM、BCM 浓度胁迫下,泥鳅死亡数目均随胁迫时间增加而升高,呈现明显时间效应。
3.2.1 TM 和BCM 对泥鳅肝脏POD 活性的影响
动物中毒时会发生氧化应激[30,31]。POD 可将H2O2转化为羟基化合物并排出体外[32],调节机体变化,维持机体稳态,广泛存在于各个组织中,尤其是肝脏。张晓红等[33]研究发现,低浓度丁草胺诱导金鱼(Carassius auratus)POD 活性,但伴随毒素积累肝脏受损其活性出现下降。本研究中,TM 胁迫7 d、14 d、21 d,泥鳅肝脏POD 活性随浓度的升高呈先上升后下降的趋势,存在明显的剂量-效应关系,说明TM对泥鳅肝脏POD 先诱导后抑制,其中高浓度组胁迫28 d,抑制作用最明显。低剂量TM虽然可以诱导POD 活性,但随着TM 在体内累积,所产生的超氧阴离子浓度超过机体承受能力,POD 活性降低。BCM胁迫14 d 0.02 mg·L-1、0.10 mg·L-1、0.50 mg·L-1浓度组活性均显著诱导,而2.50 mg·L-1胁迫14 d明显抑制POD 活性,说明高浓度BCM胁迫短时间即可使机体产生大量超氧阴离子,从而抑制POD 活性。TM和BCM胁迫一定时间后活性氧自由基的积累已远超过抗氧化酶系统清理自由氧的能力,过量的氧自由基不能被抗氧化酶及时、高效地清除掉,导致POD 活性被抑制,这与林海[34]研究氟唑菌酰胺对斑马鱼POD 影响的结果类似。
3.2.2 TM 和BCM 对泥鳅肝脏GOT 和GPT 活性的影响
GOT 和GPT 是鱼类肝脏中的主要解毒酶[35],当肝细胞发生炎症、中毒、坏死时两种转氨酶释放,因此转氨酶可作为动物毒性损伤效应的标志酶。在各组织中,GOT 在心脏中的活力最大,其次是肝脏;而GPT 则在肝脏中活力最大[36]。在氯氰菊酯胁迫下鲫(Carassius auratus)肾脏LDH 和血清GOT 活性变化研究中发现,各活性随胁迫时间的延长产生先诱导后抑制的作用[37];在亚甲基双硫氰酸酯胁迫下斑鳢(Channa maculata)肝脏GOT 活性变化中发现,一定处理时间内,高浓度胁迫GOT 活性短时间内上升,而较低质量浓度胁迫中,GOT 活性上升时间较高浓度更长[38]。本研究中,BCM比TM对泥鳅肝脏GOT活性更敏感,泥鳅肝脏GOT 活性均先上升后下降,表明两种杀菌剂低剂量胁迫诱导GOT 活性,高剂量抑制其活性,呈现明显的剂量-效应关系,干扰泥鳅肝脏GOT 平衡。在低浓度TM组GOT 活性在胁迫21 d 达到最大值,高浓度组GOT 活性胁迫14 d达到最大值,而BCM各浓度组28 d GOT 均呈下降趋势,说明伴随暴露时间增加肝脏调节能力下降,即使泥鳅一定时间后处于低质量浓度污染中,相关活性也仍旧会偏低。
GPT 抗活性氧毒性程度可作为干扰鱼氧自由基的污染物检测标志[39]。在声胁迫对斜带石斑鱼(Epinephelus coioides)的研究中发现,GPT 活性随着胁迫时间延长和强度增加而升高[40]。本研究中,两种杀菌剂胁迫下GPT 均有显著变化,TM胁迫14 d 高浓度组GPT 活性呈下降趋势,TM 胁迫会诱导泥鳅体内过氧化物过度累积,大量异常积累会诱使GPT 防御失败、活性降低。BCM胁迫7 d 各浓度组显著诱导GPT 活性,胁迫14 d 后,各浓度组GPT 活性均受抑制,当胁迫浓度高于一定程度时,体内GPT 未能及时清除机体的有害物质,导致细胞结构受到破坏,酶活性逐渐下降。泥鳅肝脏对杀菌剂应激反应中GPT 比GOT 活性变化更显著,可能是GPT 和GOT 的主要作用部位不相同所致[41]。
本文研究了两种常用杀菌剂TM 和BCM 的毒性。结果表明,TM对泥鳅的毒性等级为低毒,BCM对泥鳅的毒性等级为中毒。两种杀菌剂短期胁迫不同程度刺激泥鳅死亡,诱导POD、GOT、GPT 活性,而随着胁迫时间延长,泥鳅死亡数目持续增加,对POD、GOT、GPT 活性诱导程度减弱甚至显著抑制,并与毒物浓度呈明显剂量效应。BCM对泥鳅毒性大于TM,且水环境中一定剂量TM、BCM长期存在可能严重影响泥鳅抗氧化酶系统,在生产中应合理使用。

