套养池塘主要养殖阶段浮游生物的群落结构特征
傅建军,安睿,朱文彬,王兰梅,罗明坤,董在杰,
(1.中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业和种质资源利用重点实验室,江苏 无锡 214081;2.南京农业大学无锡渔业学院,江苏 无锡 214128)
浮游生物主要包括浮游植物和浮游动物,是水域生态系统的重要组成部分[1]。浮游植物作为水域生态系统的初级生产者,为浮游动物提供主要的营养来源,对所处水域环境变化响应敏感。浮游动物以浮游植物为食,也是鱼类的重要食物来源,在水域生态系统的食物链中起着承上启下作用,是水域环境变化的一个重要生物指标[2,3]。水域环境变化直接影响浮游生物的群落结构,目前有关河流、湖泊和水库等开放水体的浮游生物群落结构特征的研究较多[4-7],主要探究其季节性变化规律及与水体理化指标的关系等。在养殖池塘中,浮游生物群落结构特征同样与水体理化因子密切相关。李志斐等[8]研究了珠三角高产养殖池塘浮游动物群落结构,发现浮游动物群落结构与水温、光照、pH 和营养盐等非生物因素有关。宋庆洋等[9]研究发现,氮、磷是稻虾共作水体浮游植物生长的限制因子。此外,针对主要养殖阶段和特定养殖模式的池塘浮游生物群落结构特征也开展了一些研究[10-15],而针对常规淡水鱼套养池塘的浮游生物群落结构及与水体理化指标的相关性研究较少。随着长江禁捕政策的出台以及对养殖水体污染控制的要求不断提高,保质保量满足人们对水产品需求,是水产养殖业需要亟待解决的问题。池塘养殖依然是中国水产养殖的主要生产模式,鲤(Cyprinus carpio)和尼罗罗非鱼(Oreochromis niloticus)作为世界的重要水产养殖对象,在中国水产养殖中同样具有重要地位,且以池塘养殖模式为主要生产方式[16]。在养殖池塘中,通过套养鲢(Hypophthalmichthys molitrix)和鳙(H.nobilis)等滤食性鱼类,可以充分利用饵料资源和水体生态位,具有改善水体养殖环境等作用[10,17],而绿色高效养殖方式有待进一步探究。本研究通过观测和分析鲤、罗非鱼鱼种培育阶段套养鲢、鳙的池塘主要生长期内水体理化指标、浮游生物群落结构等,以期为池塘套养模式下的水质和浮游生物动态变化特征提供数据参考,并为长江中下游地区开展的养殖模式优化和提高提供基础依据。
1 材料与方法
1.1 实验材料
实验于2019 年5—9 月鱼种培育的主要生长阶段开展,在中国水产科学研究院淡水渔业研究中心宜兴屺亭科研实验基地2 口池塘,分别主养鲤(“福瑞鲤2 号”)(A 塘,约3 000 m2)和尼罗罗非鱼(“中威1 号”)(B 塘,约3 000 m2),套养鲢和鳙,采用投喂人工饲料的方式进行常规鱼种培育。于4 月下旬,在每m3水体的A 塘和B 塘(水深约2 m)中分别投放体长约2 cm 的鲤和罗非鱼6 尾;均套养鲢和鳙(100 g 左右),每10 m3各投放3 尾。在鱼苗放养15 d 后至起捕(罗非鱼移入温室)前15 d,视天气变化情况,每间隔15~25 d,选择连续晴天5 d 于上午(8:00—9:00)依次采集水样(共8 次)。
1.2 水样采集和检测
在为期150 d 的养殖期间,于5 月15 日、5 月30 日、6 月20 日、7 月11 日、7 月23 日、8 月8 日、8月21 日和9 月12 日对2 口池塘分别采集水样,共计16 个样本,依次记为T1A、T1B、T2A、T2B、T3A、T3B、T4A、T4B、T5A、T5B、T6A、T6B、T7A、T7B、T8A和T8B。水样采集中,考虑到池塘中水体理化指标和浮游生物可能受风向等因素影响,每次采样分别采集池塘5 个点(4 个边的中点离岸0.5 m 和池中心,水下0.5 m 处)进行混样用于水体理化指标检测和浮游生物观察。
池塘水温(TEM)和酸碱度(pH)使用便携式pH计现场测定,化学需氧量(COD)用重铬酸盐法(GB/T11914-1989)测定;氮循环中总氮(TN)、氨氮(NH4+-N)和亚硝酸氮(NO2--N)含量分别采用碱性过硫酸钾消解紫外分光光度法(GB/T11894-1989)、纳氏试剂比色法(GB/T7479-1987)和N-(1-萘基)-乙二胺光度法(GB/T13580.7-1992)测定;总磷(TP)含量采用钼酸铵分光光度法(GB/T11893-1989)。
1.3 浮游生物采集和测定
浮游植物检测中,取1 L 水样用1%的鲁哥氏液固定,样品带回实验室静置24 h 后,通过虹吸管取上清液,浓缩至30 mL,用于鉴定计数。浮游动物定量样品采集20 L 水样,经25 号(200 目,孔径64 μm)浮游生物网过滤浓缩,放入50 mL 塑料瓶中加入5%福尔马林溶液固定后,样本带回实验室静置沉降、浓缩后计数。浮游生物鉴定中,对每个样本均检测3 次取均值。
浮游生物分类参照《中国淡水藻类》[18]和《淡水微型生物图谱》[19]。浮游植物和浮游动物定性样品分别采用25 号和13 号(125 目,孔径为112 μm)浮游生物网在水中做“∞”形回旋3 min,采集样品,将网内浓缩液置于100 mL 塑料水样瓶中,分别用1%的鲁哥氏液和5%的福尔马林溶液固定,带回实验室显微镜下观察分类。
1.4 数据分析
利用Excel 软件整理水质理化指标数据和浮游生物数据、绘制趋势图和柱状图;用SPSS 22.0(IBM Corp.,Armonk,NY,USA)进行两两组间差异分析(T检验)、单因素多组方差分析(F 检验)和组间多重比较(Duncan 法)。基于浮游生物的密度计算各物种优势度(Y),公式如下:
式中,ni为第i 个浮游植物(或浮游动物)种类的个体数,N 为浮游植物(或浮游动物)总数;fi是第i 个物种在各样本中出现的频率;将Y>0.02 的浮游生物确定为优势种。
利用vegan 包(https://CRAN.R-project.org/package=vegan)分析各水样的α 多样性(计算Shannon-Weiner 指数H'、Simpson 指数D 和Pielou 物种均匀度J)、去趋势对应分析(Detrended correspondence analysis,DCA)和主成分分析(Principal component analysis,PCA);结合水体理化指标和浮游生物丰度数据开展冗余分析(Redudancy analysis,RDA),在构建各理化因子回归模型的过程中采用向后选择法进行校正,依次剔除共线性因子,并基于AIC 确定最佳模型;利用ggplot2 包[20]绘制PCA 和RDA 的散点图;利用pheatmap 包(https://CRAN.R-project.org/packag e=pheatmap)绘制热图,热图尺度为优势度的Z-score 校正值,样本聚类采用欧氏距离(Euclidean distance)。上述工具包在R 程序(https://www.r-project.org)运行。
2 结果与分析
2.1 水体理化因子变化与分析
实验期间,水温范围为23.0~35.8 ℃,pH 介于7.33~7.87 之间,其他理化指标如表1 所示。单因素方差分析显示,各时期间2 个池塘的各理化指标差异极显著(P<0.01)。整体而言,总氮和氨氮浓度呈上升趋势,养殖中后期趋于稳定;养殖期间亚硝酸氮浓度较低,总磷呈先上升、后下降的趋势,其中2 个池塘总氮和总磷的含量变化趋势如图1 所示。

表1 不同采样时期池塘水体理化指标的变化(均值±标准差)Tab.1 Changes in physicochemical indices in the test ponds during different sampling periods (Mean±SD)

图1 不同池塘在试验期间总氮(a)和总磷(b)浓度的变化曲线Fig.1 Line plots of total nitrogen (a) and total phosphorus (b) concentrations in different ponds
2.2 浮游生物群落结构及物种多样性
本实验共检测到浮游植物8 门77 属179 种,其中绿藻39 属106 种,占物种总数的59.22%;蓝藻13 属23 种,占12.85%;硅藻12 属21 种,占11.73%;裸藻4 属18 种,占10.06%;甲藻4 属4 种,占2.23%;隐藻2 属2 种,占1.68%;金藻2 属3 种,占1.68%;黄藻1 属1 种,占0.56%。本实验共检测到浮游动物72 种,其中枝角类20 种,占27.78%;桡足类11 种,占15.28%;轮虫30 种,占41.67%;原生动物11 种,占15.28%。各水样不同门类浮游生物的群落结构比例见图2 所示。其中,浮游植物主要以蓝藻门和绿藻门为主;浮游动物主要以轮虫类和原生动物为主,桡足类最少。养殖后期,桡足类的密度更少。对16 个水样浮游生物丰度的α 多样性分析表明(表2),池塘Shannon-Wiener 指数介于2.535~3.457 之间;Simpson 指数介于0.800~0.957 之间;种类均匀度(Pielou)介于0.573~0.772 之间。
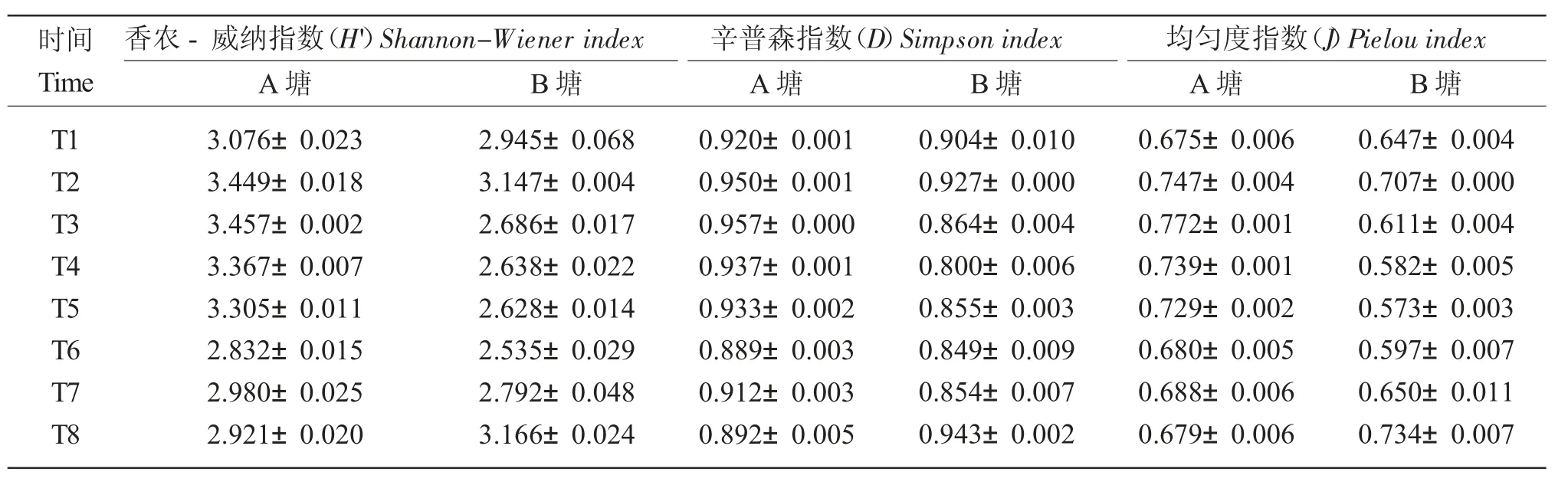
表2 浮游生物生物多样性指数变化(均值±标准差)Tab.2 Changes in the diversity index of plankton in the polyculture ponds (Mean ± SD)
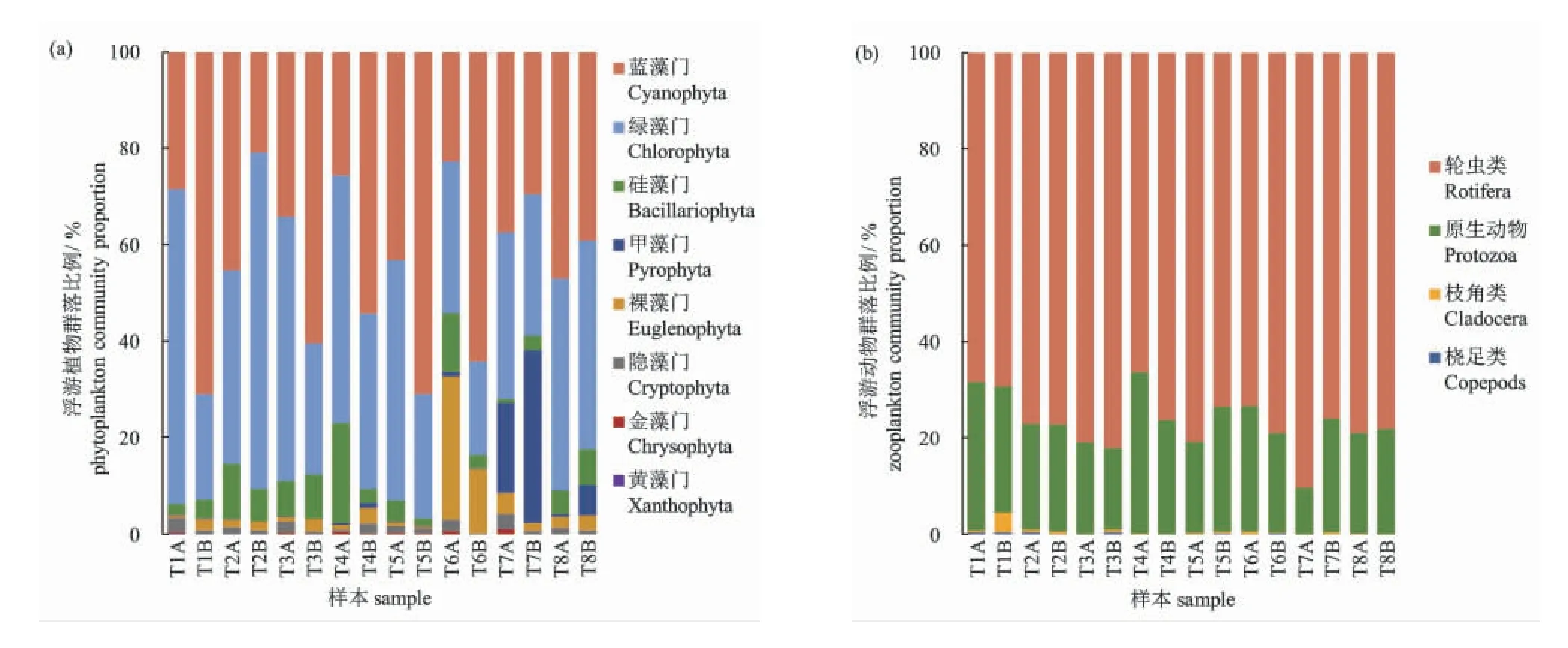
图2 不同水样的浮游植物(a)和浮游动物(b)群落结构Fig.2 Community structure of phytoplankton (a) and zooplankton (b) in different water samples
2.3 不同养殖阶段浮游生物时序性变化
基于浮游生物密度数据的主成分分析(图3-a)发现,相近时期样本聚类较近,说明养殖过程浮游生物的群落结构呈现明显的时序性变化。根据PCA结果,主要养殖阶段大致可分为3 个时期,即早期(T1 和T2,记为P1)、中期(T3、T4 和T5,记为P2)和后期(T6、T7 和T8,记为P3)。依据上述3 个时期(P1、P2 和P3)的划分,共发现45 种浮游生物(28 种浮游植物,17 种浮游动物)在至少1 个时期的优势度Y>0.02,整个养殖阶段优势度最高的3 种浮游植物依次为细小平裂藻(M.tenuissima)(0.102)、微小平裂藻(M.minima)(0.036)和伪鱼腥藻(Pseudanabaena sp.)(0.031);整个养殖阶段优势度最高的3种浮游动物依次为针簇多肢轮虫(Polyarthra trigla)(0.291)、裂痕龟纹轮虫(Anuraeopsis fissa(0.129)和暗小异尾轮虫(Trichocerca pusilla)(0.106)。基于这45 种浮游生物优势度进行热图和聚类分析(图3-b),结果显示样本能依据时序聚为3 个分枝;此外,可以直观发现不同时期的浮游生物优势度分布存在差异。

图3 基于各水样浮游生物丰度值的PCA 散点图(a)和热图(b)Fig.3 PCA scatter plot (a) and heat map (b) based on plankton abundance values in each water sample
上述45 个浮游生物的优势度差异分析表明,20 种浮游生物的优势度呈现出两两时期间显著性差异(P<0.05,表3)。其中,微囊藻(Microcystis sp.)在3 个时期的优势度间均存在显著差异(P<0.05),其优势度随着养殖进程逐渐升高;而双尾栅藻(Scenedesmus bicaudatus)的优势度变化趋势为随着养殖进程逐渐降低,养殖后期(P3)的优势度显著低于早期(P1)和中期(P2)(P<0.05)。此外,水华束丝藻(Aphanizomenon flosaquae)、双对栅藻(S.bijuga)、四尾栅藻(S.quadricauda)和二角盘星藻(Pediastrum duplex)在养殖早期(P1)的优势度显著高于中期(P2)和后期(P3)(P<0.05);变异直链藻(Melosira varians)、双尾栅藻小型变种(S.bicaudatus var.parvus)和转板藻(Mougeotia sp.)在养殖后期(P3)的优势度显著高于早期(P1)和中期(P2)(P<0.05);铜线形十字藻(Crucigenia fenestrata)和双尾栅藻四棘变种(S.bicaudatus var.quadrispina)在养殖中期(P2)的优势度显著高于早期(P1)和后期(P3)(P<0.05);而直角十字藻(Crucigenia rectangularis)在养殖早期(P1)和后期(P3)的优势度显著高于养殖中期(P2)(P<0.05)。
2.4 浮游生物群落变化的驱动因子分析
16 个样本浮游生物密度的DCA 分析表明,最大轴长为2.42(小于3),适合线性模型的RDA 分析。基于RDA 分析的最佳回归模型,剔除存在显著共线性的因子,最终保留对本研究阶段浮游生物变化最具影响的理化因子,发现亚硝酸氮和总氮浓度与池塘浮游植物丰度相关性较强(图4-a),水温、pH 和亚硝酸氮浓度与实验池塘浮游动物丰度相关性较强(图4-b)。为了进一步揭示各水体理化因子对特定优势种的影响,开展了20 个优势种(3 个养殖时期间优势度变化显著的浮游生物)密度与水体理化因子的相关性分析,发现其中14 种浮游生物的密度与水体理化因子间存在显著线性关系(P<0.05,表4)。其中,微囊藻、变异直链藻、美丽盘藻(Gonium formosum)、直角十字藻、双尾栅藻小型变种和转板藻的密度与总氮呈正相关;双尾栅藻和四尾栅藻四棘变种(S.quadricauda var.quadrispina)的密度与总氮呈负相关。
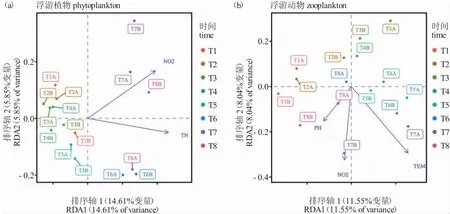
图4 浮游植物(a)和浮游动物(b)群落结构与理化因子RDA 分析结果Fig.4 RDA analysis between phytoplankton (a) and zooplankton (b) community structure and physicochemical factors
3 讨论
3.1 水体理化理化指标和浮游生物群落变化
水体理化指标不仅影响养殖鱼类的生存和生长,也是维持养殖水体稳定的重要组成[21]。本研究中,养殖中后期池塘的水质属富营养型,较适宜于浮游生物的繁殖,这与实验周期处于养殖鱼类主要生长季节有关。鲤和罗非鱼摄食能力较强,养殖期间投喂饲料较多,通过残饵和鱼类排泄物等将氮、磷元素带入水体[22,23]。在养殖后期各项理化指标下降或上升减缓,这与水温逐渐降低导致鱼类摄食、排泄等生命代谢活动减弱以及套养鲢、鳙摄食浮游生物转化营养盐有关。依据多样性指数对水质的评价标准[24],本实验养殖水体具有丰富或较丰富的浮游生物种类,但是,在养殖中后期存在富营养化和水体理化指标较高等问题,这需要引起重视。因此,认为常规套养鲢鳙的高密度池塘养殖模式,在控制水体富营养化方面的效果,还存在进一步优化的空间。
池塘养殖中,浮游生物群落结构往往呈现明显时空变化特征[1,5,12,23]。本研究中,浮游生物优势种及其密度存在明显的时序性变化,尤以浮游植物的变化更为明显。本实验套养池塘的浮游植物以绿藻门和蓝藻门为主,与宋庆洋等[9]在稻虾共作水体和张晓蕾等[14]在循环流水养殖水体中发现的浮游植物组成结构相似,这可能与养殖水体营养盐浓度的波动范围相近有关。而在养殖过程中,浮游植物的增殖又受到诸多因素影响。在养殖前期,光照增强、营养盐增加及鱼类排泄物增多促进了浮游植物的繁殖[25]。随着养殖鱼类的生长,对浮游植物摄食压力增加,会抑制其生物量的进一步增长。本实验池塘浮游动物趋于小型化,以轮虫和原生动物占优势。这与杨建雷等[10]在混养池塘和李学梅等[11]在池塘养殖中的研究结果类似,分析是由于鲢鳙等滤食性鱼类对枝角类和桡足类及大型轮虫具有更强的摄食压力导致。
3.2 浮游生物群落变化与驱动因子分析
冗余分析表明,影响浮游植物和浮游动物群落结构变化的主要理化因子存在差异。浮游植物作为初级生产者,对水环境因子较为敏感;水环境因子中氮磷营养盐浓度是影响浮游植物生长的关键因子[26]。陈思等[12]研究发现,营养盐、盐度和pH 是影响虾蟹混养池塘浮游植物群落结构特征的主要环境因子。本研究发现,亚硝酸氮和总氮浓度是影响浮游植物丰度的主要环境因子,验证了氮元素是池塘养殖中浮游植物动态变化的重要驱动因子。结合浮游生物与理化指标的关联分析不难发现,水温和磷元素同样显著影响部分浮游植物的丰度。浮游动物的种群结构和分布同样受环境因子影响,如适宜的水温促进浮游生物生长和繁殖,影响水体浮游动物的群落结构特征。浮游动物的变化还受到养殖鱼类投喂、摄食和生命活动等影响,其中包括鱼类对浮游植物(上行效应)和浮游动物的摄食(下行效应)等[10,11,23]。李志斐等[8]发现,高产养殖池塘的TP和pH 是影响浮游动物群落结构的主要因素。本研究发现,pH、水温和亚硝酸氮的浓度是影响池塘浮游动物动态变化的主要因素。
不同研究发现水体理化因子对浮游生物影响效应存在差异,可能与相应水体具有不同本底条件有关。如某些理化因子对浮游生物的生长和繁殖具有重要作用,但在相应水体和实验期间较稳定,研究中就难以揭示其重要性和相关性。就具体环境因子和浮游生物丰度的关联性分析结果而言,对特定环境因子较敏感的物种,有望作为指示物种应用于水质调控等养殖管理过程。
3.3 结论与展望
本研究发现,长江中下游地区套养池塘主要养殖阶段的浮游生物群落结构存在明显的时序性变化特征;养殖阶段水体理化指标变化较快、差异较大,浮游生物的优势种对各水体理化指标的响应程度不一。研究结果可为所在地区套养池塘的水质监测和调控及管理提供数据参考。本研究在池塘数量和养殖周期等方面还存在一定局限性,在后续的研究中建议增加池塘(或养殖模式)的数量,延长实验周期,进一步探讨池塘养殖下浮游生物的变化规律及与理化因子的关系。

