虾肝肠胞虫极管蛋白3 的鉴定
于志君,王李宝,史文军,黎慧,胡润豪,赵然,沈辉,管小平,万夕和
(1.江苏省海洋水产研究所,江苏 南通 226007;2.上海海洋大学水产科学国家级实验教学示范中心,上海 201306;3.伊犁悦然生态农业有限公司,新疆 伊犁 835300)
虾肝肠胞虫(Enterocytozoon hepatopenaei,EHP)最早发现于泰国养殖的斑节对虾(Penaeus monodon)中,是寄生在对虾肝小管上皮细胞内[1-3]的微孢子虫。近年来,EHP 感染南美白对虾(Litopenaeus vannamei)的报道越来越多,可引起南美白对虾生长缓慢,规格不齐,严重影响南美白对虾养殖效益。微孢子虫含有一个由锚定盘、极质体和单个极管组成的独特侵染器官——极管[4],侵染过程从孢子萌发开始,然后极管外翻弹出,刺穿宿主细胞膜,最后将孢原质注射到靶细胞中[5]。极管作为一种独特的侵染结构,在EHP 感染宿主的过程中起到输送孢原质的重要作用。探究极管蛋白的生物学特性、挖掘潜在的极管蛋白类型对于分析虾肝肠胞虫入侵机制具有重要意义。1894 年,Thelohan 描述了微孢子虫极管特点及其释放过程[6]。目前已有6 种不同的极管蛋白(PTP1-PTP6)被鉴定为微孢子虫极管的主要成分[7-11]。克隆和氨基酸分析表明,占极管总蛋白70%的PTP1 具有高强度的张力和弹性,有利于极管的弹出以及孢原质的输送[8,12]。虽然不同种属微孢子虫的PTP2 拥有差异较大的氨基酸序列,但它们具有相似的等电点、高含量的赖氨酸和高度保守的半胱氨酸位点[13]。利用免疫筛选技术从Encephalitozoon cuniculi cDNA 文库中鉴定到了第三种极管蛋白(PTP3)。该蛋白可以与前两种蛋白形成复合体相互作用。利用蛋白质组学等技术筛选鉴定到第四个极管蛋白-PTP4。在筛选E.cuniculi 基因组序列时发现了编码另外一个极管蛋白(PTP5)的基因。该基因与编码PTP4 的基因序列相似,与PTP4 定位于同一个染色体形成了一个新的基因簇。最近,LV等[11]又在家蚕微孢子虫(Nosema bombycis)体内发现了一种可与宿主细胞表面结合的新的极管蛋白—PTP6。迄今为止,对于家蚕微孢子虫极管蛋白的研究已经非常成熟,鉴定了6 种极管蛋白。对于虾肝肠胞虫极管蛋白的研究鲜有报道,只鉴定到了一种极管蛋白-EHPPTP2 的序列。本研究通过克隆南美白对虾虾肝肠胞虫极管蛋白3(EHPPTP3)基因,对其进行了生物信息学分析,通过原核表达获得重组蛋白制备多抗,免疫荧光试验验证了EHPPTP3 的存在,为进一步探明极管蛋白在EHP 侵染宿主过程中的作用机制提供新的线索和思路,同时为EHP 的检测以及虾肝肠胞虫病的预防和治疗提供新的靶标。
1 材料与方法
1.1 材料和主要试剂
EHP-NMB2019011 株(实验室命名)从江苏如东患病南美白对虾中分离获得,原核表达载体选用苏州强耀生物科技有限公司的pET-28a(+),超敏型辣根过氧化氢酶DAB 显色试剂盒和总RNA 快速提取试剂盒购自TaKaRa 公司,蛋白质Marker 和相关免疫荧光染料购自赛默飞(Thermofisher)公司。其他试剂参照LV 等所用试剂[11-14]。
1.2 总RNA 提取和cDNA 第一链合成
使用总RNA 快速提取试剂盒提取样品总RNA;再使用cDNA 第一链合成试剂盒(上海生工)进行反转录,所制得cDNA 于-20 ℃储存,为后续PTP3 基因克隆备用。
1.3 PTP3 基因克隆
1.3.1 PTP3 基因cDNA中间片段克隆及RACE 实验
以虾肝肠胞虫全基因组(GenBank 登录号:GCA_023079535.1)[15]中A0755 基因中630~4 000 bp序列为模板,设计PTP3 核心序列引物MF/MR(表1)进行中间片段克隆。产物经测序验证后,按照孙金秋等(2020)所述方法[16],设计特异性引物用于5’端和3’端的RACE 实验(表1)。反应完成后,进行电泳验证,克隆测序以及序列拼接,获得PTP3 基因的完整序列。

表1 实验所用引物Tab.1 Primers used in the experiment
1.3.2 PTP3 基因核心区段的克隆及原核表达
以PTP3 核心序列的部分区段(909 bp)为模板,使用Primer 5 软件设计克隆引物(PTP3F/R)构建PTP3 原核表达载体,所得产物于4 ℃保存。然后用BamH I、Xho I 和pET28a 进行双酶切和载体构建,并进行感受态细胞转化和阳性克隆检测[17],送上海生工测序。
1.4 生物信息学分析
利用NCBI 数据库和不同的软件(表2)对EHP PTP3相关数据进行不同层次的生物信息学分析。

表2 生物信息学分析软件Tab.2 Bioinformatics analysis software
1.5 EHP PTP3 基因编码蛋白诱导表达及纯化
取重组载体pET28a-PTP3 转化入Rosetta(DE3)感受态中,结合李孝良等[18]方法挑取单克隆进行后续诱导表达纯化。利用LB 培养基和ITPG 进行诱导表达,并通过破菌缓冲液和NTA 层析柱进行超声破菌和纯化。最后利用凝胶电泳检测所收集的不同组别的成分,合并符合目标蛋白的成分并进行超滤浓缩。
1.6 多克隆抗体制备
纯化的原核表达PTP3 蛋白作为免疫抗原,分装保存于4 ℃。第1 d,混合Freund adjuvant 和抗原(1 mL∶1 mL),乳化后注射到颈后部位,免疫2 只新西兰白兔。按照2 周时间间隔进行4 次免疫,每次免疫完成后第10 d 从兔耳缘静脉采集1 mL 血液,检测效价。经检测确认后,再采兔颈动脉全血静置过夜后,离心(4 ℃,10 000 r/min)30 min 取多抗血清,分装并在-20 ℃下保存。
1.7 抗体效价测定
用碳酸盐包被缓冲液(CBS)将EHPPTP3 蛋白(抗原)稀释至1 μg/mL,以每孔100 μL 的量加入酶标板,4 ℃过夜。24 h 后丢弃涂层溶液,在每孔加入200 μL 密封溶液(5%脱脂奶粉),37 ℃放置90 min。按照ELISA 试剂盒的操作步骤进行实验,最后加入终止液:每孔加入2 mol/L H2SO450 μL,终止反应。参照李孝良等[17]用酶标仪和比对公式计算出该抗体效价。
1.8 Western blotting 分析
分别取经PCR 检测验证[5]后的感染EHP 和未感染EHP 的南美白对虾肝胰腺组织、纯化的EHP孢子悬液(1 mL)。用PBS(pH 7.4)洗涤3 次,5 000 r/min 离心5 min,弃上清[18]。重悬沉淀后(400 μL PBS),加入Sigma 酸洗玻璃珠0.4 g(425~600 μm)和适量蛋白酶抑制剂PMSF,4 800 r/min 破碎6 次,每次60 s。用0.125 mol/L Tris-HCl,5%SDS,50%甘油和5%β-巯基乙醇配制适量的样品缓冲液,取300 μL 充分混匀并在4 ℃孵育6 h。离心10 min(4 ℃,12 000 r/min)所得上清就是EHP 总蛋白[19,20]。通过电泳(12%SDS-PAGE)把总蛋白转移至PVDF 膜。用3%BSA 室温封闭1 h,按1∶15 000 稀释(V∶V)的PTP3 抗血清与PVDF 膜在4 ℃孵育过夜[16]。PBST 洗涤产物3 次后,利用超敏型HRP DAB 试剂盒进行显色反应。
1.9 免疫荧光实验
用载玻片把感染EHP 的虾肝胰腺组织固定,用磷酸盐缓冲溶液(1×PBS)清洗3 次(5 min/次);滴加封闭液覆盖组织,放入37 ℃水浴箱,封闭45 min;把封闭液小心倒出并加入一抗(EHP 多抗)4 ℃过夜;重复洗涤一抗3 次后避光孵荧光二抗,AlexaFlour488 和Cy3 按照1∶400 稀释标记二抗后,室温避光孵育2 h;最后洗去二抗,避光封片,记录实验结果。
2 结果与分析
2.1 EHPPTP3 鉴定及序列结构特征分析
2.1.1 目的基因鉴定
克隆得到的EHPPTP3 序列全长为4 030 bp,CDS 区长度为3 390 bp,两端均存在UTR。其中,5’UTR 长度为345 bp,3’UTR 长度为294 bp。将此序列提交至NCBI 进行Blastx,比对出1 个EHPPTP3的氨基酸序列(GenBank 登录号:OQS53455.1)。将此序列上传至GenBank 获得登录号为ON206665。
2.1.2 序列比对分析
将获取的序列与NCBI 数据库中的3 个不同种属PTP3 序列(虾肝肠胞虫PTP3,GenBank 登录号:OQS53455.1;兔脑炎微孢子虫PTP3,GenBank 登录号:AGW15357.1 和家蚕微孢子虫PTP3,GenBank登录号:AEF33802.1)进行多序列比对。结果显示,EHPPTP3 与虾肝肠胞虫PTP3 序列相似度(identity percent)极高,为97.95%;与其他微孢子虫PTP3 之间的氨基酸序列相似度较低,均低于21%(图1-A);通过NCBI 的Batch CD-Search 工具,发现其中家蚕微孢子虫PTP3(GenBank 登录号:AEF 33802.1)存在保守结构域。后续从NCBI 数据库中选择多个不同种属PTP3 序列,采用Neighbor-joining 法来构建系统进化树,建树的bootstrap 取值为1 000 个重复。进化树结果显示,EHPPTP3 与虾肝肠胞虫PTP3 序列聚为一支,再次印证了本研究中的EHPPTP3 与OQS53455.1 亲缘关系较近,而与其他微孢子虫PTP3 亲缘关系较远(图1-B)。

图1 氨基酸序列比对(A)和系统发育树(B)Fig.1 Amino acid sequence alignment(A)and phylogenetic tree(B)
2.1.3 编码氨基酸序列的N-糖基化位点和磷酸化位点以及三级结构预测
EHPPTP3 由1 130 个氨基酸组成,预测分子质量为125 kD,等电点为4.84,无信号肽区域。预测具有13 个潜在的N-糖基化位点和558 个O-糖基化位点(图2)。

图2 EHPPTP3 蛋白的N-糖基化位点预测Fig.2 Prediction of N-glycosylation site in EHPPTP3 protein
磷酸化位点预测发现,苏氨酸、丝氨酸和酪氨酸磷酸化位点分别有71 个、37 个和9 个(图3)。

图3 EHPPTP3 蛋白磷酸化位点预测Fig.3 Phosphorylation site prediction of EHPPTP3 protein
二级结构预测表明,α 螺旋占41.77%,延伸链占12.48%,无规卷曲占39.29%,而β 转角占6.46%。三级结构预测表明,EHPPTP3 主要有α 螺旋和无规卷曲,结构较为简单(图4)。

图4 EHPPTP3 蛋白序列的三级结构预测Fig.4 Tertiary structure prediction of EHPPTP3 protein sequence
2.2 PTP3 的克隆与原核表达载体的鉴定
用PCR 方式克隆EHPPTP 基因的部分片段,获得一条符合预期目标的909 bp 条带,预测蛋白分子量为33.5 kD(图5)。参考李孝良等(2017)方法[17],将pET28a 与扩增产物连接,进行原核表达载体的鉴定。测序比对结果表明,未出现碱基突变,原核表达载体构建成功。

图5 pET28a 质粒双酶切图及重组质粒pET28a-PTP3 的酶切产物图Fig.5 Electrophoretogram of double enzyme digestion of pET28a and double enzyme digestion analysis of pET28a-PTP3 recombinant plasmid
2.3 EHPPTP3 基因蛋白的诱导表达、纯化与鉴定
SDS-PAGE 检测经超声波处理和诱导表达的菌体(0.5 mmol/L ITPG 20 ℃诱导12 h)上清液和沉淀。上清液中含有接近目标蛋白质大小的条带(图6),说明EHPPTP3 蛋白的存在形式主要为可溶性物质。
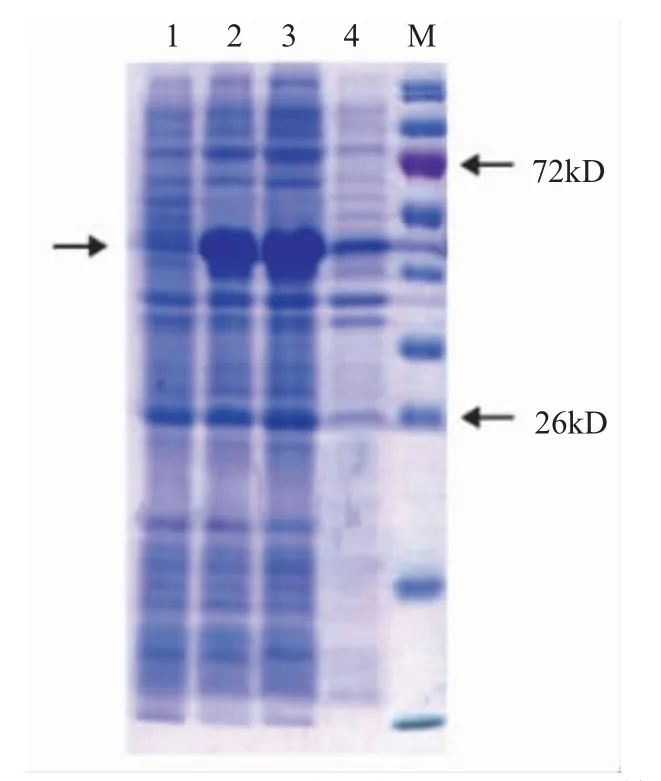
图6 EHPPTP3 蛋白表达的SDS-PAGE 检测Fig.6 SDS-PAGE detection of expression of EHPPTP3 protein
对EHPPTP3 蛋白进行大量诱导表达,超声波破碎、离心后,选择上清液,利用NTA 层析柱纯化目的蛋白。咪唑浓度梯度洗脱后,挑取高纯度部分合并,超滤浓缩。最终获得高纯度PTP3 蛋白,大小约43 kD,符合理论值(图7)。Western blot(WB)检测后确定纯化蛋白为目的PTP3 蛋白(图8)。
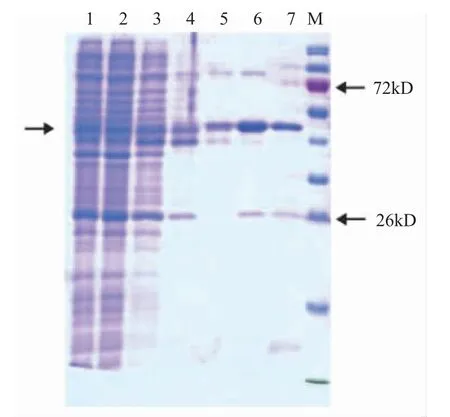
图7 不同咪唑浓度下EHPPTP3 蛋白表达的SDS-PAGE检测Fig.7 SDS-PAGE detection of expression of EHPPTP3 protein in different imidazole concentrations

图8 纯化蛋白的WB 检测Fig.8 Western blot analysis of purified protein
2.4 EHPPTP3 多克隆抗体的验证
免疫印迹法验证PTP3 多抗的特异性结果显示,被EHP 感染组织和纯化到的EHP 孢子悬液中与健康组织相比均获得更为明显的PTP3 目标条带(图9),说明制备的PTP3 多抗特异性良好。

图9 EHPPTP3 多克隆抗体验证Fig.9 Verification of EHPPTP3 polyclonal antibody
2.5 免疫荧光试验
为验证EHPPTP3 是否为虾肝肠胞虫极管蛋白,将感染EHP 的虾肝胰腺组织固定封闭加入一抗二抗孵育。结果发现,利用EHPPTP3 多克隆抗体开展的免疫荧光试验成功捕获了肝肠胞虫在侵染过程中极管的弹出状态,离EHP 顶端不远处存在强红色荧光分布(图10)。EHPPTP3 多抗特异性识别极管表面的抗原表明可引起免疫反应。该结果证实EHPPTP3 天然蛋白在虾肝肠胞虫弹出的极管上真实存在,是新鉴定出的虾肝肠胞虫极管蛋白,确认了EHPPTP3 的存在。
3 讨论
EHP 主要寄生在南美白对虾、斑节对虾等肝胰腺中,尽管它并非致命性病原,但传染性很强,可在虾池中通过水平传播和垂直传播,导致对虾生长滞缓,经济损失严重[21-24]。EHP 属于肠胞虫科,与毕氏肠微孢子虫的Small Subunit rRNA 基因有84%的一致性[1]。和其他微孢子虫一样,EHP 生活史也涉及感染性孢子的萌发、增殖和成熟、释放[21,25]。在孢子萌发阶段,EHP 产生单核的0.7 μm×1.1 μm 卵圆形孢子母细胞,孢子内含4~6 圈极丝等其他结构[1]。在一定的环境刺激下,极丝可被挤压弹出,此时其为极管。
极管作为独特的侵染器官,可以把孢原质透过细胞膜传递到宿主细胞[26]。本文对于EHPPTP3 的研究,可以更好地分析极管蛋白的组成以及进一步探索微孢子虫的感染机制。目前已经报道有6 种不同的极管蛋白(PTP1-PTP6)被鉴定为微孢子虫极管的主要成分[7-11]。其中,Peuvel 等[10]利用免疫筛选技术从Encephalitozoon cuniculi cDNA 文库中鉴定到了第三种极管蛋白(PTP3),而本文则通过同源性比对筛选到了虾肝肠胞虫极管蛋白3 的序列,利用序列分析和定位特征初步鉴定了虾肝肠胞虫极管蛋白3。
3.1 EHPPTP3 的序列特征
序列特征分析表明,本研究获得的极管蛋白3与王礼君[27]所鉴定的EHPPTP2 相似,具有高比例的丝氨酸和苏氨酸磷酸化位点,可以变构蛋白质以及激活蛋白的活力;不同的是:该极管蛋白3 不具有N 端信号肽,其或许并不发挥引导蛋白质的功能,因为蛋白质在细胞内的运输往往需要信号肽的指引。本研究中的PTP3 具有较多的酪氨酸磷酸化位点,与Peuvel 等[10]筛选到的Encephalitozoon cuniculi PTP3 相同。它的功能是变构并激活蛋白,更重要的是提供一个结构基因,以促进和其他蛋白质相互作用而形成多蛋白复合体[28,29]。该蛋白的氨基酸数目为1 130 个,预测蛋白质分子质量为125 kD,磷酸化位点等方面均符合极管蛋白3 的保守特征。值得注意的是,该蛋白具有许多潜在的糖基化位点,作为一种最常见的蛋白翻译后修饰,这些位点的糖基化可以让一些多肽改变构象,也可使蛋白增强稳定性。因此本文推测,该蛋白是虾肝肠胞虫极管蛋白3,且或许可与PTP1-2 形成复合体,并发生相互作用。
3.2 EHPPTP3 的定位特征
Western blot 实验结果表明,制备的PTP3 多克隆抗体可以在被EHP 感染组织和纯化到的EHP 孢子悬液中表达,产生阳性条带,具有良好的特异性(图9)。定位特征分析表明,利用制备的EHPPTP3多克隆抗体进一步开展的免疫荧光试验,成功捕获了肝肠胞虫在侵染过程中极管的弹出状态(图10),表明了EHPPTP3 多抗可以特异地识别极管表面的抗原并与之发生免疫反应,揭示了极管蛋白3 定位于EHP 的整根极管上(红色荧光),证明它是在EHP 上鉴定出的一种新的极管蛋白——虾肝肠胞虫极管蛋白3(EHPPTP3),为EHP 的检测以及虾肝肠胞虫病的预防和治疗提供新的靶标。
3.3 结论
本研究通过同源性比对发现了南美白对虾肝肠胞虫极管蛋白3 的序列,并利用相关生信分析软件分析了其序列,阐述了其分子量、氨基酸组成、信号肽、糖基化和磷酸化位点等特征。克隆到了PTP3基因,成功构建了PTP3 的原核表达载体pET28a-PTP3,通过诱导表达和纯化获得了大量PTP3 蛋白,并通过免疫新西兰白兔制备了特异性较好的PTP3多克隆抗体;利用SDS-PAGE 和Western blot 实验分析了目的基因原核表达蛋白的表达特征,验证了PTP3 多克隆抗体的特异性。利用EHPPTP3 多克隆抗体开展免疫荧光试验,成功捕获肝肠胞虫在侵染过程中极管的弹出状态,揭示PTP3 在南美白对虾肝肠胞虫上的定位特征。综合以上PTP3 的序列特征,蛋白表达特征,多抗特异性以及定位特征证实PTP3 即为EHP 极管蛋白3(EHPPTP3),是虾肝肠胞虫中鉴定出的一种新的极管蛋白。

